微流控芯片上电色谱聚合物整体柱研究进展
2013-12-03郑晖李秋顺马耀宏高广恒史建国
郑晖,李秋顺,马耀宏,高广恒,史建国
(山东省生物传感器重点实验室,山东省科学院生物研究所,山东济南250014)
微流控芯片(microfluidic chip)是上世纪 90年代初 Manz等[1]提出的以微机电系统(microelectromechanical systems,MEMS)技术为基础的微全分析系统(miniaturized total analysis systems,μTAS),也称为芯片实验室(lab on a chip)。在过去20年中,微流控芯片已经取得了长足的发展,这与毛细管电泳技术在芯片上的成功应用密不可分[2-5]。而随着微加工和色谱技术的发展,微流控芯片技术逐渐应用于色谱这一常规分析中应用最广泛的技术[6]中。芯片上的微色谱技术除具有色谱的优点外,还具有系统微型化、集成化和自动化的特点,有广阔的应用前景。
由于微芯片上流体通道很细(几十微米或更小),填充固定相后流体阻力大,驱动流体所需压力远高于常规HPLC的压力,芯片本身和色谱柱均难以承受,限制了机械泵驱动微芯片色谱的发展。而上世纪90年代,Ramsey研究组首次将毛细管电色谱(CEC)技术应用于微芯片平台[7],可利用电场产生的电渗流(electroosmotic flow,EOF)来驱动液体,避免了体系高压。此后,微芯片电色谱逐渐受到了国内外研究者的重视[8-9]。
色谱柱是色谱分离技术的关键,由于微芯片尺度和性质的特点,微芯片上色谱柱与常规色谱柱存在不少差异。本文介绍当前在微流控芯片上应用的几种主要的微色谱柱类型,并分析各自的优劣,重点综述当前微流控芯片上电色谱聚合物整体柱的研究进展。
1 微流控芯片色谱柱类型
目前微流控芯片上色谱柱的类型主要有开管型色谱柱、填充色谱柱和整体柱等。
开管色谱柱的制作最为简单。Jacobson等[7]在玻璃芯片微通道键合C18制成开管色谱柱,并用电色谱分离香豆素。Kutter等[10]在更短的通道中键合C18并缩短了分析时间。由于微芯片具有小管径和浅通道的结构,此类色谱柱降低了塔板高度并提高柱效,但同时会导致柱容量降低,使系统容易过载,实用性不高。
相对于开管色谱柱,填充色谱柱有更高的比表面积和柱容量。同时,多种商品化的基体和填充材料方便了复杂样品的分离分析,因此填充柱的应用更为广泛。Gaspar等[11]利用弹性的PDMS材料,通过施加气压形成局部锥形截留结构,得到填充柱,其柱长和位置可通过改变压力和填充时间来控制。填充色谱柱还被用于3种头孢菌素类抗生素的电色谱分离[12]。Park等[13]采用溶剂蒸发法填充800 nm粒径硅胶颗粒形成色谱柱,微球随液体在毛细力作用下进入通道并自动聚集,填满通道,他们在2 mm长的分离通道中15 s内分离了4种氨基酸。
填充柱的缺陷是填充不均匀,易导致峰拖尾、基线噪声大和产生气泡。近年来发展的多孔聚合物整体柱、硅胶整体柱等整体柱技术具有高通透性和高柱空间利用率,与填充柱相比优势明显[14]。
2 聚合物整体柱研究进展
聚合物整体柱从制作工艺上主要可分为三类,即原位合成整体柱、后修饰整体柱和结合微加工技术的整体柱。
2.1 原位合成聚合物整体柱
原位合成整体柱是将单体、交联剂、引发剂溶于致孔剂,在一定温度或紫外线作用下,于微芯片通道的原位合成聚合物,再冲洗除去致孔剂和残余原料得到。
反相柱是微芯片色谱中应用最多的固定相。早期的毛细管色谱和微芯片色谱研究已经成熟地运用了原位合成的聚合物整体柱,常用的是以PMMA、聚丙烯酰胺、聚苯乙烯为基础的聚合物。近年来,研究者使用了很多新的单体来制备聚合物整体反相柱,如在PMMA类整体柱中使用肉桂酸、甲基丙烯酸丁酯、辛基甲基丙烯酸甲酯等[15]做为单体,新型的C14和C16的聚丙烯酰胺类整体柱[16]以及阳离子硬脂-丙烯酸酯[17]整体柱等。Bisjak等[18]利用原位共聚合制备了PA-PDA整体柱,该柱具有强机械稳定性,可用于分离蛋白和寡聚核酸。Li等[19]把单壁碳纳米管与氯甲基苯乙烯(VBC)原位共聚合,得到新型整体柱。也有研究在芯片上集成多个组件形成联合色谱系统,如Liu等[20]在芯片上通过原位聚合集成固相萃取柱和反相色谱柱,并用于富集、分离多肽和牛血清白蛋白酶解产物。
离子交换在电色谱中非常重要。Gu等[21]制备了磺酸基强阳离子交换整体柱,将该柱用于分离多肽时,其离子结合能力、峰容量、分辨率都非常高,但表现出相对强的疏水性。对于芯片电色谱而言,有强离子相互作用的离子交换柱非常重要。Wu等[22]利用原位合成法得到强离子交换柱,单体SEMA提供硫酸基团以产生电渗流,而聚合物上带有的负电基团起到阳离子交换作用。由于该聚合物骨架的疏水性,该柱在分离多肽时,实质是反相/离子交换柱。Fu等[23]则用MEAMS和EDMA原位制备了反相/强阴离子交换柱,其表面的氨基具有产生电渗流和阴离子交换的作用,而疏水的骨架又能起反相柱的作用。
除研究可用单体外,新的工艺和制备方法的研究也取得了很大发展。通过调整单体、交联剂、致孔剂之间的比例关系,研究者可以很好地控制所得到整体柱的通透性和柱效[24]。通过制备有浓度梯度的单体混合物溶液,还可以原位制备具有梯度的反相整体柱。具有梯度的整体柱与没有梯度的整体柱相比,可以表现出更高的效率和分辨率[25]。还有的研究者改变了流道截面上只有一种柱介质的常规工艺,利用孔层开管柱(porous layer open-tubular,PLOT)的方法在截面上制备出多种柱介质的整体柱[26],并成功用于分离生物样品。这种方法不但提供了很好的通透性,也显著提高了峰容量。
双亲性和两性聚合物近来也更多地运用到芯片电色谱柱的制备中[27]。含有疏水和亲水基团的聚丙烯酰胺整体柱就是典型的双亲性柱,可以用作正相或反相柱。Hoegger和Freitag[28]制备了带有磺酸基的双亲性聚丙烯酰胺整体柱,并用于带电氨基酸和多肽的电色谱分离。
2.2 后修饰聚合物整体柱
原位聚合得到的整体柱并不总是能满足特定的色谱分离需求。在原位聚合时,很多功能团会包埋在颗粒内部,而不在表面上,因此柱性能会明显降低。采用后修饰的方法在柱表面生成功能团则会大大改善这一问题。
聚合物整体柱的后修饰方法很多,使用最多的方法是在聚合物表面接枝。利用环氧、苄氯等[29]基团接枝的方法报道比较早,近年,利用甲基丙烯酸缩水甘油酯(GMA)的环氧基团的接枝方法较为流行,并成功运用到离子交换色谱、亲和色谱、pH梯度色谱等芯片色谱柱的制备中。
反相柱的后修饰需求并不多,但Li等[30]利用简单方法在整体柱表面修饰C18基团,以提高蛋白质分离的分辨率和通量,从而用于蛋白质组学研究。Dong等[31]在GMA柱上固定了赖氨酸。当分离电中性分析物时,起到反相柱的作用。而对于带电分析物,静电相互作用、电泳迁移作用和疏水相互作用则共同生效。
用于芯片电色谱的后修饰离子交换柱也有报道。Bisjak等[32]在GMA柱上接枝氨基得到阴离子交换柱。Wieder等[33]发展了这一方法,使用两步法获得了类似机制的强阴离子交换柱。Wei等[34]通过在GMA上接枝制备了一种弱阳离子交换柱,其离子交换表面是通过一个胺化的过程得到。
除利用环氧基团开环反应的方法,其他的接枝方法也有相应研究。二苯甲酮经紫外线照射后,可引发接枝反应,如Rohr等[35]在聚BMA-co-EDMA聚合物柱表面修饰AMPS,并成功用于分离多肽。Hilder等[36]则把两层不同功能的多聚物链连接,得到新的功能表面。
相对于接枝的方法,把功能化的纳米颗粒包被在聚合物的表面的方法较为简单,也常用于制备功能化聚合物柱。Hilder等[37]在聚BMA-co-EDMA-co-AMPS的表面包被了直径为60 nm的季铵盐纳米颗粒,制备了阴离子交换柱用于分离多糖。扫描电镜图像表明聚合物表面的多孔结构在修饰前后无变化,因而可以证实所修饰纳米颗粒的阴离子交换作用。基于类似方法,Hutchinson等[38]和Zakaria等[39]实现了无机阴离子的分离,其洗脱顺序表明所修饰的纳米颗粒同时具备粒子交换和帮助电泳的机制。
2.3 结合微加工的聚合物整体柱
通过微加工技术可以在芯片微通道内形成高度整齐的微结构(collocated monolith support structures,COMOSS)[40](见图1),作为固定相载体,这种微加工整体柱是芯片色谱柱所独有的。COMOSS的设想最初是由Regnier等[41]提出的,他们首次采用深度反应离子刻蚀技术(Deep Reactive Ion Etching,DRIE),在微芯片上加工了32条高深宽比的微柱阵列,总宽度为120 μm。在总宽度为1.2 cm的微芯片上,COMOSS总数超过4×105个。然后在微柱表面上采用静电法涂覆了聚苯乙烯磺酸,制得了反相电色谱柱。这样规整微结构填充的色谱柱,被认为可优化获得接近于理想的流体形态,以及降低混合(扩散)效应,从而获得更高的分离效率[42]。He等[43]通过分析卵清蛋白酶解产物的分离效果,对比了C18修饰前后的微加工整体柱,结果表明反相涂层显著改善了分离效果,且在芯片上的分离速度比常规的液相色谱梯度洗脱更快。Lavrik等[44]通过优化的BOSCH刻蚀工艺,获得了柱径0.8~1.6 μm、深宽比25:1的微加工整体柱,其理论塔板数为1.3×106/m。
硅片基质的微加工整体柱价格昂贵,因此有研究者在廉价材料上进行了此类探索。Slentz等[45]发展了一种微加工整体柱的制备技术,能在廉价的PDMS芯片上制备尺度为10 μm的多组微结构,并在微结构表面键合C18硅烷以对异硫氰酸荧光素标记的牛血清白蛋白酶解产物进行电色谱分离,分离多肽的理论塔板数达到4×105/m。随后,Slentz[46]等还在 PDMS 柱表面修饰了 2-丙烯酰胺基-2-甲基丙磺酸等5种聚合物涂层,用于分离BSA的酶解产物,理论塔板数达6.2×105/m。
碳纳米管等纳米材料以及气相沉积法等加工技术,也被利用来制作芯片上的微结构,作为固定相的载体。Fowlkes等[47]将垂直排列的碳纳米管原位生长于石英基底,形成微柱结构排列的COMOSS,以增加相比,从而提高分离效率。Mogensen等[48]以乙炔-氨气作为碳源,采用等离子体增强的化学气相沉积技术和镍种子层,在硅芯片通道内生长了碳纳米管纤维。其表面带负电荷,产生的电渗流方向与玻璃相同,可将荧光素和5-羧基荧光素分离。Goswami等[49]利用二茂铁为催化剂,以乙烯为碳源,采用化学气相沉积方法,在石英微通道内得到紧密的纤维状碳纳米管纤维,制备得到了反相色谱柱,并成功分离了硫脲和肽的混合物。
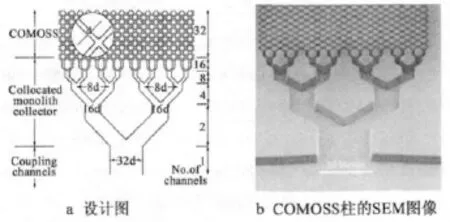
图1 微加工整体柱的进样口结构[42]Fig.1 Inlet splitter structure of COMOSS [42]
3 结论
芯片电色谱应用价值很大,将多种功能整合在微流控芯片上并用于色谱分离,将充分展示微流控芯片的巨大潜力。由于微芯片本身存在尺度限制,微芯片上的开管柱存在分离效率低的缺陷,填充型色谱柱也存在很多问题。相对而言,聚合物整体柱具备诸多优点,且其制备过程容易与微芯片相结合,是微芯片色谱柱的一个方向。
原位合成聚合物色谱柱方法最为直接,根据要求的不同,研究者已经开发了很多的单体材料和制备工艺。对于一般分离需求,这种方式是很好的选择。采用后修饰的方法在固定相表面连接功能基团可以提高柱分离效果,但这些修饰的反应条件往往不够温和,用于PDMS等化学耐受性不够好的芯片材料时会受到限制。而引入一些微加工技术,就可以在微流控芯片设计时制造出精细的微结构,然后在这些微结构上得到聚合物整体柱,从而充分发挥微流控芯片微色谱的诸多优势。
[1]MANZ A,GRABER N ,WIDMER H M.Miniaturized total chemical analysis systems:a novel concept for chemical sensing[J].Sensors and Actuators B:Chemical,1990,1(1/6):244 -248.
[2]何巧红,方群,方肇伦.微流控电泳分离的试样引入技术新进展[J].分析化学,2006,34(05):729-734.
[3]董娅妮,方群.微流控芯片毛细管电泳在蛋白质分离分析中的应用研究进展[J].色谱,2008,26(03):269-273.
[4]程永强,张涛,王鹗,等.激光诱导荧光检测微流控芯片生化分析仪的研制[J].分析化学,2008,36(01):127-131.
[5]徐中其,廣川健.基于微芯片电泳的脱氧核糖核酸片段的浓缩和分离[J].色谱,2009,27(01):102-106.
[6]REGNIER F E,HE B,LIN S,et al.Chromatography and electrophoresis on chips:critical elements of future integrated,microfluidic analytical systems for life science[J].Trends Biotechnol,1999,17(3):101 - 106.
[7]JACOBSON S C,HERGENRODER R,KOUTNY L B,et al.Open-channel electrochromatography on a microchip[J].Analytical Chemistry,1994,66(14):2369-2373.
[8]姚波,颜流水,王义明,等.微全分析系统中的电色谱分离技术[J].分析化学,2004,32(12):1673-1676.
[9]王军华,黄卫华,李灵军,等.芯片电色谱的最新研究进展及应用[J].色谱,2010,28(03):264-272.
[10]KUTTER J P,JACOBSON S C,MATSUBARA N,et al.Solvent-programmed microchip open-channel electrochromatography[J].Anal Chem,1998,70(15):3291-3297.
[11]GASPAR A,PIYASENA M E,GOMEZ F A.Fabrication of fritless chromatographic microchips packed with conventional reversed-phase silica particles[J].Anal Chem,2007,79(20):7906 -7909.
[12]GASPAR A,HERNANDEZ L,STEVENS S,et al.Electrochromatography in microchips packed with conventional reversed-phase silica particles[J].Electrophoresis,2008,29(8):1638 -1642.
[13]PARK J,LEE D,KIM W,et al.Fully packed capillary electrochromatographic microchip with self-assembly colloidal silica beads[J].Anal Chem,2007,79(8):3214 -3219.
[14]平贵臣,袁湘林,张维冰,等.整体柱的制备方法及其应用[J],分析化学,2001,29(12):1464-1469.
[15]WU R,HU L G,WANG F J,et al.Recent development of monolithic stationary phases with emphasis on microscale chromatographic separation[J].Journal of Chromatography A,2008,1184(1/2):369 -392.
[16]ZHANG K,GAO R Y,YAN C,et al.Preparation and porous property of C-14-monolithic column for capillary electrochromatography[J].Chromatographia,2005,61(1/2):55 -60.
[17]BEDAIR M ,Z.EL RASSI.Capillary electrochromatography with monolithic stationary phases-II.Preparation of cationic stearylacrylate monoliths and their electrochromatographic characterization[J].Journal of Chromatography A,2003,1013(1/2):35 -45.
[18]BISJAK C P,LUBBAD S H,TROJER L,et al.Novel monolithic poly(phenyl acrylate-co-1,4-phenylene diacrylate)capillary columns for biopolymer chromatography[J].Journal of Chromatography A,2007,1147(1):46 -52.
[19]LI Y,CHEN Y,XIANG R,et al.Incorporation of single-wall carbon nanotubes into an organic polymer monolithic stationary phase for mu-HPLC and capillary electrochromatography[J].Anal Chem,2005,77(5):1398 -1406.
[20]LIU J K,CHEN C F,TSAO C W,et al.Polymer microchips integrating solid-phase extraction and high-performance liquid chromatography using reversed-phase polymethacrylate monoliths[J].Analytical Chemistry,2009,81(7):2545 -2554.
[21]GU B H,CHEN Z Y,THULIN C D,et al.Efficient polymer monolith for strong cation-exchange capillary liquid chromatography of peptides[J].Analytical Chemistry,2006,78(11):3509 -3518.
[22]WU R,ZOU H,FU H,et al.Separation of peptides on mixed mode of reversed-phase and ion-exchange capillary electrochromatography with a monolithic column[J].Electrophoresis,2002,23(9):1239 -1245.
[23]FU H J,XIE C H,XIAO H,et al.Monolithic columns with mixed modes of reversed-phase and anion-exchange stationary phase for capillary electrochromatography[J].Journal of Chromatography A,2004,1044(1/2):237 -244.
[24]TROJER L,LUBBAD S H,BISJAK C P,et al.Monolithic poly(p-methylstyrene-co-1,2-bis(p-vinylphenyl)ethane)capillary columns as novel styrene stationary phases for biopolymer separation[J].Journal of Chromatography A,2006,1117(1):56 -66.
[25]YU G E,LUO Q,ZHANG J,et al.Ultratrace LC/MS proteomic analysis using 10-microm-i.d.Porous layer open tubular poly(styrene-divinylbenzene)capillary columns[J].Anal Chem,2007,79(3):938 -946.
[26]LUO Q,YUE G,VALASKOVIC G A,et al.On-line 1D and 2D porous layer open tubular/LC-ESI-MS using 10-microm-i.d.poly(styrene-divinylbenzene)columns for ultrasensitive proteomic analysis[J].Anal Chem,2007,79(16):6174 -6181.
[27]VIKLUND C,SJOGREN A,IRGUM K,et al.Chromatographic interactions between proteins and sulfoalkylbetaine-based zwitterionic copolymers in fully aqueous low-salt buffers[J].Anal Chem,2001,73(3):444 -452.
[28]HOEGGER D,FREITAG R.Investigation of mixed-mode monolithic stationary phases for the analysis of charged amino acids and peptides by capillary electrochromatography[J].Journal of Chromatography A,2003,1004(1/2):195 -208.
[29]LUO Q Z,ZOU H F,XIAO X Z,et al.Chromatographic separation of proteins on metal immobilized iminodiacetic acid-bound molded monolithic rods of macroporous poly(glycidyl methacrylate-co-ethylene dimethacrylate)[J].Journal of Chromatography A,2001,926(2):255-264.
[30]LI Y,ZHANG J,XIANG R,et al.Preparation and characterization of alkylated polymethacrylate monolithic columns for micro-HPLC of proteins[J].J Sep Sci,2004,27(17/18):1467 -1474.
[31]DONG X,DONG J,OU J,et al.Capillary electrochromatography with zwitterionic stationary phase on the lysine-bonded poly(glycidyl methacrylate-co-ethylene dimethacrylate)monolithic capillary column[J].Electrophoresis,2006,27(12):2518 -2525.
[32]BISJAK C P,BAKRY R,HUCK C W,et al.Amino-functionalized monolithic poly(glycidyl methacrylate-codivinylbenzene)ionexchange stationary phases for the separation of oligonucleoticles[J].Chromatographia,2005,62(Supple.13):S31 - S36.
[33]WIEDER W,BISJAK C P,HUCK C W,et al.Monolithic poly(glycidyl methacrylate-co-divinylbenzene)capillary columns functionalized to strong anion exchangers for nucleotide and oligonucleotide separation[J].J Sep Sci,2006,29(16):2478 -2484.
[34]WEI Y,HUANG X,LIU R,et al.Preparation of a monolithic column for weak cation exchange chromatography and its application in the separation of biopolymers[J].J Sep Sci,2006,29(1):5 -13.
[35]ROHR T,HILDER E F,DONOVAN J J,et al.Photografting and the control of surface chemistry in three-dimensional porous polymer monoliths[J].Macromolecules,2003,36(5):1677 -1684.
[36]HILDER E F,SVEC F ,FRECHET J M.Shielded stationary phases based on porous polymer monoliths for the capillary electrochromatography of highly basic biomolecules[J].Anal Chem,2004,76(14):3887 -3892.
[37]HILDER E F,SVEC F ,FRECHET J M J.Latex-functionalized monolithic columns for the separation of carbohydrates by micro anion-exchange chromatography[J].Journal of Chromatography A,2004,1053(1/2):101 -106.
[38]HUTCHINSON J P,ZAKARIA P,BOWIE A R,et al.Latex-coated polymeric monolithic ion-exchange stationary phases.1.Anion-exchange capillary electrochromatography and in-line sample preconcentration in capillary electrophoresis[J].Anal Chem,2005,77(2):407-416.
[39]ZAKARIA P,HUTCHINSON J P,AVDALOVIC N,et al.Latex-coated polymeric monolithic ion-exchange stationary phases.2.Micro-ion chromatography[J].Anal Chem,2005,77(2):417 -423.
[40]EIJKEL J.Chip-based HPLC:the quest for the perfect column[J].Lab Chip,2007,7(7):815 -817.
[41]HE B,TAIT N ,REGNIER F.Fabrication of nanocolumns for liquid chromatography[J].Anal Chem,1998,70(18):3790-3797.
[42]de PRA M,KOK W T,GARDENIERS J G,et al.Experimental study on band dispersion in channels structured with micropillars[J].Anal Chem,2006,78(18):6519 -6525.
[43]HE B,JI J Y,REGNIER F E.Capillary electrochromatography of peptides in a microfabricated system[J].Journal of Chromatography A,1999,853(1/2):257-262.
[44]LAVRIK N V,TAYLOR L C,SEPANIAK M J.Enclosed pillar arrays integrated on a fluidic platform for on-chip separations and analysis[J].Lab Chip,2010,10(8):1086 -1094.
[45]SLENTZ B E,PENNER N A,LUGOWSKA E,et al.Nanoliter capillary electrochromatography columns based on collocated monolithic support structures molded in poly(dimethyl siloxane)[J].Electrophoresis,2001,22(17):3736 -3743.
[46]SLENTZ B E,PENNER N A,REGNIER F E.Capillary electrochromatography of peptides on microfabricated poly(dimethylsiloxane)chips modified by cerium(IV)-catalyzed polymerization[J].Journal of Chromatography A,2002,948(1/2):225-233.
[47]FOWLKES J D,HULLANDER E D,FLETCHER B L,et al.Molecular transport in a crowded volume created from vertically aligned carbon nanofibres:a fluorescence recovery after photobleaching study[J].Nanotechnology,2006,17(22):5659 -5668.
[48]MOGENSEN K B,GANGLOFF L,BOGGILD P,et al.Carbon nanotubes integrated in electrically insulated channels for lab-ona-chip applications[J].Nanotechnology,2009,20(9):095503.
[49]GOSWAMI S,BAJWA N,ASURI P,et al.Aligned carbon nanotube stationary phases for electrochromatographic chip separations[J].Chromatographia,2009,69(5/6):473 -480.
