腹水型单克隆抗体纯化方法的研究
2013-11-30肖增鸿黄昭亮林月霞董斌田素娟
肖增鸿,黄昭亮,林月霞,董斌,田素娟
单克隆抗体被广泛应用于免疫学、药理学、细胞生物学、微生物学、临床疾病的预防、诊断和治疗及畜牧产品违禁限制药物的检测等。其生产方式主要有小鼠体内诱生腹水和杂交瘤细胞体外培养;前者生产成本低,是目前用于体外应用的主要生产方式。但无论哪种方式生产的单抗,均含有大量的杂蛋白,主要包括白蛋白、转铁蛋白、血清白蛋白、α-巨球蛋白、脂类蛋白以及其他宿主蛋白等,不能直接应用于体外。因此需对单抗进行后续的纯化,以达到使用要求。但目前尚没有一种方法能满足不同目的需要,尤其是在规模化制备单克隆抗体问题上显得更为突出。为了在大规模单克隆抗体的制备过程中,尽量减少经济成本与时间成本,对腹水型单抗纯化工艺进行了探讨[1-2]。
1 材料与方法
1.1 主要仪器和试剂
全自动数码凝胶图像分析系统、垂直电泳仪由上海天能科技有限公司生产;Moderl 680 酶标仪为美国 Bio-Rad 公司产品;Ultrospec1100pro 紫外可见分光光度计为美国 Amersham Biosciences 公司产品;核酸蛋白检测仪为上海青浦沪西仪器厂产品;小型台式记录仪购自上海自动化仪表三厂;蛋白 G 亲和层析柱和 DEAE 阴离子层析柱为美国GE 公司产品;Sephadex G-25 由美国 Pharmacia公司生产;4-D10 抗氯霉素单抗(IgG1)腹水由本实验室制备;辣根过氧化物标记羊抗鼠 IgG 由精美公司分装;牛血清白蛋白 BSA 由瑞士 Roche公司分装;硫酸铵、正辛酸等为国产化学试剂。
1.2 方法
1.2.1 腹水预处理 –20 ℃ 保存的原腹水置于4 ℃ 解冻过夜,取出后 4 ℃ 条件下,10000×g 离心 10 min,取上清,4 ℃ 保存。
1.2.2 两步硫酸铵沉淀法(AS 法) 取预处理腹水,用 0.02 mol/L pH 7.2 的磷酸盐缓冲液(PB)稀释 3 倍,再逐滴加入等量 pH 7.0 饱和(NH4)2SO4溶液,使其饱和度达到 50%,边加边搅拌,充分混匀后冰面静置 30 min。4 ℃ 条件下,10000×g 离心 10 min,取上清,将沉淀于 2 倍原腹水体积的 PB 复溶,再逐滴加入 8 倍原腹水体积 pH 7.0 饱和硫酸铵,使其饱和度达到 33%,充分混匀后冰面静置 30 min。4 ℃,10000×g 离心 10 min。弃上清,将沉淀 4 ℃ 保存。
1.2.3 辛酸-硫酸铵沉淀法(CA-AS 法) 取预处理腹水,用 0.06 mol/L pH 4.4 醋酸缓冲液稀释3 倍,用 1 mol/L HCl 调节 pH 至 4.8;按每毫升稀释腹水加 11 μl 辛酸的比例,室温搅拌下逐滴加入辛酸,于 30 min 内加完,4 ℃ 静置 2 h。取出后,4 ℃ 条件下,15000×g 离心 30 min,取上清,加入 1/10 体积的 0.01 mol/L PBS,用 1 mol/L NaOH 调 pH 至 7.2,在冰面操作加入饱和硫酸铵至 45% 饱和度,静置 30 min。取出后,10000×g离心 30 min,弃上清,将沉淀 4 ℃ 保存。
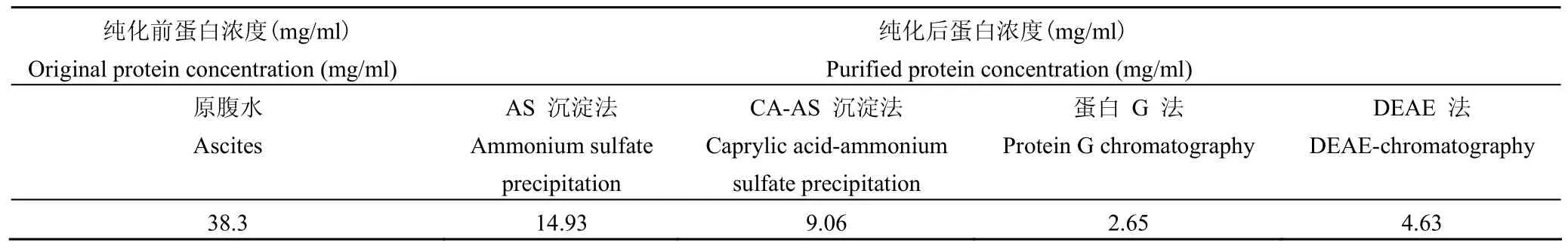
表1 不同方法纯化后蛋白浓度比较Table1 Comparison of purified protein concentrations by different methods
1.2.4 蛋白 G 亲和层析法 将辛酸-硫酸铵法获得的沉淀以 0.02 mol/L pH 7.0 PB 溶液重溶,过蛋白 G 亲和柱。以 0.1 mol/L pH 2.7 Gly-HCl 为洗脱缓冲液,流速 1 ml/min 洗脱,以 1.0 mol/L pH 9.0 Tris-HCl 为中和缓冲液进行接样收集蛋白。提纯样品保存在 –20 ℃。
1.2.5 DEAE 离子交换层析 将辛酸-硫酸铵法获得的沉淀以 0.01 mol/L pH 7.2 PB 溶液 A 重溶,经 Sepharose G-25 除盐后,过 DEAE 阴离子层析柱。以含 0.5 mol/L NaCl 的 0.01 mol/L pH 7.2 PB 为洗脱液 B,A、B 液混合进行线性梯度洗脱,收集蛋白峰。提纯样品保存于 –20 ℃ 环境中。
1.2.6 蛋白浓度鉴定 采用紫外分光光度计对抗体进行检测。测定前用溶解抗体的 PB 溶液调零,分别测定 3~4 个数值,取其平均值。利用公式:蛋白含量(mg/ml) =(1.45×OD280–0.74×OD260)× 稀释倍数。
1.2.7 蛋白分子量鉴定 以还原型 SDS-PAGE进行分析,具体方法参照文献[1],分离胶浓度为10%。
1.2.8 蛋白纯度鉴定 以非还原型 SDS-PAGE进行分析,具体方法参照文献[1],分离胶浓度为7.5%。
1.2.9 抗体免疫活性鉴定 采用间接 ELISA 法检测纯化后抗体效价。以合适浓度的包被抗原CAP-OVA 包被酶标板。根据蛋白浓度检测结果及SDS-PAGE 鉴定的纯度不同,对样品进行适当稀释,使纯化后 IgG 浓度与原腹水浓度相同。以原腹水按照 1∶1000 稀释液为阳性对照,SP2/0 小鼠骨髓瘤细胞 1∶1000 稀释腹水为阴性对照。具体操作方法参照文献[2]。
2 结果
2.1 单克隆抗体分子量与纯度、浓度鉴定
2.1.1 纯化前后抗体浓度测定 不同方法腹水纯化前后的蛋白含量见表 1,由此可以看出不同纯化方法的收率。
2.1.2 单克隆抗体分子量鉴定 IgG 抗体在 2-巯基乙醇作用下,免疫球蛋白中的二硫键被破坏,重链与轻链分开,因此,在还原型 SDS-PAGE 电泳中,可见两条明显的条带,两者分子量分别为:重链约 50 kD,轻链约 28 kD,如图 1 所示。单克隆抗体的分子量为 156 kD。
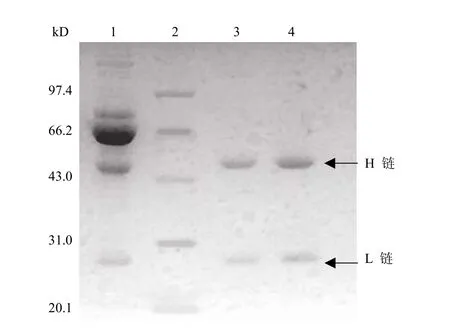
图1 单克隆抗体还原型 SDS-PAGE 电泳Figure1 Reduced SDS-PAGE electrophoresis of antibody
2.1.3 单克隆抗体纯度鉴定 由于 IgG 抗体由轻链与重链组成,还原型 SDS-PAGE 电泳很难直观分析其纯度,如图 2 所示,只能粗略观察到,CA-AS 法纯化后腹水纯度略大于两步 AS 法纯化后腹水。利用凝胶成像系统进行分析,CA-AS 法纯化后单抗纯度可达 44%,而两步 AS 法则只能去除含量较大的大分子蛋白条带,纯度约为 25%。
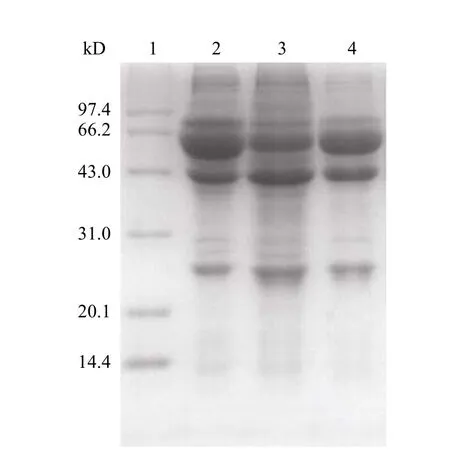
图2 粗提腹水还原型 SDS-PAGE 电泳Figure2 Reduced SDS-PAGE electrophoresis of the crude sample
为了进一步比较单抗纯化的效果,采用非还原型 SDS-PAGE 电泳检测了抗体的纯度。SDS-PAGE电泳分离胶浓度为 7.5%,然后借助电泳条带分析软件进行分析,从而精确判断抗体的纯度。利用凝胶成像系统进行分析,可得:蛋白 G 亲和层析纯化样品为单一条带,DEAE 离子交换层析纯化样品还有一些未知大分子残留,纯度 87%(图 3)。
2.2 单克隆抗体纯度、回收率
通过凝胶成像系统进行分析,对分析结果进行计算,可得到各种纯化方法纯化后的 IgG 纯度及相应的回收率,如表 2 所示。AS 法回收率最高,达到 63%,但其纯度明显低于 CA-AS 法;蛋白 G亲和层析法纯度达到 100%,但其回收率小于10%;DEAE 回收率 11.7%,明显高于蛋白 G 亲和层析法 6.9%,纯度 87%。
2.3 纯化后抗体间接 ELISA 效价检测
纯化后抗体效价如表 2 所示。将纯化前后腹水调节至相同浓度,通过有限稀释法设定检测梯度,以 OD630为参照,测定 OD450,以 P/N ≥ 2.1临界值为最高稀释倍数,即相应效价。结果表明:原腹水效价为 2.048×106,AS 法和 CA-AS 法纯化后抗体活性略低于原腹水;蛋白 G 法纯化后效价为 1.28×105,低于 DEAE 法,抗体活性损失较DEAE 法大。
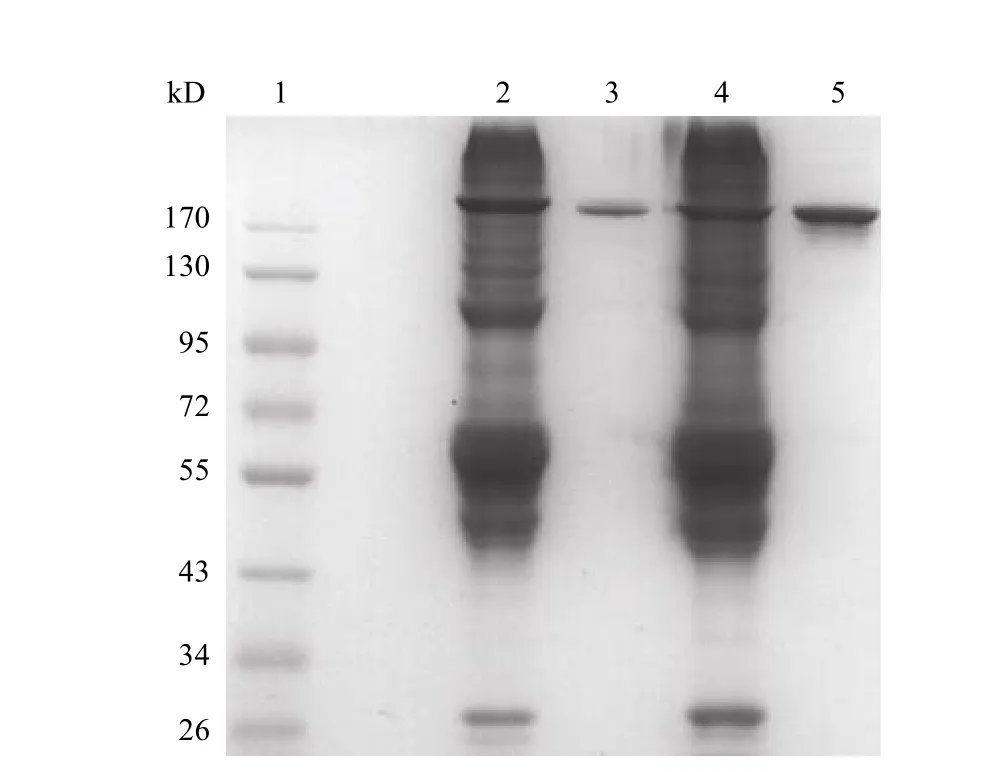
图3 非还原型 SDS-PAGE 电泳测定单克隆抗体纯品纯度Figure3 SDS-PAGE electrophoresis of samples
3 讨论
单克隆抗体在生物检测和医学、畜牧领域的应用越来越广泛,而其纯度与活性是影响其质量的关键因素。当前实验室常用的小鼠 IgG1、IgG2a、IgG2b 类单克隆抗体纯化方法中,常用沉淀法和层析法。常用粗纯的沉淀法有 AS 法、CA-AS 法,一般回收率高,但纯度低,活性较好,其中 AS 法收率较高,CA-AS 法纯度较高、抗体活性好[2-4]。而经 AS 法或 CA-AS 法初步纯化再联合 DEAE阴离子交换层析法或蛋白 A、G 亲和层析进一步纯化,纯度可达 87%~100%[2,5-6],但回收率较低,CA-AS 法联合蛋白 A 亲和层析法回收率为26%[5],AS 法联合 DEAE 阴离子交换层析法回收率为 8.9%[2]。本研究分别探讨了 AS 法、CA-AS法、CA-AS 法联合 DEAE 阴离子交换层析法与CA-AS 法联合蛋白 G 亲和层析法纯化抗氯霉素的 IgG1 类单克隆抗体,AS 法、CA-AS 法的回收率与周玉等[2]、梁荣等[4]的结果一致,但抗体纯度、活性降低,还有待进一步研究。CA-AS 法联合蛋白 G 亲和层析法纯化,纯度高,但回收率、活性低,成本高。采用 CA-AS 法联合 DEAE 阴离子交换层析法,纯度比 CA-AS 法联合蛋白 G 亲和层析法稍低,但显著提高了回收率与活性,比周玉等[2]报道的回收率 8.9% 有所提高。综合考虑,CA-AS 法联合 DEAE 阴离子交换层析法,与 AS法、CA-AS 法及 CA-AS 法联合蛋白 G 亲和层析法相比,无论在抗体回收率、抗体活性、抗体纯度等方面存在较大优势,且此法操作简便,可重复使用,生产成本较低,在实验室检测试剂盒制备方面,利用此方法纯化单克隆抗体,有一定的应用价值。

表2 不同纯化方法纯化后蛋白纯度、回收率与效价Table2 Comparison of purity, recovery and antibody titer by different purification methods
[1] Sambrook J, Russell DW.Molecular cloning: a laboratory manual.Huang PT, translate.3rd ed.Beijing: Science Press, 2002:1713-1720.(in Chinese)萨姆布卢克 J, 拉塞尔 DW.分子克隆实验指南.黄培堂, 译.3版.北京: 科学出版社, 2002:1713-1720.
[2] Zhou Y, Li YS, Pan FG, et al.The study of purified methods of mouse ascites IgG McAb.Heilongjiang Anim Sci Vet Med, 2006(10):14-16.(in Chinese)周玉, 李岩松, 潘风光, 等.小鼠腹水 IgG类单克隆抗体纯化方法的研究.黑龙家畜牧兽医, 2006(10):14-16.
[3] Tang JJ, Li XB, Liu GW, et al.Progress on purification of monoclonal antibody.China Anim Husbandry Vet Med, 2011, 38(2):76-80.(in Chinese)唐佳佳, 李小兵, 刘国文, 等.单克隆抗体纯化的研究进展.中国畜牧兽医, 2011, 38(2):76-80.
[4] Liang R, Yi L, Yang JQ.Comparison of three methods for the purification of mouse ascites IgG monoclonal antibody.J Cell Mol Immunol, 1996, 12(1):55-58.(in Chinese)梁荣, 伊岚, 杨健强.小鼠IgG类单克隆抗体三种纯化方法的比较.细胞与分子免疫学杂志, 1996, 12(1):55-58.
[5] Yang W, Li XB, Liu GW, et al.Purification of mouse ascites IgG2b monoclonal antibody methods.Anim Husbandry Vet Med, 2011,43(1):48-50.(in Chinese)杨威, 李小兵, 刘国文, 等.几种方法纯化小鼠腹水 IgG2b类单抗的比较.畜牧兽医, 2011, 43(1):48-50.
[6] Lewis JG, Rehm BH.ZZ polyester beads: an efficient and simple method for purifying IgG from mouse hybridoma supernatants.J Immunol Methods, 2009, 346(1-2):71-74.
