储存mRNA在大豆胚根萌发过程的作用
2013-11-26莫蓓莘徐晓峰
莫蓓莘,黄 彪,刘 丽,叶 浩,徐晓峰
1)深圳大学生命科学学院,深圳市微生物基因工程重点实验室,深圳518060;2)深圳大学生命科学学院,深圳市海洋生物技术与生态环境重点实验室,深圳518060
在种子发育过程中,胚完成发育、成熟和生理干燥后,进入相对静止期,直到温湿度和光照等条件满足了才开始萌发[1].目前已在多种处于相对静止状态的植物干种子中发现大量mRNA存在[2-4],说明这些mRNA(又称为长寿命mRNA[5])能存在于干燥环境中并保持活力.储存mRNA最早在成熟的棉花干种子中发现[6],随后研究者们对拟南芥干种子转录组的测序分析,鉴定出10 000多种储存mRNA[7-9];在大麦和水稻干种子中也发现相似数目的储存mRNA[10-12];对大豆干种子基因微阵列的分析发现,其至少含有22 000种储存 mRNA[13].这些储存mRNA被认为可能在种子萌发早期参与蛋白质的合成,但这些贮存mRNA存在于干种子细胞的什么部位?在萌发过程中有何功能?如何在萌发过程参与蛋白质的合成?种子能否完全依赖储存mRNA完成萌发过程?对于这些问题,我们知之甚少.近年研究发现:酵母、哺乳动物和植物细胞中存在被称为胁迫颗粒的mRNA储存结构和被称为处理小体 (或P-body)的mRNA降解结构.这些结构通过抑制 (将mRNA降解)或延迟 (将mRNA运送回多核糖体)特异mRNA的翻译实现对转录后蛋白质表达的调控.逆境条件下,mRNA通过在多核糖体、胁迫颗粒和处理小体之间转运调控特异蛋白质的表达,从而使其所在的细胞实现对逆境的适应[14-16].如热胁迫诱导下,在拟南芥根尖细胞和烟草叶肉原生质体中可以观察到处理小体和胁迫颗粒的数量和大小都有所增加[17],该研究结果表明,储存mRNA的胁迫颗粒和降解mRNA的处理小体对植物适应逆境有重要作用.种子发育成熟后即进入生理干燥期,种子细胞在该时期脱水,类似干旱胁迫;在萌发过程浸泡吸水相当于胁迫解除,恢复自然状况.种子发育和萌发过程基因表达,是否也通过mRNA在细胞内胁迫颗粒、处理小体以及多核糖体之间的运动实现转录后调控?萌发所需的mRNA是否在种子发育后期合成、干燥期被运送到mRNA储存结构中?种子吸水后,mRNA即离开储存结构被运送到多核糖体中,为种子吸水后迅速开展的蛋白质合成提供mRNA模版?本研究以大豆胚根为实验材料,通过转录抑制剂处理种子,分析在mRNA合成被抑制时,种子能否依赖储存的mRNA完成萌发过程.根据不同萌发阶段mRNA在种子细胞储存结构和多核糖体之间量的变化,探讨mRNA在细胞内运动介导的转录后调控机制是否参与种子发育和萌发过程基因表达的调控.
1 材料与方法
1.1 植物材料与萌发实验
利用转录抑制剂α-鹅膏蕈碱(α-amanitin)抑制新的mRNA合成,或利用翻译抑制剂抑制新蛋白质的合成,必须使抑制剂透过种皮进入胚细胞内,且处理方法不能影响胚的活力.大豆胚根易从种子中剥离,且能保持胚根活力,胚根可直接与转录抑制剂接触,避免了种皮和子叶阻碍胚对抑制剂的吸收.因此,本研究采用大豆胚根作为实验材料,大豆华夏一号由华南农业大学王晓峰教授提供.
将大豆干种子分为2组,每组设3个重复,每份样品为100 mg干种子胚根.将其中一组胚根分别置于装有去离子水、0.4 mmol/L转录抑制剂 αaminitin溶液或100 μg/mL翻译抑制剂放线菌酮(cycloheximide,CHX)溶液的培养皿中;另一组种子用沸水浴处理2 min,之后将剥离的胚根浸泡在去离子水中,置于25℃黑暗环境中.处理时间分别为0、4、8、12、16和20 h.
1.2 萌发过程中不同亚细胞器的分离
分别取浸泡0和4 h的胚根200 mg,加入1 mL裂解缓冲液 (Hepes-KOH 40 mol/L,pH=7.2;KCl 10 mmol/L,EDTA 0.1 mmol/L,Heparin 1 mg/mL,CHX 100 μg/mL,DTT 10 mmol/L,蔗糖 50 g/L,Triton X-100体积分数为1%),充分研磨,将研磨液转移至1.5 mL离心管中,11 400 r/min,4℃,离心10 min;取上清液0.3 mL,分别加至质量浓度为100~400 g/L连续蔗糖密度梯度溶液的顶端,4℃,45 000 r/min(SW60Ti,Beckman),离心2.5 h,自上往下收集分离液,每管60 μL,测260 nm处光密度值 (optical density,OD),根据吸收值绘制萌发0 h和萌发4 h的胚根细胞多核糖体特征图谱,根据吸收峰确定多核糖体组分和非多核糖体组分[18-19].
1.3 提取RNA并合成cDNA
采用Trizol法[20]提取大豆胚根总RNA,按试剂公司 (Invitrogen)提供的操作说明进行,每个检测点做3个生物学重复,每份样品重复3次,测定浓度并电泳检测.
经蔗糖密度梯度离心得到多核糖体组分和非多核糖体组分中的RNA,用酚氯仿法[21]提取.测定RNA浓度并电泳检测.
取900 ng RNA,按PrimerScript 1st Strand cDNA Synthesis Kit(Takara Biotechnology(大连)有限公司)的说明书操作进行逆转录反应合成cDNA.
1.4 实时定量PCR及数据分析
选取大豆膨胀素 (soybean expansin)基因(se)和β-微管蛋白 (soybean beta-tubulin)基因(sbt)为目的基因.其中,se上游引物序列为5'-GCAACCCACCACTCAAGCA-3',下游引物序列为 5'-TGAAATAGCACGGGACGA-3';sbt上游引物序列为5'-ACCGGGCTTTGACTGTTCC-3',下游引物序列为5'-TCATCTGTTCATCCACCTCCTTT-3',以 cDNA 为模板,进行PCR扩增,产物经琼脂糖凝胶电泳鉴定后切胶回收,连接到T载体上,转入大肠杆菌.提取大肠杆菌质粒作为标准品.
取1 ng含有目的基因的重组质粒,按10倍梯度稀释,取10-1~10-7ng/μL做标准品用于制备标准曲线.使用Takara公司SYBR®Premix Ex TaqTM(Tli RNaseH Plus)试剂盒进行实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)反应,反应体系大小为 20 μL,模板为2 μL,正反向10 μmol/L引物各0.8 μL.其他按该试剂盒的说明书进行操作.每组实验设置3个平行.
种子相关的实时定量PCR数据将干种子中的目的基因的拷贝数设置为1,对实验数据进行标准化处理.而细胞组分分离相关定量以结果最小的设为1,进行标准化处理.
1.5 蛋白质电泳和Western blot分析
分别从大豆干种子胚根、浸泡在水或转录抑制剂中的胚根中提取总蛋白质.将蛋白质样品与5倍的蛋白质上样缓冲液 (由pH=6.8的Tris-HCl 0.3 mol/L,SDS 100 g/L,Glyin 500 g/L,2-mercaptoethanol 50 g/L和Bromophenol blue 0.5 g/L配制而成)混合;100℃加热5 min后,上样 (聚丙烯酰胺凝胶质量浓度为100 g/L),100 V电泳3~4 h;最后,将凝胶板上的蛋白转到纤维膜上.
转膜所用缓冲液为Dunn buffer(10 mmol/L NaHCO3,3 mmol/L Na2CO3);转膜电压55 V,时间75 min.转膜后,将纤维膜在体积分数为5%的牛奶中浸泡1 h,用PBST(1×PBS,0.5%Tween-20)洗3次,每次10 min.在初级抗体中摇晃浸泡1 h后,再用PBST洗3次,每次10 min.然后在二级抗体中摇晃下浸泡45 min,再用PBST洗3次,每次10 min.最后用加强化学发光试剂盒 (Amersham pharmacia biotech inc.)进行检测,具体操作按制造商说明书进行.
2 结果与讨论
2.1 大豆干种子中含有萌发所需蛋白的mRNA
储存 mRNA 被发现存在于棉花[6]、苜蓿[18]、拟南芥[7]、水稻[10-11]和大豆[13]等多种植物的干种子中,其功能尚不清楚.如果储存mRNA在种子萌发过程中发挥作用,那么萌发过程所需蛋白的mRNA应存在于干种子中.实验选取大豆种子萌发过程必需的几种基因作为标记物,包括β-微管蛋白 (β-tubulin)、膨胀素 (expansin)、谷氨酰胺合成酶 (glutamine synthetase)和脂氧合酶 (lipoxygenase),检测干种子中是否储存这些基因的mRNA.RT-PCR结果发现:在4种标记物基因大小对应位置均有明显的条带 (图1),说明大豆干种子中存在4种基因的mRNA.因此推测,储藏在干种子中的mRNA可能在种子萌发过程中为该过程所需蛋白质的翻译提供模板.
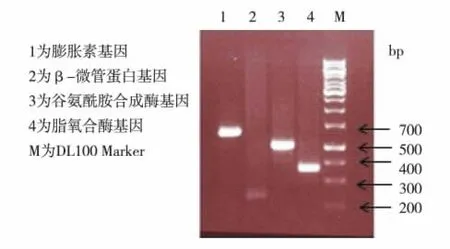
图1 RT-PCR检测大豆干种子中萌发相关基因mRNA的存在Fig.1 Detection of the existence of germination related mRNAs in soybean dry seed
2.2 检测转录抑制剂对大豆胚根中mRNA合成的抑制效果
实验选取大豆种子萌发过程所需膨胀素基因(se)和β-微管蛋白基因(sbt)作为基因标记物,利用RT-qPCR技术分析萌发过程转录抑制剂对大豆胚根中mRNA合成的抑制情况.图2显示萌发过程中转录抑制剂对大豆胚根中mRNA合成的抑制效果.结果表明,与干种子相比,对照组从吸涨开始至吸涨8 h,se和sbt基因的表达量均呈逐渐上升趋势,8 h后两种基因的表达量都逐渐下降.而转录抑制组自吸涨开始,se的表达量随吸涨时间延长呈明显降低趋势,sbt的表达量至吸涨4 h略有上升,然后明显降低.这表明转录抑制剂在吸涨开始后迅速渗入胚根细胞的细胞核中并抑制mRNA合成,作用效果显著.
2.3 转录抑制剂对大豆胚根中蛋白质合成的影响
结合转录抑制剂对大豆胚根中mRNA合成的抑制效果,为探讨转录抑制剂对大豆胚根中蛋白质合成的影响,实验利用Western blot对大豆胚根萌发过程谷氨酰胺合成酶的表达水平进行分析.图3结果显示,转录抑制剂处理4和8 h后,谷氨酰胺合成酶的表达水平相对于干种子均有升高,说明在转录被抑制的条件下,大豆胚根能利用储存的mRNA继续合成蛋白质,为种子顺利完成萌发过程提供必需的蛋白质.与浸泡在水中的大豆胚根样品比较,浸泡在转录被抑制的大豆胚根样品中的谷氨酰胺合成酶的表达水平更低,显示新合成的mRNA被抑制后,蛋白质的合成所需的模板减少,从而使新蛋白质合成的速度减慢.转录抑制条件下,种子萌发速度减慢与蛋白质合成速度的降低密切相关.SDSPAGE显示的蛋白质主要是种子中的储存蛋白,这些蛋白质在种苗的生长过程将被降解为种苗的发育提供养分.
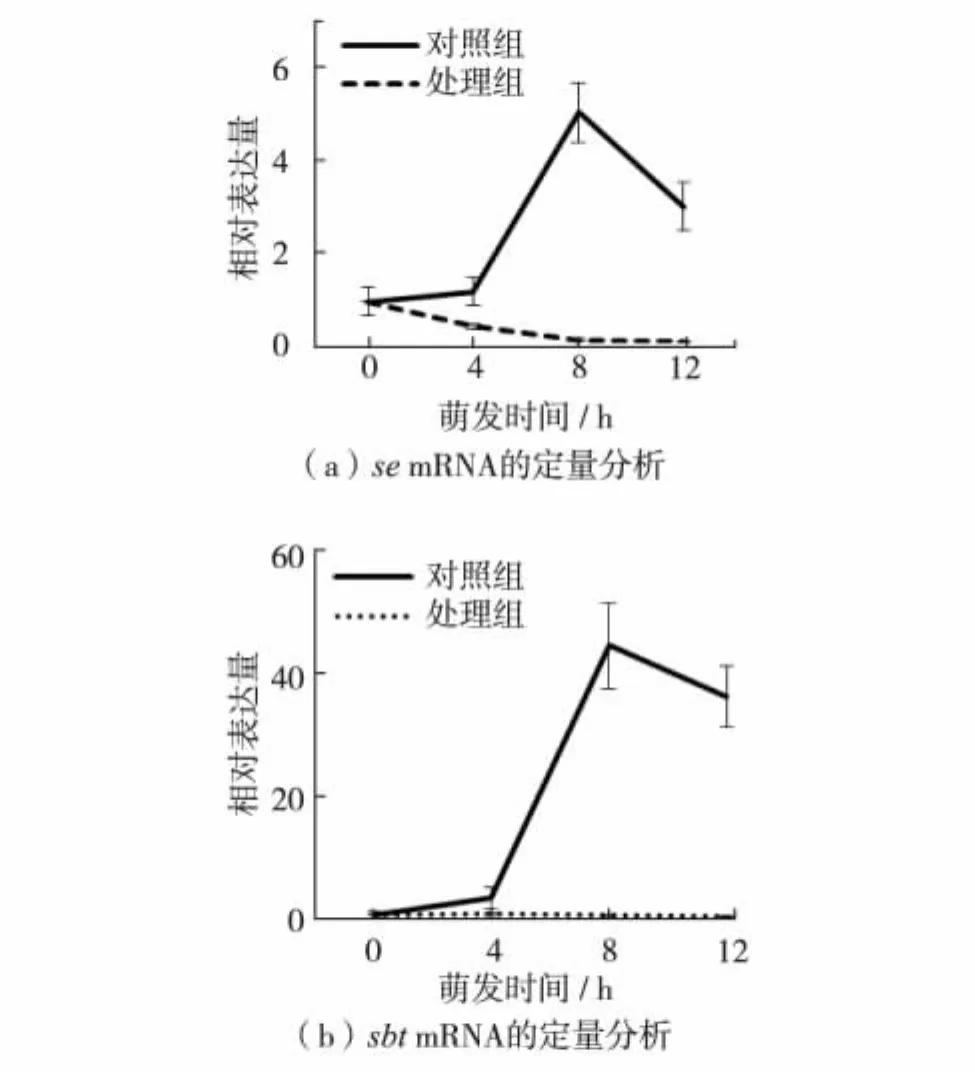
图2 大豆胚根萌发过程se和sbt mRNA的定量分析Fig.2 Quantitative analysis of the mRNAs of se(a)and sbt(b)during the germination of soybean radicle
2.4 转录抑制剂对大豆胚根萌发的影响
RT-qPCR结果显示,转录抑制剂浓度为0.4 mmol/L时能显著抑制大豆胚根中mRNA的合成.在转录被抑制时,胚根能否完成萌发?如图4,实验以浸泡在水中的大豆胚根为对照组;以浸泡在0.4 mmol/L的α-amanitin溶液中的大豆胚根为se处理组;为区分大豆胚根的伸长是萌发结果还是吸水膨胀结果,用沸水浴处理后的大豆胚根浸泡在水中作为sbt处理组.图4结果发现,大豆干种子胚根长为4.3 mm,经沸水煮过后,sbt处理组胚根伸长至6.4 mm;浸泡4 h后,对照组和se处理组的胚根伸长至7.3 mm,sbt处理组胚根长度没有变化;8 h后,对照组胚根伸长至8 mm,而se处理组的胚根伸长至7.5 mm;sbt处理组胚根长度依然没有变化.之后随着萌发时间延长,对照组胚根继续伸长,而se和sbt处理组不再变化.相比之下,大豆胚根有显著伸长,说明这种伸长是由于胚细胞的生长而不单纯是由于吸水膨胀.表明大豆胚根在转录被抑制的条件下依赖储存mRNA可以完成萌发过程.大豆胚根伸长一定程度后停止生长,说明储存mRNA只能提供大豆胚根完成萌发过程,不能满足萌发后种苗的生长过程蛋白质翻译的需要.
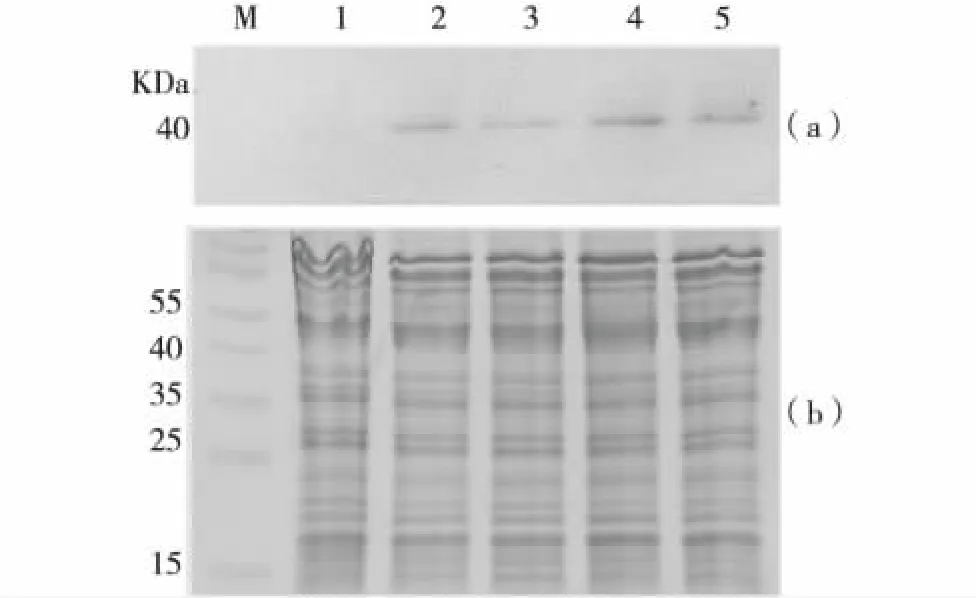
图3 通过Western blot分析大豆胚根萌发过程谷氨酰胺合成酶的表达水平 (a),SDS-PAGE显示相同的总蛋白上样量 (b)Fig.3 Analysis of protein levels of glutamine synthetase during germination process by Wesrtern blot(a),SDS-PAGE showing equal amount of total proteins(b)

图4 转录抑制剂处理对大豆胚根萌发的影响Fig.4 The effects of transcription inhibitor on the germination of soybean radicle
2.5 不同萌发时间大豆胚根细胞中mRNA亚细胞定位的变化
2.4节的结果显示,大豆胚根可依赖干种子中储存的mRNA完成萌发.干种子中处于储存状态的mRNA和萌发过程中处于翻译状态的mRNA是否发生了亚细胞定位的变化?为探明这个问题,实验将干种子胚根和处于萌发过程的胚根分别研磨后,进行蔗糖密度梯度离心,分离不同的亚细胞结构,同样以se和sbt作为基因标记物,通过RT-qPCR分析mRNA在不同亚细胞结构间的分布.图5可见,干种子胚根中的mRNA主要存在于核糖体外的亚细胞结构中,即mRNA的储存结构中,浸泡4 h的胚根中的mRNA主要存在于多核糖体中.说明萌发所需的mRNA在种子发育的后期合成,并被运送到多核糖体外的mRNA储存结构中,种子吸水后,mRNA应离开储存结构被运送到多核糖体中为随后迅速开展的蛋白质合成提供mRNA模板.
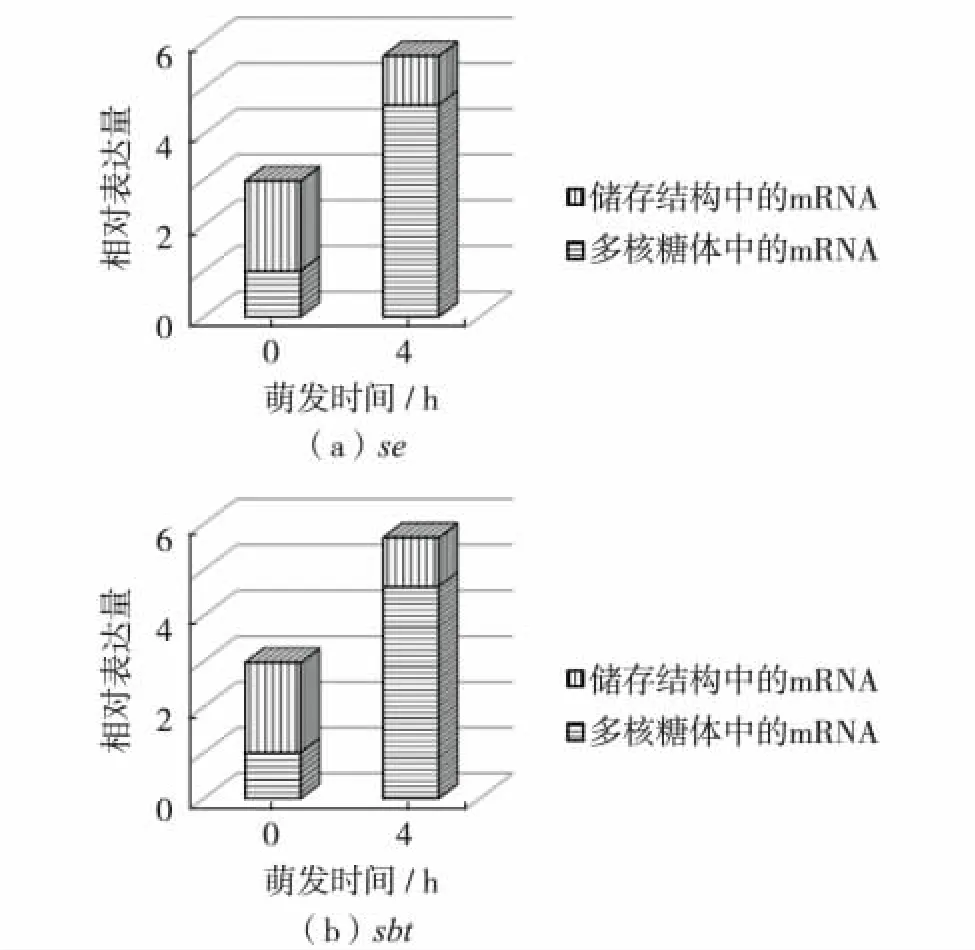
图5 大豆胚根萌发过程不同时间mRNA在不同亚细胞结构中的量的变化Fig.5 The changes of mRNAs levels in different subcellular structures after different time of imbibition
2.6 萌发过程不同阶段多核糖体特征图谱分析
2.5节的结果表明,干种子中mRNA主要位于核糖体外的亚细胞结构中,浸泡一定时间后,mRNA大部分转移到多核糖体中.干种子中蛋白质翻译整体水平应处于较低的状态,浸泡一定时间后蛋白质翻译水平迅速提高.为研究多核糖体特征图谱是否能体现这种mRNA定位的变化,利用蔗糖密度梯度超速离心法对浸泡不同时间大豆胚根细胞的核糖体特征图谱进行分析.图6显示,干种子中多聚核糖体特征曲线中多核糖体的峰型很低,这一现象是翻译水平受到抑制的体现[22].萌发4 h后,胚根细胞中多聚核糖体特征曲线中多核糖体的峰型明显升高,显示细胞内翻译水平的升高.该结果证实干种子细胞中整体翻译水平受到抑制,细胞内的mRNA处于储存状态,浸泡一定时间后,细胞内的mRNA处于翻译状态,该结果与2.5节的结果一致.

图6 大豆胚根在0和4 h萌发时的多聚核糖体特征图谱Fig.6 Polysome profiles of soybean radicles after different hours(0h,4h)of imbibition
2.7 翻译抑制剂对大豆胚根萌发的影响
大豆干种子中除了含有大量的储存mRNA外,还含有大量的储存蛋白质.2.4节的结果显示大豆胚根可以依赖干种子中储存的mRNA完成萌发.大豆胚根是否也可以依赖干种子中储存的蛋白质完成萌发?为探明这一问题,本研究检测分析了在翻译被抑制的条件下大豆胚根的萌发情况.以浸泡在水中的大豆胚根为对照组,以浸泡在翻译抑制剂100 μg/mL翻译抑制剂CHX溶液的大豆胚根为se处理组,为区分大豆胚根的伸长是萌发结果还是吸水膨胀的结果,用沸水浴处理后的大豆胚根浸泡在水中作为sbt处理组.然后观察不同处理条件下大豆胚根的萌发情况.图7结果显示,大豆干种子胚根长为4.3 mm,经沸水煮过后sbt处理组胚根伸长至6.4 mm;浸泡4 h后,对照组胚根伸长至7.3 mm,se处理组胚根伸长至与sbt处理组相同的长度后不再伸长;浸泡8 h后,对照组胚根伸长至8 mm,而se处理组和sbt处理组胚根长度依然没有变化.之后,随着萌发时间延长,对照组胚根继续伸长,而se和sbt处理组胚根长度不再变化.虽然se处理组的胚根伸长,但与已经致死的sbt处理组相比,长度无区别,说明这种伸长是因单纯吸水膨胀引起的,并没有发生由于胚细胞生长产生的伸长.表明大豆胚根在翻译被抑制的条件下不能完成萌发过程.大豆胚根的萌发需要有新蛋白质的合成,转录被抑制的情况下,储存的mRNA能继续为新蛋白质合成提供模板,使种子完成萌发.
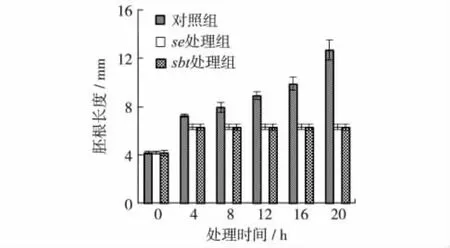
图7 翻译抑制剂处理对大豆胚根萌发的影响Fig.7 The effects of translation inhibitor on the germination of soybean radicle
结 语
本研究通过抑制mRNA和蛋白质的合成,了解储存mRNA和储存蛋白质在大豆胚根萌发过程所起的作用.发现大豆胚根中储存mRNA可以为胚根萌发过程蛋白质的翻译提供模板,使胚根在没有新合成的mRNA的条件下完成萌发.但在没有新蛋白质合成的情况下,胚根不能依赖储存蛋白质完成萌发.本研究还发现大豆胚根中的mRNA可以通过在多核糖体和mRNA储存结构间的运动来调节蛋白质的翻译.干种子中mRNA主要以储存状态存在于多核糖体外的储存结构中,吸水后,mRNA主要以翻译状态存在于多核糖体中.该研究为深入了解种子萌发的机制提供了实验依据.关于储存mRNA在种子萌发过程的作用有很多问题尚待深入研究.如其他种子,特别是萌发所需时间较长的种子是否也能依赖储存mRNA完成萌发?储存mRNA在发育过程中通过什么机制进入储存结构中?萌发过程又是通过什么机制转移到多核糖体中?发育过程中种子根据什么机制选择哪些mRNA储存起来?接下来我们将对这些问题逐一开展研究.
/References:
[1] Bewley J D.Seed germination and dormancy[J].Plant Cell,1997,9(7):1055-1066.
[2] Almoguera C,Jordano J.Developmental and environmental concurrent expression of sunflower dry-seed-stored lowmolecuLar-weight heat-shock protein and Lea mRNAs[J].Plant Molecular Biology,1992,19(5):781-792.
[3] Ishibashi N,Yamauchi D,Minamikawa T.Stored mRNA in cotyledons of Vigna unguicuLata seeds:nucleotide sequence of cloned cDNA for a stored mRNA and induction of its synthesis by precocious germination [J].Plant Molecular Biology,1990,15(1):59-64.
[4] Ku Ligowski J M,Ferrand E Chenou.Stored mRNA in early embryos of a fern Marsilea vestita:a paternal and maternalorigin [J]. Molecular Reproduction and Development,1991,30(1):27-33.
[5] Rajjou L,Gallardo K,Debeaujon I,et al.The effect of alpha-amanitin on the Arabidopsis seed proteome highlights the distinct roles of stored and neosynthesized mRNAs during germination [J].Plant Physiol,2004,134(4):1598-1613.
[6] Dure L,Waters L.Long-lived messenger RNA:evidence from cotton seed germination [J].Science,1965,147(3656):410-412.
[7] Nakabayashi K,Okamoto M,Koshiba T,et al.Genomewide profiling of stored mRNA in Arabidopsis thaliana seed germination:epigenetic and genetic reguLation of transcription in seed [J].The Plant Journal,2005,41(5):697-709.
[8] Kimura M,Nambara E.Stored and neosynthesized mRNA in Arabidopsis seeds:effects of cycloheximide and controlled deterioration treatment on the resumption of transcription during imbibition [J].Plant Molecular Biology,2010,73(1-2):119-129.
[9] Okamoto M,Tatematsu K,Matsui A,et al.Genome-wide analysis of endogenous abscisic acid-mediated transcription in dry and imbibed seeds of Arabidopsis using tiling arrays[J].The Plant Journal,2010,62(1):39-51.
[10] Howell K A,Narsai R,Carroll A,et al.Mapping metabolic and transcript temporal switches during germination in rice highlights specific transcription factors and the role of RNA instability in the germination process[J].Plant Physiology,2009,149(2):961-980.
[11] Sano N,Permana H,Kumada R,et al.Proteomic analysis of embryonic proteins synthesized from long-lived mRNAs during germination of rice seeds[J].Plant Cell Physiol,2012,53(4):687-698.
[12] Sreenivasu Lu N,Borisjuk L,Junker B H,et al.Barley grain development toward an integrative view [J].International Review of Cell and Molecular Biology,2010,281:49-89.
[13] Asakura T,Tamura T,Terauchi K,et al.Global gene expression profiles in developing soybean seeds[J].Plant Physiol Biochem,2012,52:147-153.
[14] Brengues M,Teixeira D,Parker R.Movement of eukaryotic mRNAs between polysomes and cytoplasmic processing bodies[J].Science,2005,310(5747):486-489.
[15] Floris M,Mahgoub H,Lanet E,et al.Post-transcriptional regulation of gene expression in plants during abiotic stress[J].International Journal of Molecular Sciences,2009,10(7):3168-3185.
[16] Xu J,Chua N H.Processing bodies and plant development[J].Current Opinion in Plant Biology,2011,14(1):88-93.
[17] Weber C,Nover L,Fauth M.Plant stress granuLes and mRNA processing bodies are distinct from heat stress granules [J].The Plant Journal,2008,56(4):517-530.
[18] Saroj K Pramanik,Joan E Krochko,Bewley J Derek.Distribution of cytosolic mRNAs between polysomal and ribonucleoprotein complex fractions in alfalfa embryos[J].Plant Physiology,1992,99:1590-1596.
[19] Mo Beixin,Ye Hao,Ou Zhonghua,et al.Stress-induced processing body formation in tobacco suspension cells[J].Journal of Shenzhen University Science and Engineering,2012,29(1):80-84.(in Chinese)莫蓓莘,叶 浩,欧忠华,逆境诱导烟草悬浮细胞内处理小体的形成 [J].深圳大学学报理工版,2012,29(1):80-84.
[20] Liu Yike,Sun Hongbo,Jian Bo,et al.Two efficient improved methods for isolation of high quality total RNA from soybean [J].Journal of Northwest Sci-Tech University of Agriculture and Forestry,2006,34(12):83-86.
[21] Del prete M J,Rolando Vernal,Helmut Dolznig,et al.I-solation of polysome-bound mRNA from solid tissues amenable for RT-PCR and profiling experiments[J].RNA,2007,13(3):414-421.
[22] Ashe M P,De Long S K,Sachs A B,et al.Glucose depletion rapidly inhibits translation initiation in yeast [J].Molecular Biology of the Cell,2000,11(3):833-834.
