免疫球蛋白A 1和肝细胞生长因子与腹型过敏性紫癜患儿胃组织损伤关系的研究
2013-11-21杨文萍
余 强 刘 洪 杨文萍 李 群 傅 睿
过敏性紫癜(HSP)是儿童时期最为常见的系统性小血管炎综合征,临床表现上除有典型非血小板减少性紫癜样皮疹外,还可出现关节肿痛、腹痛、消化道出血和血尿,甚至蛋白尿等症状。由于HSP相关病因及发病机制目前仍未完全明确,致使在日常临床诊治中缺乏明确的实验室诊断指标。尤其是以腹痛为首发症状的腹型HSP,常被误诊为急腹症等消化道疾病,从而延误病情。虽然目前欧洲抗风湿病联盟会议已将病理所见皮肤或肾小球基底膜上IgA类免疫复合物沉积作为HSP主要诊断标准之一[1]。但亦有研究提示,HSP的临床表现类型与皮损处IgAl的沉积强度无明显相关[2],而腹型HSP患儿胃黏膜组织中IgA类免疫复合物的表达目前尚未见文献报道。本文对腹型HSP患儿胃黏膜IgA、IgA1和肝细胞生长因子(HGF)表达情况进行分析,初步探讨腹型HSP胃组织损伤的发病机制,为腹型HSP的早期诊断提供依据。
1 方法
1.1 腹型HSP诊断标准 符合2005年欧洲风湿病防治委员会、欧洲儿童肾脏病防治委员会和美国风湿协会共同制订的HSP诊断标准[3]:有持续或反复腹痛伴或不伴消化道出血,无典型紫癜样皮疹且临床不支持外科疾病。
1.2 分组及其纳入条件 ①腹型HSP组:a.2010年9月至2012年11月江西省儿童医院肾内科收治通过胃镜检查诊断为腹型HSP的患儿;b.临床诊断HSP前行胃镜检查并获得胃黏膜组织;c.无其他合并症,且无长期服用肾上腺皮质激素、免疫抑制剂等病史。②非HSP胃炎组:临床以腹痛或消化道出血为主要表现,胃镜检查胃黏膜下未见类似皮肤紫癜样点片状隆起、且胃黏膜病理提示炎性改变,并获取胃黏膜组织的患儿。③正常对照组:取胃肿瘤切除部分胃的远离肿瘤部分、并经病理证实为正常的胃黏膜组织的患儿。
1.3 胃黏膜组织IgA、IgA1、HGF表达水平的测定 各组胃黏膜组织石蜡标本切至2~3μm厚度。兔抗人IgA多克隆抗体购自北京中杉金桥公司(批号za-0446),按1∶30稀释;鼠抗人IgA1单克隆抗体购自美国Southern Biotech公司(批号9130-0),按1∶500稀释;鼠抗人HGF单克隆抗体购自武汉博士德生物工程有限公司(批号BA0911),按1∶100稀释。PV-9000二步法试剂盒、AEC显色试剂盒购自北京中杉金桥公司,牛血清清蛋白购自武汉博士德生物工程有限公司。胃黏膜组织中IgA蛋白表达采用免疫组化非生物素二步法检测,操作步骤按抗体说明书进行。
1.4 免疫组化结果半定量分析 应用Nikon显微镜行免疫组化结果观察,通过Image Pro Plus 6.0病理图像分析软件,计算胃黏膜IgA、IgA1和HGF染色的强弱。每个病例于400倍视野下任意选取5个视野,每个视野的免疫分数等于阳性染色的平均光密度(IOD)值/(视野面积-空白面积),每个病例的免疫分数取5个视野免疫分数的平均值,即组织中蛋白的表达水平。
1.5 统计学方法 数据经正态分布检验后,采用SPSS 13.0软件进行统计学处理。计量资料采用±s表示,两组间比较采用t检验,多组资料间比较采用单因素方差分析,组间两两比较采用LSD-t检验;相关性分析采用Pearson相关分析。按α=0.05为检验水准,(P<0.05)为差异具有统计学意义。
2 结果
2.1 一般情况 腹型HSP组纳入20例,男13例,女7例,发病年龄5~13岁,平均年龄(8.3±2.5)岁。非HSP胃炎组纳入10例,男6例,女4例,发病年龄6~11岁,平均年龄(8.9±1.3)岁;正常对照组纳入4例,男2例,女2例,发病年龄4~10岁,平均年龄(7.3±1.9)岁。
2.2 各组胃黏膜组织中IgA、IgA1蛋白的表达 腹型HSP组胃黏膜组织中均可观察到IgA、IgA1的表达(图1A,B),主要分布在胃黏膜上皮的表面黏液细胞内和固有层管状腺之间的间质细胞、炎症细胞内,表1显示,IgA与IgA1免疫分数间差异无统计学意义((P>0.05))。非HSP胃炎组胃黏膜组织黏膜上皮及管状腺之间亦可见IgA、IgA1沉积,但阳性染色弱于腹型HSP组(图1C,D),且IgA、IgA1免疫分数及IgA1/IgA的比值低于腹型HSP组,差异有统计学意义((P<0.01)),非HSP胃炎组IgA、IgA1间比较差异有统计学意义((P<0.01))。正常对照组胃黏膜组织未见IgA及IgA1的明显沉积(图1E,F),HSP组与非HSP胃炎组IgA、IgA1免疫分数均显著高于正常对照组,差异有统计学意义((P<0.01))。
表1 各组患儿胃黏膜组织IgA、IgA 1和HGF蛋白表达±s)Tab 1The expressions of IgA,IgA 1 and HGF of gastric mucosa indifferent groups ± s)
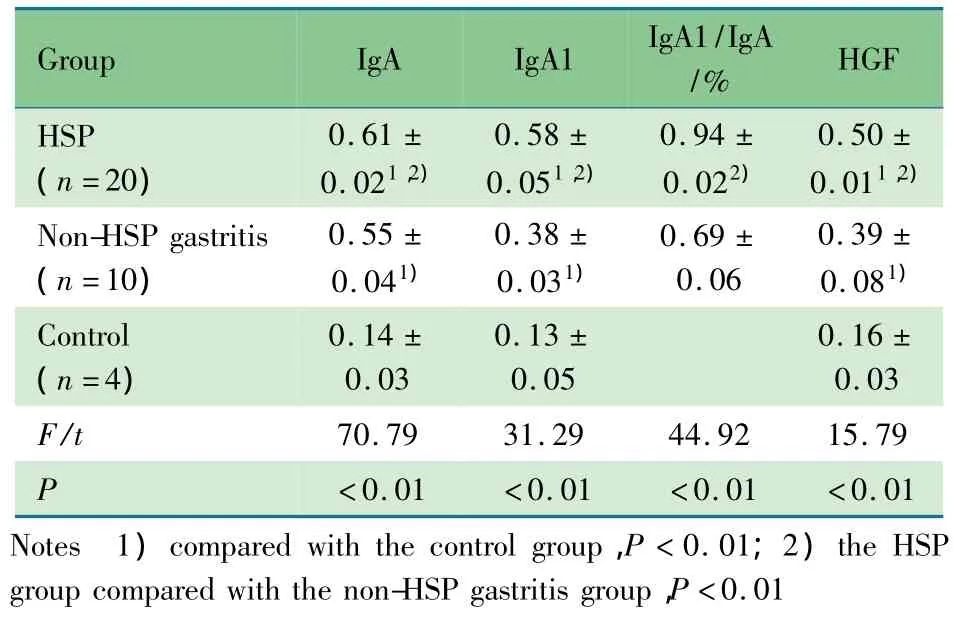
表1 各组患儿胃黏膜组织IgA、IgA 1和HGF蛋白表达±s)Tab 1The expressions of IgA,IgA 1 and HGF of gastric mucosa indifferent groups ± s)
?
2.3 各组胃黏膜组织HGF蛋白的表达 腹型HSP组胃黏膜组织中可观察到HGF的显著表达(图1G),主要分布在胃黏膜管状腺细胞内。非HSP胃炎组胃黏膜组织也可见HGF沉积于管状腺细胞内,但阳性染色较腹型HSP组偏弱(图1H),表1显示,HGF免疫分数低于腹型HSP组,差异有统计学意义((P<0.01))。正常对照组胃黏膜组织中HGF无明显表达(图1I),HGF免疫分数较非HSP胃炎组和腹部HSP组显著降低((P<0.01))。
2.4 IgA1与HGF蛋白表达的相关性分析 腹型HSP组胃黏膜组织中IgA1与HGF蛋白表达呈正相关(r=0.892,(P<0.01))。非HSP胃炎组中IgA1与HGF表达亦存在正相关(r=0.634,(P<0.01)),但正常对照组中两者表达无显著相关性(r=0.128,P >0.05)。

3 讨论
近年来,HSP不典型病例逐年增多,临床上以腹痛、呕血和便血等非特异性消化道症状为首发表现而就诊的患儿不少见。在缺乏紫癜样皮疹的情况下,腹型HSP患儿常被误诊为急性胃肠炎、消化性溃疡、急腹症和肠梗阻等消化道疾病,有部分患儿进行剖腹探查仍找不到病因,典型皮疹出现后方能确诊,从而耽误病情,延误治疗。由于HSP的治疗与其他常见的消化道疾病截然不同,尤其是HSP合并消化道出血时往往需要给予大剂量肾上腺皮质激素冲击治疗才能使症状得以缓解。同时在对HSP回顾性研究中发现[4],腹痛、胃肠道出血与肾脏损伤的发生有着密切关系,所以对有腹痛、甚至消化道出血症状的腹型HSP患儿,早诊断和早治疗就显得格外重要。
腹型HSP患儿胃黏膜组织内除了存在不同程度的充血和水肿外,还可以观察到部分黏膜下有类似皮肤紫癜样的点片状隆起,此为HSP胃镜下最具特征性的表现,临床中常以此作为腹型HSP的确诊标准。但该法缺乏客观的病理学指标支持,受胃镜操作者技术水平、临床经验等主观因素影响较大,且部分皮疹迟发病例,即使在胃镜观察下仍无特异性表现,而组织病理检查只能于光镜下观察到固有层水肿、充血、结缔组织增生和血管周围炎症等一般消化道疾病均能表现的非特异性改变,导致腹型HSP诊断仍有很大的困难。Alina等[5]对22例HSP患儿行皮肤活检,发现皮肤血管壁均可观察到IgA沉积,部分病例伴有C3、纤维蛋白、IgM和CD3的表达,据此提出对皮疹不典型而无其他临床表现(关节炎、腹痛、肾脏受累等)的患儿,可行皮疹部位的皮肤活检以协助临床对HSP的诊断。这也提示对于以腹痛为主要临床表现而皮疹迟发的HSP患儿,是否能在进行电子胃镜检查排除其他消化道疾病的同时,通过对胃黏膜中某些细胞因子表达水平的检测为腹型HSP的早期诊断提供客观的依据呢?
IgA1是免疫球蛋白IgA的一种亚类[6]。异常糖基化的IgA1因糖链上唾液酸和(或)半乳糖减少,导致自身空间结构发生改变,使其不能被正常的代谢途径所清除,最终在循环中积聚[7~9]。目前研究显示[10],HSP 患儿循环中的免疫复合物IgA均为糖基化缺陷的IgA1分子,提示IgA1的异常糖基化可能参与了HSP病程中脏器的损伤。也有研究显示HSP患儿的胃肠道损伤可能是由IgA介导的食物过敏反应引起[11,12]。本研究通过免疫组化法观察到在腹型HSP患儿胃黏膜中,IgA、IgA1显著表达于黏膜上皮的表面黏液细胞及固有层管状腺间的间质细胞内,提示两者参与了腹型HSP胃黏膜的损伤。
HGF在机体内,尤其是受损组织中作为抗损害因子,起到抗炎、抗细胞凋亡和促进受损组织修复等保护作用[13]。本研究显示,HGF在腹型HSP患儿胃黏膜管状腺细胞内大量沉积,并与胃黏膜中IgA1的表达呈正相关,提示两者在HSP胃黏膜损伤中可能存在相互作用。提示在发病初期当异常糖基化的IgA1沉积于HSP患儿的胃黏膜组织后,可通过释放TNF-α、IL-6等炎症因子刺激HGF高表达[14]。虽然在非HSP胃炎组亦可见到IgA、IgA1及HGF的表达,但程度较腹型HSP组轻,且IgA1/IgA免疫组化分数比值显著低于腹型HSP组,提示非HSP的胃炎患儿可能在某些因素(如病原体或者炎症因子等)的刺激下释放IgA(包括IgA1及IgA2)参与免疫炎症反应,但IgA1可能并不是其主要的介导因子。同时显示非HSP胃炎组IgA1与HGF的表达亦成正相关,提示仅微量表达的IgA1仍可通过释放炎症因子刺激HGF高表达。
本文为IgA、IgA1和HGF对腹型HSP患儿诊断的初步研究,鉴于样本量较小,尚无法计算各指标对于HSP的诊断参数,但本文结果显示这3个指标对于腹型HSP有较好的提示作用,因此有待继续收集病例深入分析。
本研究提示,对于临床表现以腹痛或消化道出血为首发症状、无典型紫癜样皮疹且临床不支持外科疾病的患儿,可早期行电子胃镜检查,对于胃黏膜下观察到类似皮肤紫癜样隆起、尤其是胃黏膜紫癜不典型的患儿,可以通过对其胃黏膜组织IgA1、HGF蛋白表达进行测定,并辅助形态学检查,为临床早期、准确的诊断腹型HSP提供一种客观的依据。
[1]Ozen S,Pistorio A,Iusan SM,et al. EULAR/PRINTO/PRES riteria for Henoch-Schonlein purpura,childhood polyarteritis nodosa,childhood Wegene. Granulomatosis and childhood Takayasu arteritis: Ankara 2008. PartⅡ: Final classificationcriteria. Ann Rheum Dis,2010,69( 5) : 798-806
[2]Zhang Q(张琴), Lu L, Lin D.儿童过敏性紫癜血清 IgA1和皮肤小血管IgA1的沉积及意义.Chin J Dermatol(中华皮肤科杂志),2008,41(1):55-56
[3]Ozen S,Ruperto N,Dillon MJ,et al.EULAR/PReS endorsed consensus criteria for the classification of childhood vasculitides.Ann Rheum Dis,2006,65(7):936-941
[4]de Almeida JL,Campos LM,Paim LB,et al.Renal involvement in Henoch-Schonlein purpura:A multivariate analysis of initial prognostic factors.J Pediatr(Rio J),2007,83(3):259-266
[5]Murqu A,Mihaila D,Cozma L,et al.Indications and limitations of histopat hological of Henoch-Schonlein purpura in children.Rom J Morphol Embryol,2012,53(3):769-773
[6]Tarelli E,Smith AC,Hendry BM,et al. Human serum IgA1 is substituted with up to six O-glycans as shown by matrix assisted laser desorption ionisation time-of-flight massspectrometry. Carbohydr Res,2004,339( 13) : 2329-2335
[7] Nartia I,Gejyo F. Pahogenetic significance of aberrantglycosylation of IgA1 in IgA nephropathy. Clin Exp Nephrol,2008,12( 5) : 332-338
[8]Inoue T,Suqiyama H,Kitaqawa M,et al. Abnormalities of glycogenes in tonsillar lymphocytes in IgA nephropathy. Adv Otorhinolarynqol,2011,72: 71-74
[9]Gharavi AG,Moldoveanu Z,Wyatt RJ,et al. Aberrant IgA1 glycosylation is inherited in familial and sporadic IgA nephropathy. J Am Soc Nephrol,2008,19( 5) : 1008-1014
[10]Kiryluk K, Moldoveanu Z, Sanders JT. et al. Aberrant glycosylation of IgA1 is inherited in both pediatric IgA nephropathy and Henoch-Schonlein purpura nephritis. Kidney Int,2011,80( 1) : 79-87
[11]李春艳.食物特异性IgG抗体检测在儿童相关性疾病中的临床意义.吉林大学硕士论文,2008
[12]Kawasaki Y,Hosoya M,Suzuki H,et al.Possible pathologenic role of interleukin-5 and eosino cationic protein in Henoch-Schonlein purpura nephritis.Pediatr Int,2005,47(5):512-517
[13]Boros P,Miller CM.Hepatocyte growth factor:a multi functional cytokine.Lancet,1995,345(8945):293-295
[14]Chan LY,Leung JC,Tsang AW,et al. Activation of tubular epithelial cells by mesangial-derived TNF-alpha:Glomerulotubular communication in IgA nephropathy. KidneyInt,2005,67( 2) : 602-612
