两种方案治疗合并胰岛素抵抗的多囊卵巢综合征不孕患者临床疗效评价
2013-11-12四川省成都金沙医院四川成都610074
王 莉(四川省成都金沙医院,四川 成都 610074)
多囊卵巢综合征(PCOS)是育龄期妇女最常见的内分泌系统紊乱性疾病之一,其以长期无排卵和高雄激素血症为基本特征,并且常伴有胰岛素抵抗症状,PCOS不孕患者的发病率高达30%~60%。达英-35因其有抑制促黄体生成素(LH)和雄激素(T)的作用,一直作为治疗PCOS的一线药物使用,而二甲双胍和罗格列酮在PCOS-IR治疗中的运用也愈来愈受到广泛重视。经临床观察发现达英-35联合二甲双胍或罗格列酮配合促排卵法在治疗PCOS-IR不孕患者时疗效明显,现报告如下。
1 资料与方法
1.1 一般资料:选择2010年11月~2012年6月我院妇产科就诊的PCOS-IR不孕患者58例,年龄22~35岁,平均(27.4±4)岁。婚后夫妻双方性生活正常,排除男方原因,不孕史2~10年。PCOS诊断标准(参照2003年10月美国生殖医学学会于荷兰鹿特丹会议上修订内容):①排卵稀发,减少或无排卵;②临床和(或)生化检查有高雄激素血症表现;③经阴道超声检查,可见一侧或双侧卵巢内直径为2~9 mm的卵泡有12个或以上,和(或)卵巢体积>10 ml,以上三种符合两项,并排除一下疾病:①如先天性肾上腺皮质增生,库欣综合征,分泌雄激素的肿瘤等可引起高雄激素血症的其他疾病;②其他引起排卵障碍的疾病:高密乳素血症、卵巢早衰和垂体或下丘脑性闭经或甲状腺功能异常。
1.2 胰岛素抵抗标准:用HOMA模型评价胰岛素抵抗。HOMA稳态模型胰岛素抵抗指数(HOMA-IR)=(空腹血糖(mmol/L)×空腹胰岛素(mIU/L)/22.5;HOMA-IR的切割点根据年龄匹配的背景调查人群该指数的上25%位点1.66确定,≥1.66为胰岛素抵抗;<1.66为非胰岛素抵抗组。
1.3 方法:将所收集58例PCOS-IR不孕患者随机分为A组和B组,各29例。A组采用达英联合二甲双胍治疗。口服达英,自月经第5天起,1片/晚,连服21 d。停药月经来潮后的第5天开始下个疗程,共3个疗程。在此期间口服二甲双胍500 mg/次,3次/d,共3个月。B组采用达英联合罗格列酮治疗,达英口服方法同上,罗格列酮4 mg/d,1次/d,共3个月。嘱患者服药间避孕。采用克罗米芬加促性腺激素(CC/HMG)促排卵,即于月经第5天开始服用CC,50 mg/d,连用5 d,第10、12、14天,加用小剂量HMG 75 U,肌内注射,1次/d,待卵泡直径达18 mm,注射HCG 4000~6000 U诱发排卵,并指导性交,每个月阴道超声检测排卵,观察受孕情况。
1.4 观察指标及方法
1.4.1 观察指标:①每个月经期、经量及服药期间有无不良反应等情况;②治疗前后BMI、WHR评分、空腹血糖(FSG)、糖负荷后1 h血糖(SG1h)、2 h血糖(SG1h)、空腹胰岛素(FINS)、糖负荷后1 h胰岛素浓度(INS1h)、2 h胰岛素浓度(INS2h)、脂代谢指标及性激素水平;③治疗前后卵巢体积、卵泡个数;④排卵情况、排卵率及妊娠率。
1.4.2 判定方法:排卵标准:月经周期第10天起,阴道B超监测,即成熟卵泡最大直径≥20 mm,外形饱满、壁薄、张力大,位于卵巢边缘。排卵征象:增大卵泡消失或明显缩小,内壁塌陷,内见点状强回声,陶氏腔见少许积液。血清胰岛素测定方法:于隔夜禁食12 h后采血,采血后即服葡萄糖75 g分别于服后60 min、120 min测血糖浓度和胰岛素水平。
1.5 统计学方法:数据采用SPSS 17.0统计软件进行数据分析,计量资料以均数±标准差()表示,运用配对t检验,分析各组PCOS-IR不孕患者治疗前后自身观察指标的情况;运用多个独立样本Kruskall Wallis检验,分析两组PCOS-IR不孕患者组间比较疗效有无差异。
2 结果
2.1 两组患者治疗前后血糖及胰岛素变化:治疗前后FINS及各时相INS均有显著变化(P<0.05),但SG变化不明显。两组疗效比较,B组优于A组,见表1。
表1 两组患者治疗前后血糖及胰岛素变化( )
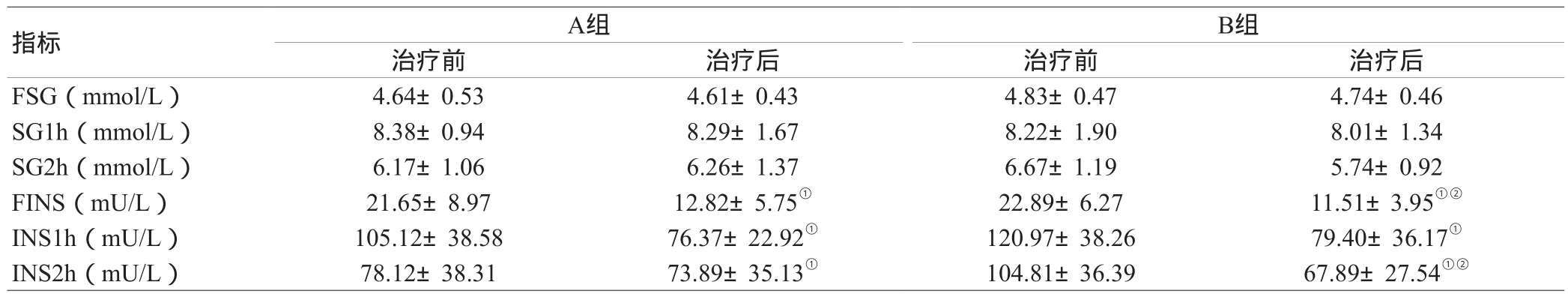
表1 两组患者治疗前后血糖及胰岛素变化( )
注:与自身治疗前比较,①P<0.05;与A组比较,②P<0.05
B组治疗前 治疗后 治疗前 治疗后FSG(mmol/L) 4.64±0.53 4.61±0.43 4.83±0.47 4.74±0.46 SG1h(mmol/L) 8.38±0.94 8.29±1.67 8.22±1.90 8.01±1.34 SG2h(mmol/L) 6.17±1.06 6.26±1.37 6.67±1.19 5.74±0.92 FINS(mU/L) 21.65±8.97 12.82±5.75① 22.89±6.27 11.51±3.95①②INS1h(mU/L) 105.12±38.58 76.37±22.92① 120.97±38.26 79.40±36.17①INS2h(mU/L) 78.12±38.31 73.89±35.13① 104.81±36.39 67.89±27.54①②指标A组
2.2 两组患者治疗前后BMI、WHR、脂代谢指标变化:两组治疗前后指标对照可见,BMI评分两组组间疗效比较,差异有统计学意义(P<0.05)。脂代谢指标总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、三酰甘油(TG)治疗前后差异均有统计学意义(P<0.05),见表2。
表2 两组患者治疗前后BMI、WHR、脂代谢指标变化( )
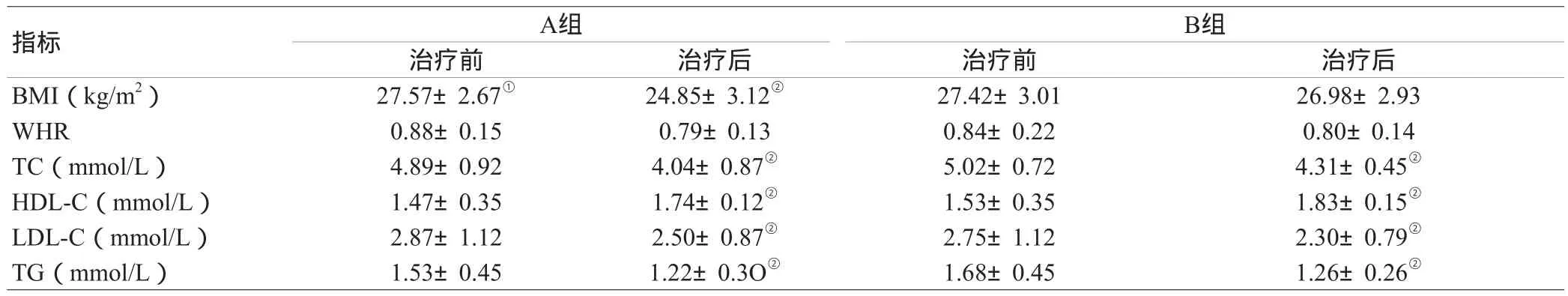
表2 两组患者治疗前后BMI、WHR、脂代谢指标变化( )
注:与B组比较,①P<0.05;与自身治疗前比较,②P<0.05
B组治疗前 治疗后 治疗前 治疗后BMI(kg/m2) 27.57±2.67① 24.85±3.12② 27.42±3.01 26.98±2.93 WHR 0.88±0.15 0.79±0.13 0.84±0.22 0.80±0.14 TC(mmol/L) 4.89±0.92 4.04±0.87② 5.02±0.72 4.31±0.45②HDL-C(mmol/L) 1.47±0.35 1.74±0.12② 1.53±0.35 1.83±0.15②LDL-C(mmol/L) 2.87±1.12 2.50±0.87② 2.75±1.12 2.30±0.79②TG(mmol/L) 1.53±0.45 1.22±0.3O② 1.68±0.45 1.26±0.26②指标A组
2.3 两组患者治疗前后生殖激素的改变:两组用药前后自身比较,黄体生成素(LH)、LH/FSH、T水平均显著下降(P<0.05),促黄体生成素(FSH)前后改变及组间疗效比较差异无统计学意义(P>0.05),见表3。
表3 两组患者治疗前后生殖激素的改变( )
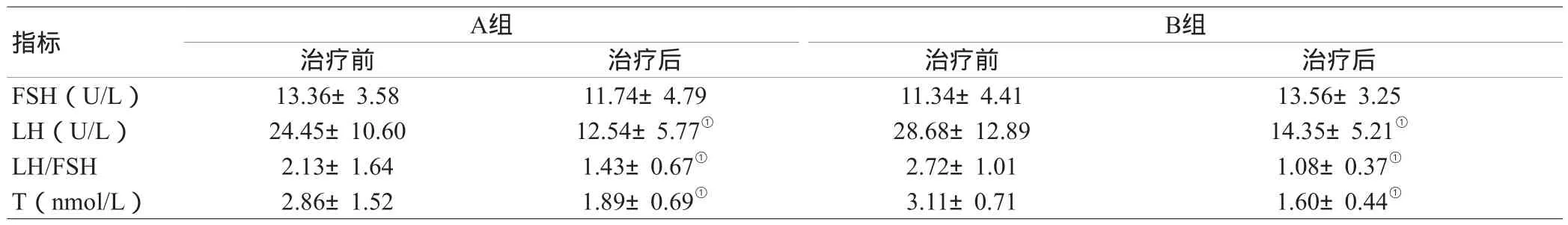
表3 两组患者治疗前后生殖激素的改变( )
注:与自身治疗前比较,①P<0.05
B组治疗前 治疗后 治疗前 治疗后FSH(U/L) 13.36±3.58 11.74±4.79 11.34±4.41 13.56±3.25 LH(U/L) 24.45±10.60 12.54±5.77① 28.68±12.89 14.35±5.21①LH/FSH 2.13±1.64 1.43±0.67① 2.72±1.01 1.08±0.37①T(nmol/L) 2.86±1.52 1.89±0.69① 3.11±0.71 1.60±0.44①指标 A组
2.4 两组患者治疗前后卵巢体积与卵泡数的变化:治疗前
后阴道超声显示,双侧卵巢体积及卵泡数均显著减小(P<0.05),但组间疗效比较差异无统计学意义(P>0.05),见表4。
表4 两组患者治疗前后卵巢体积与卵泡数的变化( )
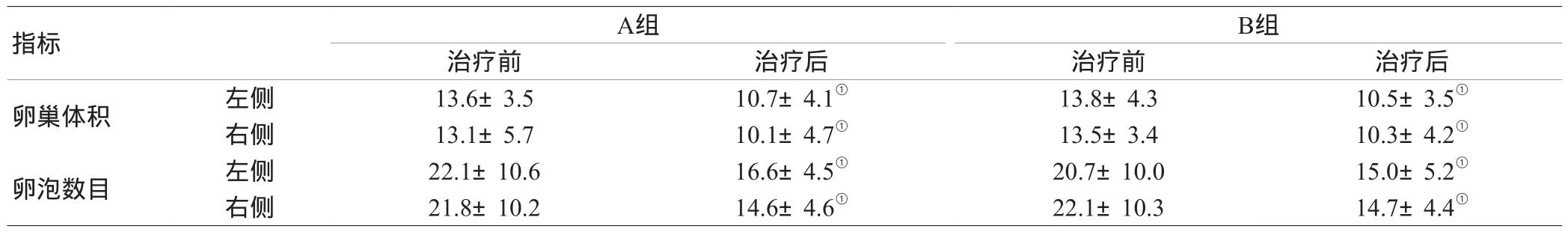
表4 两组患者治疗前后卵巢体积与卵泡数的变化( )
注:与自身治疗前比较,①P<0.05
B组治疗前 治疗后 治疗前 治疗后卵巢体积 左侧 13.6±3.5 10.7±4.1① 13.8±4.3 10.5±3.5①右侧 13.1±5.7 10.1±4.7① 13.5±3.4 10.3±4.2①卵泡数目 左侧 22.1±10.6 16.6±4.5① 20.7±10.0 15.0±5.2①右侧 21.8±10.2 14.6±4.6① 22.1±10.3 14.7±4.4①指标A组
2.5 两组患者治疗后排卵率与妊娠率的变化:A组和B组排卵率与妊娠率的比较,A组排卵率及妊娠率均优于B组,但两组疗效差异无统计学意义(P>0.05),见表5。
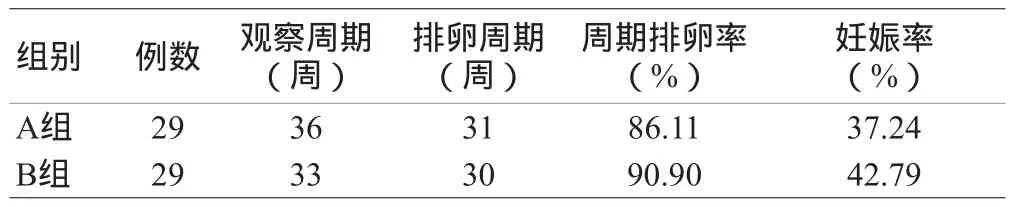
表5 两组患者治疗后排卵率与妊娠率的变化
3 讨论
PCOS因其两大基本特征成为育龄妇女不孕的常见病因。除因下丘脑—垂体—卵巢轴调节功能异常从而导致的高LH、高雄激素及相对较低水平的FSH,使患者因无法产生优势卵泡而妊娠外,IR或成为PCOS的发病机制中的关键因素[1-2]。高胰岛素可抑制肝脏性腺素结合蛋白(SHBG)及胰岛素生长因子结合蛋白(IGFBP)的合成,加重PCOS患者的高雄激素血症[3]。实验研究也证明其可诱导大鼠卵巢中卵泡膜细胞和间质细胞增生,导致卵泡发育停滞[4]。武秀峰等研究表示口服葡萄糖耐量试验(OGTT)正常的PCOS患者子宫内膜可能依然存在IR现象,这种现象可能影响子宫内膜发育,此可能是PCOS妊娠率低或孕后流产率高的原因之一,故对有生育要求的PCOS不孕患者改善IR更有其必要性[5]。同时观察发现,PCOS患者多伴有血糖异常及肥胖症状,其存在高胰岛素血症→肥胖→血糖↑→IR→肥胖→高胰岛素血症的恶性循环。
达英-35作为治疗PCOS一线用药,可竞争双氢睾酮受体,抑制5α-还原酶活性,并抑制促性腺激素分泌而减少卵巢雄激素的合成。另外,其雌激素成分炔雌醇可促肝脏合成SHBG,降低血循环中的游离雄激素。但有文献显示单用达英-35不能改善IR状态及与其相关的脂代谢紊乱[6]。综上所述,治疗PCOS-IR不孕患者除常规用药外还应配合胰岛素增敏剂联合治疗。
二甲双胍应用于临床已有50多年历史,可抑制葡萄糖吸收,降低肝糖原合成,增加外周组织对胰岛素的敏感性。最新研究发现,二甲双胍可直接作用于卵巢降低卵巢细胞色素P450c17α及卵泡膜细胞CYPl7活性,减少雄激素合成。在PCOS-IR患者中长期应用二甲双胍治疗可以促进排卵、改善月经周期以及减少血清T水平[7-8]。
罗格列酮是第二代噻唑烷二酮类口服降糖药,其作用机制主要是通过与核受体—过氧化物酶体增生激活受体结合,并与视黄醇X受体形成二聚体,作用于靶基因启动子区的特异核苷酸序列重复区,增强一系列特定基因的表达,包括前脂肪细胞分化加快,成熟的脂肪细胞对胰岛素更敏感等,从而缓解IR。本次观察显示,其虽在改善向心性肥胖方面不及前者,但在改善IR方面明显优于二甲双胍。同时,PCOS-IR不孕患者常需借助促排卵法提高排卵率及妊娠率。众多文献显示,对于单用CC促排卵无效患者,联合使用罗格列酮后,促排卵效果明显加强,此次观察同意上述说法[9-10]。所有58例患者中均未出现恶心、呕吐、腹泻等不良药物反应。
两组患者在接受两种方案治疗后均可改善卵巢生殖功能及内分泌水平,帮助不孕患者妊娠。临床中还有运用无水酒精注射及腔镜治疗PCOS-IR不孕患者,两种外科治疗方法均可有腹痛、发热等不良反应,还可因机械原因导致盆腔粘连的可能,故患者治疗时较为痛苦,其接受度不高。因此,在治疗PCOS-IR不孕患者中还需进一步研究观察,同时应对患者进行更为细致的个体化治疗以增强治疗效果。
[1]彭爱萍,张水仙.达英-3配合促排卵法治疗多囊卵巢综合征不孕的疗效观察[J].实用预防医学,2011,18(9):1699.
[2]崔 伟,文 璞.3种方案治疗合并胰岛素抵抗的多囊卵巢综合征患者疗效研究[J].中外医疗,2010,29(35):14.
[3]乐 杰.妇产科学[M].第7版.北京:人民卫生出版社,2010:33.
[4]Kuscu NK,Koyuncu F,Ozbilgin K,et a1.Does it indcluce follicular arrest in the rat ovary[J].Gynecology Endocrinol,2002,16(5):361.
[5]金 红.多囊卵巢综合征脂代谢异常的研究[D].延边大学:生理学,2007.
[6]丁 晖,王素香,位玲霞.达英-35联合罗格列酮治疗PCOS合并IR患者25例疗效观察[J].山东医学,2009,49(51):96.
[7]孙 慧,杨振宇,曾 涛.多囊卵巢综合征的药物治疗机制新进展[C].第三届全国妇科医学大会,2012.
[8]李曾一,李玉秀.二甲双胍在多囊卵巢综合征治疗中的作用[J].药品评价,2012,5(27):15.
[9]王炼炼,丘 彦,白晓苏,等.罗格列酮改善PCOS患者的生殖和内分泌功能[J].重庆医科大学学报,2005,30(3):366.
[10]张翠莲,高航云,赵志刚,等.罗格列酮和二甲双胍治疗胰岛素抵抗多囊卵巢综合征的临床研究[J].中国实用妇科与产科杂志,2004,20(8):477.
