萝卜籽中活性成分提取及抑菌效果的研究
2013-11-12李东华叶春苗
李东华,叶春苗
(1.沈阳化工大学 制药与生物工程学院,辽宁 沈阳 110142;2.辽阳职业技术学院 化工系,辽宁 辽阳 111000)
萝卜又名莱菔,是十字花科(Cruciferous)植物的一种,在中国根菜类蔬菜中,占有极为重要的地位[1-3],其硫代葡萄糖苷含量非常丰富,硫代葡萄糖苷是十字花科蔬菜中重要的次生代谢产物,到目前为止已发现有近120 种[4-5],广泛存在于十字花科植物如萝卜、甘蓝、黑芥子和辣根等中.据资料报道蔬菜在破碎时硫苷可被内源芥子酶(myrosinase)水解成异硫氰酸酯盐.异硫氰酸酯盐是抗癌效果较好的生物活性物质之一,具有较强的抗菌、抗氧化作用.
目前对于硫苷活性的研究主要集中在提取、纯化、活性研究等方面,对硫苷的各种研究都要以提取为前提,因此很多学者致力于高提取率的硫苷成分的研究,李洁,谭正林等[6]利用正交旋转设计方法进行水提硫苷,提取液浓度可达到0.9 g/L以上,但这种方法的影响因素较多,分析过程也较复杂.本实验拟寻找一种简单、方便的提取方法,利用超声波辅助,以水为提取剂,通过正交实验优化萝卜籽硫苷的提取工艺,并对粗提物的抑菌效果做了探讨,为萝卜籽中硫苷的抗菌研究奠定一定的理论基础.
1 实验部分
1.1 实验材料
萝卜种子(购买于沈阳农业大学种子公司)进行消毒处理,具体方法为:用体积分数75 %的酒精冲洗2 次消毒,然后用无菌去离子蒸馏水清洗2 次,置于干燥箱(40 ℃)烘干,备用[7].
将灭菌烘干处理的萝卜种子置于干燥箱内,在90 ℃下烘2 h,使萝卜种子中的硫代葡萄糖苷酶失活,再用粉碎机粉碎,过40 目筛,以石油醚脱脂,烘干,密封备用.
1.2 实验方法
1.2.1 真菌的分离提取与继代繁殖方法
实验菌种从脚癣、手癣患者身上直接取样.首先用酒精对患癣部位消毒,接着用灭菌棉棒沾取患癣部位的脓水,涂于土豆培养基平板上,培养4 d 后从长满菌落的平板上刮取部分菌落,置于20 mL 无菌去离子蒸馏水中,摇匀过滤菌丝,菌液涂布在土豆培养基平板上,培养4 d 左右用划线法分离菌株,结果见图1 和图2.
根据资料显示引起手足癣的菌株主要为红色发癣菌(Trichophyfon purpureatum),本实验中筛选出来的菌种呈现红色,基本表现出红色发癣菌的特征,故可作为抑菌实验的研究对象[8-9].

图1 划线法分离菌株Fig.1 Fungus bacterial strain

图2 菌悬液Fig.2 Fungus suspension inoculation
1.2.2 硫苷的提取方法
在一定温度、料液质量比、时间、超声功率等条件下,采用水提法进行硫苷提取工艺研究.
1.2.3 萝卜籽中硫苷含量的测定方法
准确称取萝卜籽粉末100 mg,移入10 mL具塞刻度试管中,沸水浴中干蒸10 min,加沸蒸馏水6~8 mL,再蒸煮30 min.取出冷却后定容至10 mL 过滤.取滤液2 mL 于10 mL 比色管,加4 mL 质量分数0.15 %的羧甲基纤维素钠,摇匀后再加2 mL 浓度为8 mmol/L 的氯化钯显色溶液,在(22 ±3)℃放置2 h,在紫外可见分光光度计540 mm 处以氯化钯-羧甲基纤维素钠空白溶液作为参比溶液,测其吸光度.
1.3 水提硫苷法提取条件的设定
1.3.1 温度对硫苷提取效率的影响
称取5 份0.2 g 脱脂萝卜籽粉末,加入20 mL 水置于150 mL 三角瓶中,分别在20、30、40、50、60 ℃的60 W 超声波条件下提取15 min,3 000 r/min离心15 min,过滤,取滤液2 mL 测定硫苷含量.
1.3.2 破碎时间对硫苷提取效率的影响
称取8 份0.2 g 脱脂萝卜籽粉末,加入20 mL 水置于150 mL 三角瓶中,分别在20 ℃、60 W 的超声辅助下,提取5、15、25、35、45、55、65、75 min,3 000 r/min 离心15 min,过滤,取滤液2 mL 测定硫苷含量.
1.3.3 水料质量比对硫苷提取效率的影响
称取5 份1.0 g 脱脂萝卜籽粉末分别加入10、15、20、25、30 mL 水置于150 mL 三角瓶中,在40℃,60 W 超声波下提取25 min,3 000 r/min离心15 min,过滤,取滤液2 mL 测定硫苷含量.
1.3.4 超声波功率对硫苷提取效率的影响
称取6 份2.0 g 脱脂萝卜籽粉末,加入20 mL 水置于150 mL 三角瓶中,温度为40 ℃,分别在40、50、60、70、80、90 W 的超声辅助下提取30 min,3 000 r/min 离心15 min,过滤,取滤液2 mL测定硫苷含量.
2 结果与分析
2.1 标准曲线的绘制
准确称取硫苷含量分别为10 μmol/g、20 μmol/g、30 μmol/g、40 μmol/g、50 μmol/g 的标准液100 mg 于10 mL 具塞刻度试管中,采用氯化钯比色法测定吸光值,以硫苷含量为横坐标,吸光值为纵坐标绘制标准曲线[10],如图3 所示.
硫苷标准曲线:
A=0.004 9c+0.035 6.

图3 硫苷含量标准曲线的制作Fig.3 Standard curve of glucosinolates content
2.2 萝卜籽中硫苷最佳提取条件确定
单因素实验确定破碎温度为40 ℃时,破碎时间30 min,加水量为15 mL/g,超声功率为60 W 时,提取效果达到最佳.根据单因素的实验结果,选用L(34)正交设计表(见表1)进行正交实验,结果见表2.由表2 可知,按照极差R 的大小,影响种子中硫苷提取率的因素主次顺序为B>C >D >A,即水料质量比>提取温度>提取时间>超声波功率;根据K 值可知因素最优组合条件为A3B1C3D2,即超声波功率70 W、破碎时间30 min、破碎温度40 ℃、水料质量比为15.
为进一步判断上述4 类受控制的因素对实验结果的影响是否存在,运用DPS 数据处理软件对正交实验数据进行方差分析,找出这些因素中起主导作用的变异来源[11-12].由表3 可知,4因素对硫苷提取率的影响都很显著(P <0.05),其中B、C 的影响最显著,其次是D、A,证明正交实验设计正确合理,综上所述,实验最终确定的提取条件为:A3B1C3D2.
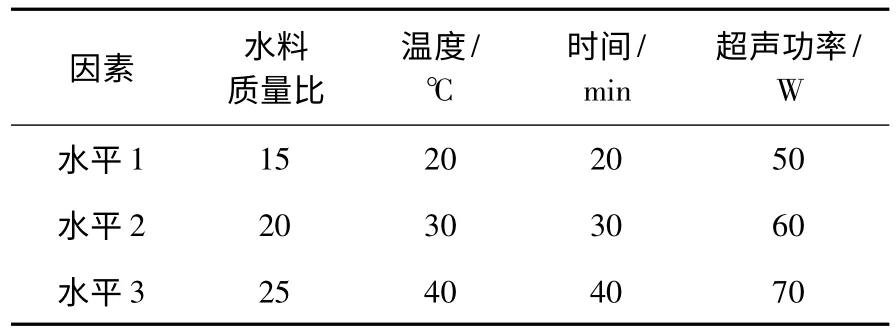
表1 L9(34)因素水平表Table 1 Factors and levels of test

表2 正交结果处理表Table 2 Results of orthogonal test

表3 正交实验方差分析表Table 3 Analysis of variance table
2.3 抑菌实验
实验分别在正交实验获得的最优提取方案A3B1C3D2(硫苷含量65.59 μmol/g)、任意两组组合A2B2C2D3(硫苷含量57.22 μmol/g)和A1B1C2D2(硫苷含量50.9 μmol/g)条件下进行硫苷的提取,研究提取液的抑菌效果.在混菌平板上分别加入上述3 个提取条件下的提取液100 μL,在28 ℃下培养4 d,抑菌效果见图4~图7.

图4 水(对照)Fig.4 Water(control experiment)

图5 A1B1C2D2的抑菌效果Fig.5 Inhibitory effect of A1B1C2D2group

图6 A2B2C2D3的抑菌效果Fig.6 Inhibitory effect of A2B2C2D3group

图7 A3B1C3D2(最优)抑菌效果Fig.7 Inhibitory effect of A3B1C3D2group
实验初步测量图4~图7 的抑菌圈直径大小,分别为0 cm、0.75 cm、0.82 cm、1.54 cm,由此可知萝卜种子提取液的抑菌活性随硫代葡萄糖苷的含量增加而增加,萝卜种子中的抑菌活性与硫代葡萄糖苷的含量有直接关系,萝卜种子提取液的抑菌效果在正交最优方案下提取液中硫代葡萄糖苷的含量达到最大,抑菌效果也达到最好.
3 结论
以脱脂的烘干萝卜籽粉末为原料,采用超声波辅助加热的方法提取萝卜种子中的活性成分,通过正交实验的结果可得:影响种子中硫苷提取率的因素主次顺序为B >C >D >A,即水料质量比>提取温度>提取时间>超声波功率;根据K值可知4 因素最优组合条件为A3B1C3D2,即超声波功率70 W、破碎时间30 min、破碎温度40℃、水料质量比15.
萝卜种子提取液的抑菌活性随硫代葡萄糖苷的含量增加而增加,萝卜种子中的抑菌活性与硫代葡萄糖苷的含量有直接关系,萝卜种子提取液的抑菌效果在正交最优化的方案下提取液中硫代葡萄糖苷的含量达到最大,抑菌效果也达到最好.
实验还有一定的不足之处:①萝卜种子内含物中还有糖类、醇类等成分对硫代葡萄糖苷提取的影响没有做进一步的研究;②在本实验中硫代葡萄糖苷的提取只属于初步的提取,硫代葡萄糖苷的纯化、精制还待进一步研究;③在抑菌试验中硫代葡萄糖苷的抑菌机理及抑菌的持久性还待进一步研究.
[1]陈精明,包宗宏.硫代葡萄糖苷测定方法的新进展[J].中国油脂,2003,28(5):44-47.
[2]修丽丽,钮昆亮.十字花科植物中的硫代葡萄糖苷及其降解产物[J].浙江科技学院学报,2004,16(3):187-189.
[3]Bennett R N,Mellon F A,Botting N P,et al.Identification of the Major Glucosinolate(4-methulsulfinyl glucosino-late)in Leaves of Eruca Sativa(Salad rocket)[J].Phy-tochemistry,2002,61(1):25-30.
[4]王见冬,袁其朋,钱忠明.萝卜硫素研究进展[J].食品与发酵业,2003,29(2):76-80.
[5]Brown P D,Tokuhisa J G,Reichelt M,et al.Variation of Glucosinolate Accumulation among Different Organs and Developmental Stages of Ambidopsis Thaliana[J].Phytochemistry,2003,62(3):471-481.
[6]李洁,谭正林,王清章,等.正交旋转设计优化萝卜籽硫苷提取工艺[J].食品科学,2008,29(12):264-269.
[7]王向阳,周蓉,姜丽佳.西兰花中提取的萝卜硫苷的稳定性研究[J].食品科技,2009,12(34):50-257.
[8]胡新文,郭建春,郑学勤.抗真菌蛋白Rs-AFPs 生物学特性的研究[J].热带作物学报,2005,19(2):36-42.
[9]张丽,何洪巨,陈静华,等.不同萝卜品种中硫代葡萄糖苷组分及含量分析[J].中国蔬菜,2010(18):43-46.
[10]李秋云,戴绍军,陈思学,等.萝卜芥子油苷组分及含量的分析[J].园艺学报,2008,35(8):1205-1208.
[11]Padilla G,Cartea M E,Velasco P,et al.Variation of Glucosinolates in Vegetable Crops of Brassica Rapa[J].Phytochemistry,2007,68(4):536-545.
[12]单毓娟,吴坤.十字花科蔬菜的癌症预防作用[J].国外医学卫生学分册,2005,32(5):269-273.
