UPLC-MS/MS法同时检测血浆中氧化芍药苷、芍药内酯苷和苯甲酰芍药苷
2013-11-01牟景丽张治蓉王永林
何 峰,牟景丽,张治蓉,郑 林,王永林,黄 勇*
(1.贵阳医学院药学院,民族药与中药开发应用教育部工程研究中心,贵州贵阳 550004;2.贵州省药物制剂重点实验室,贵州贵阳 550004)
赤芍为毛茛科植物芍药 Paeonia lactiflora Pall.或川赤芍Paeonia veitchii Lynch的干燥根,性味苦、微寒,归肝经,具有清热凉血、散瘀止痛之功能,主要用于治疗温毒发斑、目赤肿痛、经闭痛经、跌扑损伤、肝郁胁痛等症[1-2]。现代药理研究表明,赤芍富含的各种单萜及苷类成分具有抗炎、抗病毒、免疫调节等作用[3-5],氧化芍药苷、芍药内酯苷、苯甲酰芍药苷为赤芍中主要单萜苷类成分[6-7],药物动力学研究有助于解释并预测与药物作用和毒性有关的现象,是药物治疗的基础,因此本实验以氧化芍药苷、芍药内酯苷、苯甲酰芍药苷为指标性成分,研究大鼠静脉注射赤芍提取物后体内的动力学特征,为赤芍的物质基础的阐明及临床用药的安全性和有效性提供实验依据。
1 材料
1.1 仪器 超高液相色谱-三重四级杆质谱联用仪(美国Waters公司);Allegra 64R高速离心机(美国Beckman Coulter公司);ZH—2涡旋混合器(天津药典标准仪器厂);MTN—2800D氮吹仪(天津奥特塞恩斯公司);CQ 250A—TS超声波清洗机(上海跃进医用光学器械厂)。
1.2 试剂与试药 氧化芍药苷对照品(批号为20120310,纯度≥98%)、芍药内酯苷对照品(批号为S37—100126,纯度≥98%)、苯甲酰芍药苷对照品(批号为20120315,纯度≥98%)购自江西本草天工科技有限公司,葛根素对照品(批号为0752—9605,纯度≥98%)购自中国食品药品检定研究院;色谱乙腈(德国Merck公司);水为超纯水;其余溶剂均为分析纯。
赤芍提取物制备(批号为20120615) 赤芍15 kg,3次水提,60%乙醇沉淀,用饱和正丁醇再提取,在聚酰胺柱乙醇洗脱,微波真空干燥。
1.3 实验动物 健康SD大鼠18只,雌雄兼用,体质量为(230±10)g,由贵阳医学院动物中心提供,动物许可证号SCXK(黔)2002-0001。
2 实验方法
2.1 标准溶液的配制 分别精密称取各对照品适量,置10 mL量瓶中,用甲醇溶解并定容,获得氧化芍药苷(0.97 mg/mL)、芍药内酯苷(0.968 mg/mL)、苯甲酰芍药苷(0.986 mg/mL)的贮备液,同法配制内标葛根素贮备液(1 mg/mL)。取葛根素贮备液适量,置25 mL量瓶中加甲醇稀释至刻度,获得葛根素[8-9]工作溶液(20μg/mL),置冰箱(-20℃)保存,备用。
2.2 色谱条件 Waters Acquity BEH C18色谱柱(2.1 mm×50 mm,1.7μm);0.1%甲酸乙腈 -0.1%甲酸水梯度洗脱,梯度为0~2 min:5% ~25%,2~3 min:25% ~90%,4 min:5%;体积流量为0.35 mL/min;柱温45℃ 。进样体积为1μL。
2.3 质谱条件 Waters Acquity TQD质谱仪,MassLynxV4.1工作站,电喷雾电离源(ESI);毛细管电压3 kV;离子源温度120℃;去溶剂气温度350℃;去溶剂气为氮气(650L/h);碰撞气为氩气(0.16 mL/min);扫描方式为多反应离子监测模式(MRM),用于定量的正离子对等质谱信息见表1。

表1 质谱条件Tab.1 Mass spectrometric conditions
2.4 血浆样品处理方法[10-11]取大鼠血浆100μL,依次加入 10μL内标葛根素溶液(20μg/mL),50μL 1%甲酸溶液,400μL 乙腈,涡混1 min,15000 r/min离心10 min,取上清液置离心管中,45℃氮气吹干,残留物用300μL甲醇溶解,离心,取上清1μL进样。
3 结果
3.1 专属性 取大鼠空白血浆100μL,除不加内标外,其余按2.4项下操作,得空白样品色谱图A;将氧化芍药苷、芍药内酯苷、苯甲酰芍药苷混合标液和内标溶液加入空白血浆,依法操作,得相应色谱图B;取大鼠给药后血浆,依法操作,得相应色谱图C,结果见图1。由结果可以看出氧化芍药苷、芍药内酯苷、苯甲酰芍药苷分离良好,基质无干扰。
3.2 标准曲线和灵敏度 取大鼠空白血浆100μL,依次加入系列混合标准溶液50μL,按“血浆样品处理方法”项下操作,建立标准曲线。以待测物的峰面积与内标峰面积之比(A/Ai)为纵坐标Y,各物质浓度(C)为横坐标X进行直线回归,权重系数为1/X,求的直线方程,即为标准曲线。结果3个成分的线性方程分别为:氧化芍药苷Y=0.2127X+0.0074(线性范围0.07~17.32μg/mL,r>0.9978)、芍药内酯苷Y=0.4525X+0.0089(0.57 ~138.29μg/mL,r>0.9960)、苯甲酰芍药苷Y=0.3347X+0.0034(0.07~17.61μg/mL,r>0.9980);LOD 分别为5.5、7.4、3.7 ng/mL。

图1 MRM色谱图Fig.1 MRM chromatograms
3.3 准确度和精密度 按3.2标准曲线项下分别配制3个成分大鼠血浆低、中、高3个质量浓度的质量控制样品(QC),每一个质量浓度进行5样本分析,连续测定3 d。求得氧化芍药苷、芍药内酯苷、苯甲酰芍药苷3个成分准确度为81.5%~112.0%;日内精密度RSD为2.9%~11.5%;日间精密度RSD为0.8% ~7.4%,结果见表2。
表2 大鼠血浆中3种成分的日内、日间精密度和准确度(,n=5,3 days)Tab.2 Accuracy,intra-and inter-day precision of the three components(,n=5,3 days)

表2 大鼠血浆中3种成分的日内、日间精密度和准确度(,n=5,3 days)Tab.2 Accuracy,intra-and inter-day precision of the three components(,n=5,3 days)
检测成分 加入质量浓度/(μg·mL-1) 日内精密度RSD/%日间精密度RSD/% 准确度/%0.07 0.06±0.01 2.93 7.40 81.54氧化芍药苷 0.64 0.53±0.05 10.12 7.22 83.075.77 5.08±0.58 11.45 3.65 88.070.56 0.55±0.05 9.11 2.55 97.53芍药内酯苷 5.12 4.78±0.41 8.66 0.79 93.3346.09 41.05±3.39 8.27 0.38 89.070.061 0.08±0.01 9.41 6.58 109.40苯甲酰芍药苷 0.55 0.73±0.06 8.66 4.94 112.044.91 5.13±0.23 4.47 4.21 87.55
3.4 提取回收率和基质效应考察 配制3个成分的大鼠血浆低、中、高3个质量浓度的质量控制样品(QC),按“2.4项血浆样品处理”项下操作,获得相应峰面积值(A);另取空白血浆,按“血浆样品处理”项下操作,离心后获得上清液,加入与上述相应质量浓度的标准溶液,于30℃氮气吹干,以300μL甲醇复溶,获得相应峰面积值(B);另取上述低、中、高3个质量浓度的对照溶液50μL与内标10μL,30℃氮气吹干,残留物以300μL甲醇复溶,得相应峰面积(C),每一个质量浓度均以5样本进行分析,内标同法考察。以A/B(%)计算提取回收率,B/C(%)计算基质效应。氧化芍药苷、芍药内酯苷、苯甲酰芍药苷3个成分的提取回收率为92.2% ~104.4%,内标葛根素提取回收率为90.7%;氧化芍药苷、芍药内酯苷、苯甲酰芍药苷3个成分基质效应为85%~115%,内标葛根素基质效应为93.6%,表明均不存在明显的基质效应。
3.5 稳定性考察 配制氧化芍药苷等3个成分的大鼠血浆低、中、高3个质量浓度的质量控制样品(QC),样品处理后至自动进样器中,在0 h,6 h分别进样,以考察处理后血浆样品中氧化芍药苷等3个成分在自动进样器条件下的稳定性,以每一质量浓度3样本分析。同法配制低、中、高3个质量浓度血浆样品(QC),分别在室温(约20℃)下放置6 h,4℃下冷藏8 h,冻融3次,经处理后进样测定浓度,以考察血浆中氧化芍药苷等3个成分在室温,冷藏,反复冻融条件下的稳定性。以每一质量浓度3样本分析。结果表明氧化芍药苷、芍药内酯苷、苯甲酰芍药苷3个成分在各条件下均稳定,其RSD小于15.1%。
3.6 药动学实验 健康SD大鼠18只,雌雄各半,体质量为(230±20)g,给药前12 h禁食,自由饮水。尾静脉注射赤芍提取物溶液。于给药前与给 药 后 5、10、20、30、45、60、90、120、140 min经尾静脉取血约0.4 mL置涂有肝素的塑料离心管中,4500 r/min离心10 min,分离血浆于-20℃冰箱中保存,直至分析[12-14]。实验所有数据均用表示,采用DAS 2.0软件(中国数学药理专业委员会)计算各检测成分的药动学参数。氧化芍药苷、芍药内酯苷、苯甲酰芍药苷3个成分的C-t曲线见图2,药动学参数见表3。
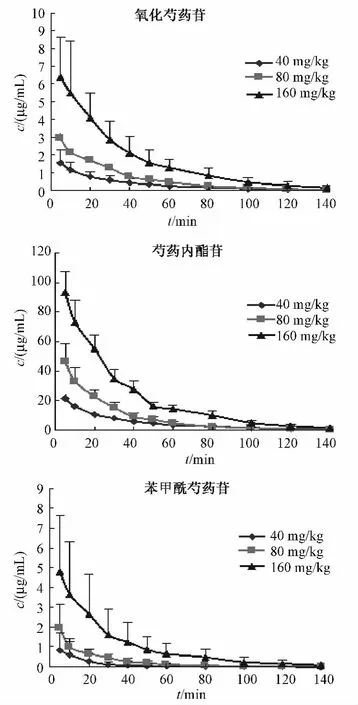
图2 大鼠静脉注射低、中、高剂量赤芍提取物后氧化芍药苷、芍药内酯苷、苯甲酰芍药苷的C-t曲线(,n=6)Fig.2 Concentration-time profiles of three components after i.v of 40,80,160 mg/kg of Radix Paeoniae Rubra extract to rat(,n=6)
表3 低、中、高剂量下氧化芍药苷、芍药内酯苷、苯甲酰芍药苷的主要药动学参数(,n=6)Tab.3 Pharmacokinetic parameters describing disposition after i.v of 40,80,160 mg/kg of Radix Paeoniae Rubra extract to rat(,n=6)

表3 低、中、高剂量下氧化芍药苷、芍药内酯苷、苯甲酰芍药苷的主要药动学参数(,n=6)Tab.3 Pharmacokinetic parameters describing disposition after i.v of 40,80,160 mg/kg of Radix Paeoniae Rubra extract to rat(,n=6)
氧化芍药苷 芍药内酯苷 苯甲酰芍药苷低剂量 中剂量 高剂量 低剂量 中剂量 高剂量 低剂量 中剂量 高剂量t1/2α/min 12.6±12.5 23.6±8.6 21.4±9.2 16.5±10.4 20.3±7.4 18.2±10.7 5.5±2.9 7.4±8.1 15.4±10.1 t1/2β/min 24.2±12.5 25.9±7.3 30.7±6.5 24.5±1.2 20.2±8.5 33.2±28.7 34.9±36.0 44.3±13.7 39.4±29.1 V/(L/kg) 19.4±15.9 33.4±19.9 28.1±9.6 1.7±0.98 3.0±2.9 1.7±1.2 30.1±25.9 75.1±39.7 39.5±42.5 CL/(L/min·kg)0.65±0.23 0.69±0.32 0.60±0.20 0.047±0.016 0.072±0.064 0.045±0.019 1.9±1.0 2.8±1.4 1.3±1.1 AUC(0-tmin)/(mg/L·min) 53.2±21.8 106.4±39.5235.1±34.1 760.6±0.13 1653.0±97.5 3407.3±73.6 28.7±36.6 33.7±36.5 178.9±24.4 AUC(0-∞)/(mg/L·min) 69.9±28.6 133.4±32.7292.8±38.1 977.6±23.4 1903.0±104.2 3489.9±87.8 41.5±3.2 43.8±43.房室参数0 237.5±24.5
4 讨论
4.1 本实验建立了UPLC-MS/MS测定大鼠静脉注射赤芍提取物后血浆中氧化芍药苷、芍药内酯苷、苯甲酰芍药苷的分析方法,并对其方法进行了全面的方法学考察,结果表明此方法对3种检测成分可特异、快速、准确、灵敏的同时测定。
4.2 药动学参数结果表明,氧化芍药苷、芍药内酯苷、苯甲酰芍药苷在大鼠体内符合二室药动学模型,3个指标成分在大鼠体内分布半衰期(t1/2α)为5.5~23.6 min,消除半衰期(t1/2β)为20.2~44.3 min,表明其分布与消除均较迅速。分布容积(V)结果表明氧化芍药苷(19.4~33.4 L/kg)、苯甲酰芍药苷(30.1~75.1L/kg)与芍药内酯苷(1.7~3.0 L/kg)相比存在较大的差异,前两者为后者的10~20倍,同时3者的清除率(CL)也与之相似,氧化芍药苷、苯甲酰芍药苷、芍药内酯苷的CL分别为0.60~0.69L/(min/kg)、1.3~2.8 L/(min/kg)、0.045~0.072 L/(min/kg),存在较大差异。
4.3 氧化芍药苷、芍药内酯苷、苯甲酰芍药苷的药时曲线下面积结果表明芍药内酯苷要明显大于氧化芍药苷和苯甲酰芍药苷,这不仅与3者在提取物中的含量有关,还可能与芍药内酯苷在体内分布容积小、清除较慢(与氧化芍药苷和苯甲酰芍药苷相比)而增加了其在血浆中的暴露量有关。赤芍提取物中氧化芍药苷、芍药内酯苷、苯甲酰芍药苷在大鼠体内的药动学参数的差异性在一定程度上体现了中药多成分、多作用机制的特征,因此开展其多指标成分药动学研究,有利于更为全面的了解其体内过程,为赤芍药材的进一步开发利用提供依据。
[1]阮金兰,赵钟祥,曾庆忠,等.赤芍化学成分和药理作用的研究进展[J].中国药理学通报,2003,19(9):965-970.
[2]刘 超,王 静,杨 军.赤芍总甙活血化瘀作用的研究[J].中药材,2000,23(9):557-560.
[3]胡世林,付桂兰,冯学锋,等.不同产地和部位赤芍中芍药苷的含量测定[J].中国中药杂志,2000,25(12):714-716.
[4]肖尚喜,张咏南,史百芬.芍药总苷促干扰素诱生及抗病毒作用的研究[J].中国药理学通报,1993,9(1):58-60.
[5]李 文,殷小杰,廖福龙,等.六种产地赤芍对大鼠抗凝血及抗血小板聚集作用的比较[J].中国实验方剂学杂志,2001,7(6):30-31.
[6]陈海生,廖时萱,洪志军,等.川赤芍化学成分的研究[J].中国药学杂志,1993,28(3):137-138.
[7]王云涛,王莉梅,金向群.赤芍的高效液相指纹图谱及液-质联用分析[J].中成药,2010,32(7):1089-1092.
[8]黄 勇,何 峰,郑 林,等.UPLC-ESI-MS/MS法研究注射用复方荭草在大鼠体内的排泄[J].中成药,2012,34(5):879-883.
[9]黄 勇,何 峰,郑 林,等.UPLC-MS/MS同时测定Beagle犬血浆中原儿茶酸、异荭草素和野黄芩苷[J].中成药,2011,27(5):716-719.
[10]孙 兰,李家春,李 芳,等.惊天宁注射液在大鼠体内药代动力学研究[J].中药药理与临床,2011,27(4):80-83.
[11]沈 熊,梁 健,杨春欣,等.大鼠血浆中绿原酸和木犀草苷的 HPLC法测定[J].中成药,2012,34(11):2099-2102.
[12]党晓伟,李 清.紫丁香苷在大鼠体内的药动学研究[J].中成药,2012,34(7):1246-1249.
[13]王 巧,杨汉煜,刘伟娜,等.液相色谱-质谱联用测定大鼠血浆中芍药内酯苷及其药动学研究[J].中国药学杂志,2008,43(15):1170-1173.
[14]谭朝丹,马越鸣,石 荣,等.黄芩对大鼠体内甲苯磺丁脲药动学的影响[J].中成药,2011,33(7):1153-1158.
