快速诱导细胞凋亡及检测方法研究
2013-10-29周良彬雷航谭文佳陈俊鹏周晓余晓丽
周良彬,雷航,谭文佳,陈俊鹏,周晓,余晓丽
武汉工业学院 生物与制药工程学院,湖北 武汉 430023
随着细胞凋亡检测技术的不断发展和日渐成熟,细胞凋亡检测的实验室教学也显得颇为重要。然而,用于科学研究的检测方法由于耗材、耗时、操作繁琐等原因不适合实验教学,所以研究如何快速诱导细胞凋亡,建立经济、简便、快速的检测细胞凋亡的实验室教学方法是目前实验教学中亟待解决的问题。细胞凋亡的诱导因素主要有物理因素、化学因素及生物因素。物理因子包括射线、水涝[1]、高渗、机 械 胁 迫 等 ;化 学 因 子 有H2O2[2]、营 养 因 子[3]、NaCl、AlCl3、CaCl2等盐溶液[4-7];生物因子涵盖激素、细胞生长因子等。我们选择NaCl、CaCl2胁迫诱导法进行细胞凋亡的快速诱导,操作简便、经济,更适用于实验室教学。采用甲基绿-派诺宁试剂可对动、植物细胞进行细胞凋亡的快速检测,凋亡细胞核染成蓝绿色,细胞质染成红紫色。
1 材料与方法
1.1 材料
洋葱鳞茎内表皮、大蒜根尖、鸡血。
离子胁迫诱导溶液:NaCl、无水CaC12、蒸馏水。
鸡血红细胞处理液:0.75%生理盐水、Hanks液。
甲基绿-派诺宁试剂:2%甲基绿水溶液6 mL、5%派诺宁水溶液2 mL、0.1 mol/L醋酸盐缓冲液(pH4.8)(0.1 mol/L醋酸 40 mL,0.1 mol/L醋酸钠60 mL)16 mL、蒸馏水 16 mL,临用时混合,存于冰箱中,可用数次。
1.2 离子胁迫诱导法探讨最佳诱导浓度
取新鲜洋葱在室温下于清水中培养数小时,使其活化。自培养好的洋葱鳞茎上切取1 cm2左右的内表皮若干,洋葱鳞茎内表皮细胞经0.1、0.2、0.3、0.4、0.5 mol/L共5个不同浓度梯度的NaCl、CaCl2离子胁迫处理2 h后,用显微镜观察其形态变化。
1.3 离子胁迫诱导法探讨最适诱导时间
取新鲜洋葱在室温下于清水中培养数小时,使其活化。自培养好的洋葱鳞茎上切取1 cm2左右的内表皮若干,用0.4 mol/L的CaC12溶液诱导,诱导时间分别为 2、4、6、8、10、12、14 h,用光学显微镜观察凋亡细胞的形态学变化并计数。
1.4 甲基绿-派诺宁染色法检测洋葱鳞茎内表皮细胞的凋亡
1.4.1 洋葱鳞茎内表皮预处理及凋亡诱导 取新鲜洋葱在室温下于清水中培养数小时,使其活化。从培养好的洋葱鳞茎上切取1 cm2左右的内表皮若干,分成3组。第1组正对照,为正常细胞;第2组试验组,于0.4 mol/L的CaCl2溶液中培养8 h得到的凋亡细胞;第3组负对照,为煮沸5 min的坏死细胞。
1.4.2 染色与镜检 将上述3组处理后的材料分别用甲基绿-派诺宁染色15~20 min,然后制片镜检观察,比较,各组细胞的形态特征和颜色变化并拍照。
1.5 甲基绿-派诺宁染色法检测大蒜根尖细胞的凋亡
1.5.1 大蒜根尖的预处理及凋亡诱导 取新鲜大蒜在室温下于清水中培养数天,使其长出新根。将长出新根的大蒜剪下根尖长约1 cm,分成3组。第1组正对照,为正常细胞;第2组试验组,于0.4 mol/L的CaCl2溶液中培养8 h得到的凋亡细胞;第3组负对照,为煮沸5 min的坏死细胞。
1.5.2 染色与镜检 将上述3组分别用甲基绿-派诺宁染液染色15~20 min,然后制片压片(注意压片适当,使细胞充分分开),镜检观察,比较各组细胞的形态特征和颜色变化并拍照。
1.6 甲基绿-派诺宁染色法检测鸡血红细胞的凋亡
1.6.1 鸡血红细胞的预处理及诱导凋亡 取新鲜的鸡血悬浮液3 mL左右,以4500 r/min离心5 min,弃上清液,加Hanks液,混匀,制成10%的鸡血细胞悬浮液。分别向3只小烧杯中加入上述悬浮液1 mL,向其中一只中滴加1 mL 0.4 mol/L的CaCl2溶液,静置8 h;向另一只中滴加0.75%生理盐水1 mL;向最后一只中滴加0.75%生理盐水1 mL,紫外线照射约20 min。
1.6.2 染色与镜检 取一滴10%的鸡血细胞悬浮液于载玻片上,滴加一滴甲基绿-派诺宁染液,静置15~20 min,用滤纸吸去染液,在酒精灯旁烘干固定(或用吹风机吹干),用水慢慢冲洗装片上的染液(水流不宜过激),再用吸水纸吸去载玻片上的水分,在酒精灯旁烘干固定(或用吹风机吹干)。镜检观察,比较各组细胞的形态特征和颜色变化并拍照。
2 结果
2.1 离子胁迫最佳诱导浓度
据实验观察,经0.1、0.2、0.3、0.4、0.5 mol/L浓度梯度的NaCl、CaCl2离子胁迫处理后均能诱导细胞凋亡,但凋亡的程度不同。表1简要描述了经不同浓度离子处理8 h后的细胞形态。
用不同浓度离子处理洋葱鳞茎内表皮后,取样并制片,每种处理各选取3个视野,统计总细胞数和凋亡细胞数(以细胞核染色质出现明显的边缘化凝集为标志),计算凋亡率[凋亡率(%)=(凋亡细胞数/总细胞数)×100%]。以离子浓度为x轴、凋亡率为y轴,绘制诱导离子浓度与凋亡率之间的关系图(图1),可以看出,采用离子胁迫诱导法时,离子胁迫诱导剂浓度为0.4 mol/L有较高的凋亡率,且CaCl2的诱导效果较NaCl好。
2.2 离子胁迫最适诱导时间
诱导1 h未出现凋亡小体,随着诱导时间的延长,凋亡细胞的数目逐渐增加,诱导5 h时明显出现凋亡小体,若继续延长处理时间,凋亡现象更加明显,但同时坏死细胞数量也大大增加,出现细胞膜破损、细胞核裂解、细胞内含物外泄等现象,不能保持细胞完整性。

表1 5种不同浓度离子处理8 h后的细胞凋亡形态学描述
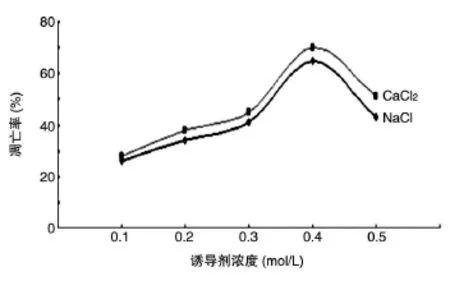
图1 诱导剂浓度与凋亡关系曲线
用不同时间梯度诱导洋葱鳞茎内表皮后,取样并制片,每种处理各选取3个视野,统计总细胞数和凋亡细胞数(以细胞核染色质出现明显的边缘化凝集为标志),计算凋亡率[凋亡率(%)=(凋亡细胞数/总细胞数)×100%]。以离子浓度为x轴、凋亡率为y轴,绘制诱导时间与凋亡率之间的关系图(图2),可以看出,采用离子胁迫诱导法时,诱导8 h左右有较高的凋亡率。
2.3 甲基绿-派诺宁染色法检测洋葱鳞茎内表皮细胞凋亡
对比图3A、B可知,经甲基绿-派诺宁染色后,凋亡细胞的细胞核染成红色,细胞质部分染成浅红色,细胞质壁分离现象明显,细胞质高度浓缩,细胞核内出现泡状结构,且某些细胞的细胞核消失,形成大量凋亡小体;死亡细胞经甲基绿-派诺宁染色后,其细胞核呈蓝色,细胞质无色。
2.4 甲基绿-派诺宁染色法检测大蒜根尖细胞凋亡
对比图4A、B可知,经甲基绿-派诺宁染色后,凋亡细胞的细胞核染成红色,细胞质部分染成红色,且出现明显的质壁分离,部分细胞核呈不规则状;死亡细胞经甲基绿-派诺宁染色后,细胞核呈蓝色,细胞质无色。
2.5 甲基绿-派诺宁染色法检测鸡血红细胞凋亡
对比图5A、B可知,经甲基绿-派诺宁染色后,凋亡细胞的细胞核染成蓝色,细胞质染成红色;坏死细胞经甲基绿-派诺宁染色后,细胞核呈红色。
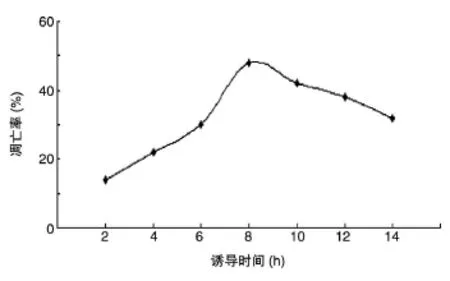
图2 诱导时间与凋亡率的关系曲线
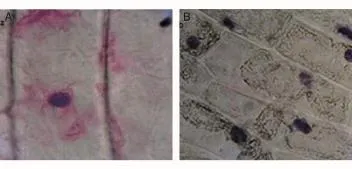
图3 Ca2+胁迫诱导洋葱鳞茎细胞的凋亡
3 讨论
3.1 影响本实验的因素
本实验采用3种不同实验材料进行细胞凋亡的检测,洋葱鳞茎内表皮细胞的结果最好,原因在于其细胞较大,且为单层细胞结构,因而容易观察。大蒜根尖细胞排列较紧密,且是多层排列,故不宜分散。鸡血红细胞易分散,但细胞较小,故难以观察,且容易凝集和破裂,难以对其做坏死处理。
凋亡现象的发生与诱导时间之间有着十分重要的关系。诱导2 h,染色现象并不明显,诱导8 h时染色明显。诱导剂的浓度也应适当,过高或过低都会对实验造成影响。诱导剂浓度过低,凋亡不明显;浓度过高,会使细胞继发性坏死。
染色时间对实验结果也有很大影响,染色时间短时现象不明显,染色时间过长也会对实验结果造成干扰。
3.2 Ca2+和Na+胁迫诱导细胞凋亡的可能机理
Ca2+和Na+等离子胁迫剂能刺激线粒体外膜上的受体,使线粒体膜通透性改变孔(mitochondrion permeability transition pore,PT孔)不可逆性开放,线粒体跨膜电位消失,通透性增高,从而导致细胞色素C、凋亡诱导因子等促凋亡物质的释放,最终导致细胞凋亡[8]。
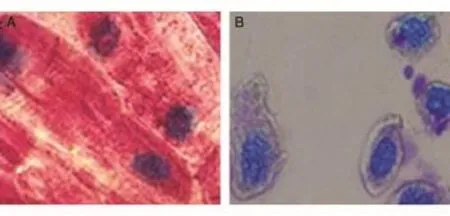
图4 Ca2+胁迫诱导大蒜根尖细胞的凋亡
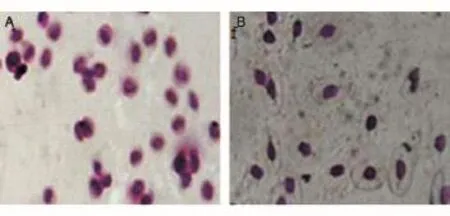
图5 Ca2+胁迫鸡血红细胞的凋亡
目前的研究表明,在许多细胞凋亡过程中,都伴随胞内自由Ca2+的大幅增加,特别是在凋亡早期,Ca2+往往表现出急剧增加,提示Ca2+可能是启动细胞凋亡的早期信号[9]。细胞内、外的一些凋亡因子,可能激活内质网、线粒体上的钙通道,使其中的Ca2+大量释放,并打开质膜上的钙通道,使胞外Ca2+内流,导致细胞质内Ca2+增加,进而诱导细胞凋亡[10]。而Ca2+依赖性的凋亡信号途径又可以被高盐(NaCl)所诱导。本实验中,CaCl2中的Ca2+可能通过细胞质膜上的钙通道进入细胞质,使细胞质内Ca2+浓度急剧增加,从而高效诱导细胞凋亡。并且,Ca2+还能激活相应的核酸内切酶及参与凋亡相关信号的转导等。因此,CaCl2对凋亡的诱导效率比单纯的盐胁迫剂NaCl略高。
3.3 甲基绿-派诺宁对凋亡细胞染色的机理
细胞凋亡和坏死均可表现为细胞核固缩等细胞死亡形态,但两者的发生机制不同。细胞凋亡是一种细胞主动死亡过程,需要细胞内蛋白酶的激活,细胞质内常有mRNA表达的增强。而坏死则是一种被动的细胞死亡过程,细胞质内常有RNA损失。根据这一特点,可利用试剂甲基绿对DNA染色的特异性和派诺宁对RNA的亲和性。甲基绿对染色质中的DNA选择性结合显示绿色或蓝色,派诺宁与核仁、细胞质中的RNA选择性结合显示红色。如果细胞质内核糖核酸呈派诺宁阳性染色(红紫色)者为凋亡细胞,呈阴性染色(蓝绿色)者为坏死细胞。
3.4 结语
我们采用离子胁迫诱导法测得诱导洋葱鳞茎细胞凋亡的最适离子浓度为0.4 mol/L,最佳诱导时间为8 h,最佳诱导剂为CaCl2。采用甲基绿-派诺宁染色法,可检测到洋葱鳞茎细胞、大蒜根尖细胞、鸡血红细胞的凋亡现象,其中洋葱鳞茎内表皮细胞凋亡现象最为明显。该方法实验现象明显,易于观察,操作简便,能为实验教学提供快捷、经济、准确的方案。同时,采用甲基绿-派诺宁法进行细胞凋亡的快速检测,对于肿瘤、宫颈糜烂等疾病的检测也有一定的临床应用价值。
[1]樊海燕.小麦胚乳细胞程序性死亡机理初探以及淹水胁迫对其进程的影响[D].武汉:华中农业大学,2010.
[2]宁顺斌,谭瑞,王玲.H2O2诱导玉米根尖细胞凋亡形态、生化及分子生物学证据[J].湖北民族学院学报(自然科学版),1999,17(3):1-7.
[3]张虹,梁婉琦,张大兵.花药绒毡层细胞程序性死亡研究进展[J].上海交通大学学报(农业科学版),2008,26(1):86-89.
[4]Li J Y, Jiang A L, Zhang W. Salt stress-induced pro⁃grammed cell death in rice root tip cells[J].Integer Plant Bi⁃ol,2007,49(4):481-486.
[5]李晓晴.盐胁迫诱导蚕豆保卫细胞和表皮细胞程序性死亡的信号调控机理研究[D].兰州:兰州大学,2006.
[6]宁顺斌,宋运淳,王玲,等.盐胁迫诱导的植物细胞凋亡-植物抗盐的可能机理[J].实验生物学报,2000,(03):245-253.
[7]苏金为,王湘平.镉诱导的茶树膜脂过氧化和细胞程序性死亡[J].植物生理与分子生物学报,2002,28(4):292-298.
[8]浦雪艳,高洪,段纲.线粒体与细胞凋亡[J].动物科学与动物医学,2003,20(8):37-59.
[9]Xu H,Heath M C.Role of calcium in signal transduction during the hypersensitive response caused by basidiospore-de⁃rived infection of the cowpea rust fungus[J].Plant Cell,1998(10):585-597.
[10]刘欣梅,项黎新,邵健忠,等.重金属诱导细胞凋亡的分子机制[J].细胞生物学杂志,2004,26(3):235-240.
