骨髓间充质干细胞对急性胰腺炎大鼠腹腔巨噬细胞活化的影响
2013-10-19孙学成余震吴明朱启槐
孙学成 余震 吴明 朱启槐
·短篇论著·
骨髓间充质干细胞对急性胰腺炎大鼠腹腔巨噬细胞活化的影响
孙学成 余震 吴明 朱启槐
巨噬细胞为主的多种免疫细胞共同参与重症急性胰腺炎(SAP)中炎症反应的级联样放大,构成了全身炎症反应综合征的免疫紊乱基础[1-2]。有研究报道,腹膜巨噬细胞、肺泡巨噬细胞和肝脏库弗细胞在实验性急性坏死性胰腺炎(ANP)的不同阶段被活化[3-4]。骨髓间充质干细胞(MSCs)是一种有多向分化能力的干细胞,具有向肠黏膜细胞分化的潜能,有可能作为肠黏膜损伤后的修复细胞[5]。但国内外实验研究结果均提示异体干细胞向肠黏膜迁移的数量极少,不足以有效修复受损的肠黏膜。本研究前期工作中发现腹腔内给予MSCs同样可以减轻肠黏膜损伤。本研究进一步探讨MSCs保护ANP时肠黏膜损伤的机制。
一、材料与方法
1.MSCs分离、培养及鉴定:成年健康清洁级SD大鼠(Sino-British SIPPR/BK),鼠龄8~10周,体重200~250 g,购于第二军医大学动物实验中心。取1只大鼠,皮肤消毒后分离大鼠双侧股骨,用10%胎牛血清冲洗髓腔后,以800 r/min离心5 min,弃上清,按5×105/cm2的密度接种于含10%胎牛血清的DMEM+F12培养基中培养24 h,待细胞80%融合时传代3次,胰酶消化,收获细胞 (图1)。采用流式细胞仪检测MSCs表面抗原CD29、CD44、CD45进行鉴定。
2.动物模型制备及分组:取24只雌性大鼠,按数字表法随机分成对照组、ANP组和MSCs组。采用逆行胰胆管注射3%牛磺胆酸钠(Sigma公司)的方法制备ANP模型。MSCs组于ANP成模后12 h尾静脉注射MSCs 5×106个/只,连续3 d;ANP组尾静脉注射等容积生理盐水;对照组仅腹腔注射等容积生理盐水。术后72 h用乙醚吸入麻醉大鼠,下腹部皮肤消毒后腹腔注射无血清DMEM培养液10 ml,轻柔大鼠腹部2~3 min,静置5~7 min,用注射器吸取腹腔灌洗液。然后处死大鼠,取回肠组织。
3.大鼠腹腔巨噬细胞(PMs)分离、培养:取对照组大鼠的腹腔灌洗液,1000 r/min离心5 min,弃上清,用PBS洗涤2遍,再用含10%胎牛血清的DMEM的培养液调节细胞密度至1×106/ml接种于培养瓶,常规培养12 h,用无血清DMEM培养液漂洗2遍后加含10%胎牛血清的RPMI-1640的培养液继续培养,行台盼蓝和瑞氏染色进行鉴定(图2)。收获的大鼠PMs以l×106/ml的细胞密度接种于6孔培养板,待细胞贴壁后更换新培养基,分为常规培养液组(对照组)、常规培养液+ANP大鼠腹腔灌洗液组(灌洗液组)、常规培养液+ANP大鼠腹腔灌洗液+MSCs组(MSCs组),加ANP大鼠腹腔灌洗液培养1 h后再加1×106/ml的MSCs)。常规培养18 h后收集培养上清液。
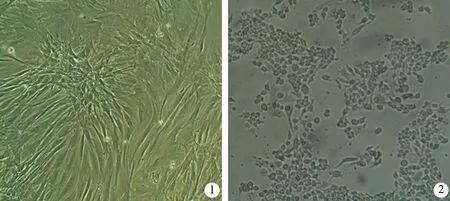
图1 MSCs细胞(×400) 图2 腹腔巨噬细胞(×400)
4.腹腔灌洗液和PMs培养上清液中TNFα、IL-1β和MIP-1α浓度测定:大鼠TNFα、IL-1β和 MIP-1α采用ELISA法检测,试剂盒均购自R&D公司,按说明书操作。
5.回肠组织病理学检查:取术后72 h各组大鼠回肠组织快速冷冻切片、丙酮固定、HE染色,由病理科医师按照Chiru标准行病理学评分。Chiru评分标准:正常小肠黏膜绒毛为0级;上皮下腔隙扩大、血管充血为1级;上皮下腔隙扩大明显、上皮与固有层分离为2级;上皮剥脱为3级;上皮剥脱显著为4级;固有层分解、出血、溃疡为5级。
6.回肠组织TNF-α、IL-1β mRNA表达检测:用Trizol抽提组织总RNA。采用RT-PCR法检测TNF-α、IL-1β mRNA。IL-1β引物上游AGGCTTCCTTGTGCAAGTGT,下游TGAGTGACACTGCCTTCCTG,产物230 bp;TNF-α引物上游ACTCCCAGAAAAGCAAGCAA,下游CGAGCAGGAATGAGAAGA-GG,产物211 bp;内参β-actin引物上游CCTGTACGCCAACACAGTGC,下游ATACTCCTGCTTGCTGATCC,产物211 bp。引物均由上海英俊生物公司合成。PCR反应条件:94℃ 2 min,94℃ 40 s、58℃(IL-1β)或60℃(TNF-α及β-actinin)40 s、72℃ 1 min,35个循环,最后72℃延伸5 min。
二、结果
1.大鼠腹腔灌洗液TNF-α、IL-1β和MIP-1α浓度的变化:对照组、ANP组、MSCs组腹腔灌洗液TNF-α浓度分别为(47.08±5.47)、(173.95±13.13)、(117.15±10.36)pg/ml;IL-1β浓度分别为(35.45±7.98)、(162.08±11.29)、(103.61±10.66)pg/ml;MIP-1α浓度分别为(4.83±0.48)、(57.01±5.16)、(20.02±3.04)pg/ml。ANP组均较对照组明显升高(F值分别为4.59,1.38,8.83,P值均<0.05),MSCs组较ANP组明显下降(F值分别为39.9,65.7,40.2,P值均<0.05),但仍明显高于对照组(F值分别为182.2,109.9,94.4,P值均<0.05)。
2.巨噬细胞培养上清液TNF-α、IL-1β和MIP-1α浓度的变化:对照组、灌洗液组、MSCs组的PMs培养上清中TNF-α浓度分别为(53.85±6.35)、(152.48±16.4)、(108.54±10.91)pg/ml;IL-1β浓度分别为(41.74±7.01)、(145.51±14.46)、(94.39±8.76)pg/ml;MIP-1α浓度分别为(5.53±0.80)、(49.36±6.63)、(16.91±2.84)pg/ml。灌洗液组较对照组明显升高(F值分别为154.2,178.4,222.5,P值均<0.05);MSCs组较灌洗液组明显减少(F值分别为94.4,110.1,70.4,P值均<0.05)。
3.回肠组织病理改变:对照组大鼠肠道黏膜仅有轻度水肿及少量炎性细胞。ANP组可见肠黏膜绒毛上皮细胞脱落、毛细血管塌陷及大量的中性粒细胞浸润。MSCs组肠道组织损伤较ANP组减轻。3组病理评分为(3.88±0.22 )、(2.62±0.47)及(0.63±0.46)分,两两比较,差异均具有统计学意义(F值分别为5.7,49.1,27.6,P值均<0.05)。
4.大鼠回肠组织TNF-α、IL-1β mRNA表达水平的变化:ANP组和MSCs组回肠组织中TNF-α mRNA和IL-1β mRNA的相对表达量均较对照组明显增强(3.53±0.69、1.87±0.38对0.49±0.12;4.71±1.09、2.24±0.25对1.10±0.21;F值分别为109.4,97.5,P值均<0.05);MSCs组中二者的相对表达量较ANP组明显下降,差异有统计学意义(F值分别为11.9,87.0,P值均<0.05)。
讨论巨噬细胞处于天然免疫系统的最前线,具有良好的可塑性[6]。参与ANP时炎症反应的巨噬细胞包括肺泡巨噬细胞、库否细胞和腹腔巨噬细胞等,这些细胞过度活化使胰腺炎症放大,进而引起多器官功能衰竭。Lundberg等[7]和Jaffray等[8]分别将受损胰腺释放物、胰酶(如胰蛋白酶、弹性蛋白酶脂肪酶等)与巨噬细胞共培养,结果发现以上物质可以通过巨噬细胞上的膜结合受体促进IκB降解,激活NF-κB途径介导巨噬细胞活化,分泌促炎细胞因子。本研究结果显示,ANP大鼠腹腔灌洗液中TNP-α、IL-1β水平明显升高,作为促炎症细胞聚集的重要趋化因子MIP-1α的水平也明显升高,在体外用ANP大鼠腹腔灌洗上清液可以诱导PMs过度活化并分泌大量的促炎细胞因子,加重肠道病理损伤,且回肠内TNF-α、IL-1β mRNA的表达明显增强,表明过度活化的腹腔巨噬细胞是决定炎症轻重的核心细胞,并参与肠黏膜损伤。
MSCs可通过不同机制对多个脏器如心肌、神经和肾脏损伤具有修复作用[9-10],但外源性干细胞的数量相对机体细胞量来说极少,而能迁移至受损脏器的干细胞数量更少,不足以弥补受损的细胞。文献报道[11-12],MSCs可以通过旁分泌的方式而发挥一系列的生理学作用如抗炎、抗凋亡及促进血管形成等。本研究结果显示,无论是静脉给予还是腹腔给予MSCs均能减轻ANP后大鼠的细胞因子水平,减轻肠道黏膜的损伤。下调回肠黏膜TNF-α mRNA和IL-1β mRNA的表达,提示异体MSCs对ANP时肠黏膜损伤具有保护作用。
MSCs可抑制多种免疫细胞(如T淋巴细胞、自然杀伤细胞、B淋巴细胞及树突状细胞)的活化、增殖和发育[13-15]。本研究采用加入ANP大鼠的腹腔灌洗液及异体MSCs的培养液培养PMs,结果细胞培养上清液中促炎细胞因子的含量减少,提示MSCs是通过抑制活化的PMs分泌促炎细胞因子,从而减轻肠黏膜损伤的。
[1] Gea-Sorli S, Guillamat R,Closa D, et al. Activation of lung macrophage subpopulations in experimental acute pancreatitis. J Pathol,2011, 223: 417-424.
[2] Gea-Sorli S, Closa D.Role of macrophage in the progression of acute pancreatitis.World J Gastrointest Pharmacol Ther, 2002, 132: 86-92.
[3] Satoh A, Shimosegawa T,Kimura K, et al. Nitric oxide is overproduced by peritoneal macrophages in rat taurocholate pancreatitis: the mechanism of inducible nitric oxide synthase expression. Pancreas, 1998, 17: 402-411.
[4] Murr MM, Yang J,Fier A, et al. Pancreatic elastase induces liver injury by activating cytokine production within Kupffer cells via nuclear factor-Kappa B. J Gastrointest Surg, 2002,6: 474-480.
[5] Sala FG, Matthews JA, Speer AL,et al. A multicellular approach forms a significant amount of tissue-engineered small intestine in the mouse.Tissue Eng Part A, 2011, 17: 1841-1850.
[6] Mosser DM, Edwards JP. Exploring the full spectrum of macrophage activation. Nat Rev Immunol, 2008, 8: 958-969.
[7] Lundberg AH, Eubanks JW 3rd,Henry J, et al. Trypsin stimulates production of cytokines from peritoneal macrophages in vitro and in vivo. Pancreas, 2000, 21: 41-51.
[8] Jaffray C, Mendez C, Denham W, et al. Specific pancreatic enzymes activate macrophages to produce tumor necrosis factor-alpha: role of nuclear factor kappa B and inhibitory kappa B proteins. J Gastrointest Surg, 2000, 4: 370-377.
[9] Lee PH, Lee JE, Kim HS, et al. A randomized trial of mesenchymal stem cells in multiple system atrophy.Ann Neurol, 2012, 72:32-40.
[10] De Martino M, Zonta S, Rampino T, et al. Mesenchymal stem cells infusion prevents acute cellular rejection in rat kidney transplantation. Transplant Proc, 2010, 42:1331-1335.
[11] Newman RE, Yoo D, LeRoux MA, et aI. Treatment of inflammatory diseases with mesenchymaI stem cells. lnflamm Allergy Drug Targets, 2009, 8:110-123.
[12] Togel F, Hu Z, Weiss K, et al.Administered mesenchymal stem cells protect against ischem ic acute renaI faiIure through diferentiation-independent mechanisms.Am J Physiol Renal Physiol, 2005,289:F31-F42.
[13] Glennie S,Soeim I,Dyson PJ,et al.Bone marrow mesenchymal stem cells induce division arrest anergy of activated T cells.Blood,2005,105:2821-2827.
[14] Gao K,Chen Y,Wei L,et al.Inhibitory effect of mesenchymal stem cells OH lymphocyte proliferation.Cell Biochem Funct,2008,26:900-907.
[15] Sotimpoulou PA,Perez SA,Gritzapis AD,et al.Interactions between human mesenchymal stem cells and natural killer cells.Stem Cells,2006,24:74-85.
2012-02-25)
(本文编辑:屠振兴)
10.3760/cma.j.issn.1674-1935.2013.03.018
黎介寿院士肠道屏障研究专项基金(LJS-2009015)
325000 温州,温州医学院附属第一医院消化科(孙学成、吴明、朱启槐),普外科(余震)
余震,Email:Yuzhen0577@yahoo.com.cn
