丁香酚对小麦-蚕豆间作土壤微生物数量及多样性的影响
2013-10-17刘辉娟黄高宝周海燕
刘辉娟,柴 强,黄高宝,周海燕,朱 静
(甘肃省干旱生境作物学重点实验室 甘肃农业大学农学院,甘肃 兰州730070)
土壤微生物是土壤有机质和养分转化、循环的动力,它们参与土壤有机质分解、腐殖质形成、土壤养分转化和循环等过程[1-2]。土壤微生物除了受季节的影响之外,主要受种植作物种类的影响,作物主要通过根系影响土壤微生物[3-4]。根系影响着根际土壤微生物数量、种类和各种微生物的结构比例,直接或者间接通过微生物影响土壤中的养分转化[5]。根系分泌物存在的根际土壤被称为“沙漠中的绿洲”,这是因为植物根系周围的土壤由于受到根系活动及其分泌物的影响,其化学、物理、生物学性质不同于原土体[6]。对于经植物根系分泌物的化感物质改良后的土壤,其土壤中无机离子的状态也发生变化,现已经证明,无机离子的变化是由于外源有机质、分泌物中的养分或由于分泌物中不稳定碳引起的微生物将养分固定的结果[7]。由此可见,根系分泌物是影响土壤微生态环境的主要因素之一。
酚类物质是植物次生代谢物质中最丰富的一类[8-9],多具有显著的化感作用[10],根系分泌和秸秆腐解是这类物质的主要来源[11-12],酚酸类物质对土壤微生物可产生显著影响[13]。在复合群体中,作物之间通过化感物质产生互作效应的现象普遍存在,研究化感效应对构建高效复合群体具有重要的指导意义。间套作作为主体的多熟种植是中国耕作制度的核心和特色[14],大量研究证明,间作套种具有提高养分利用率的作用。本研究以单作小麦(Triticumaestivum)、单作蚕豆(Viciasativa)和小麦间作蚕豆为研究对象,以前期研究中[15]分离鉴定的小麦根系分泌物丁香酚为参试化感物质,对根际土壤微生物的变化进行研究,以探讨优势种形成的机理。
1 材料与方法
1.1 试验地点及材料 试验于2010年3-7月在甘肃农业大学农业生态工程研究所网室中进行。光照和温度与外界相同。
供试土壤:采自甘肃农业大学试验田,为黄河灌淤土,田间最大持水量为24.4%,全氮含量1.766g·kg-1,全磷0.732g·kg-1,有效磷29.18mg·kg-1,pH值为8.24;施肥量为纯氮200mg·kg-1,P2O5为200mg·kg-1。
供试作物:春小麦品种为永良4号,由甘肃省农业科学院提供;春蚕豆品种为临蚕5号,由临夏州农业科学研究所提供。
播种管理:供试土壤风干后过2mm筛,播前将土壤与肥料混合均匀,每盆装土14kg,浇水至田间持水量的60%,表土稍干后播种。小麦、蚕豆种子在播种前用10%H2O2消毒10min。单作小麦每盆留主茎苗40株,单作蚕豆每盆保苗8株,间作时密度减半。在3月18日播种小麦,3月28日播种蚕豆。作物生长期间按田间持水量的75%进行控水,采用称重法控水。3月到4月底蒸发量小,隔1 d称1次,后期蒸发量增大,每天称重,并定期调换盆的位置。
1.2 试验设计
1.2.1 丁香酚处理 试验设种植模式和丁香酚处理两种因素,种植模式为单作小麦(W)、单作蚕豆(B)、小麦间作蚕豆(WB);丁香酚处理为3×10-4mol·kg-1土(A)和不处理两个水平。共组成 W、AW、B、AB、WB、AWB 6个处理,每处理重复3次。在4月21日进行丁香酚处理,丁香酚采用天津化工厂生产的分析纯物质。处理时按照每盆0.616mL的剂量取原液,溶于3mL酒精中,稀释成1 000mL浇灌设定处理,对照组取3mL酒精稀释到1 000 mL浇灌。
1.2.2 土样采集与微生物培养 在4月28日(小麦拔节期、蚕豆分枝期)、5月14日(小麦孕穗期、蚕豆开花期)、5月28日(小麦灌浆期、蚕豆鼓粒期)进行采样。采集土样时,每次每处理取3盆。取样时先去掉0~2cm的表土,轻轻挖出植株,抖掉根系外围土,再用毛刷轻刷粘附在根际表面的土壤作为根际土,用无菌自封袋密封,置于冰盒内带回实验室进行微生物数量的测定。
土壤微生物数量采用梯度稀释平板涂布法测定,细菌计数用牛肉膏蛋白胨培养基、真菌用马丁氏培养基、放线菌用改良的高氏一号培养基[16],结果以每克干土所含数量表示。
1.2.3 测定指标及方法 微生物多样性指数(DI)采用Shannon-Wiener指数法[17]计算,公式为:
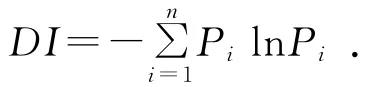
式中,Pi为群落中第i个物种个体数占总个体数的百分比。
化感效应(RI)采用 Willimson法[13]计算:
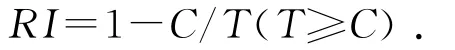
式中,C为对照值,T为处理值,当0<RI<1时,化感物质具有促进作用,当-1<RI<0时,化感物质具有抑制作用,当RI=0时,表示无化感效应,RI绝对值大小代表化感作用的强度。
1.2.4 数据分析 试验数据用SPSS 16.0进行裂区试验设计统计分析。
2 结果与分析
2.1 微生物数量 在小麦孕穗期(5月14日)和灌浆期(5月28日),丁香酚处理和种植模式对土壤真菌、放线菌数量的影响显著,且存在互作;两个因素对细菌数量的影响在小麦拔节期和孕穗期达到显著水平,同样存在互作(表1)。
无丁香酚处理下单作小麦根际土壤真菌、放线菌、细菌和微生物总数在3个生育时期总体呈增大趋势;丁香酚处理下,单作小麦土壤真菌数量呈先减小后增大趋势,放线菌、细菌和微生物总数总体呈减小趋势。在4月28日,AW较W真菌和微生物总数减少了31.60%和12.95%,放线菌和细菌增加了52.52%和27.67%;在5月14日和28日,W较AW四项指标明显增加(表1)。可见,丁香酚对小麦根际微生物影响较大。
B处理根际土壤四项指标随生育期的进程其数量变化趋势为先增大后减小;AB处理下放线菌和真菌呈逐渐减小趋势,而细菌和微生物总数先减小后增大。在4月28日,B较AB真菌和放线菌增加了411%和51.79%,而细菌和总数减小了88.54%和86.73%;5月14日,B较AB四项指标增加了222.95%、77.25%、62.87%和63.23%;在5月28日,B较AB真菌和放线菌增加了28.12%和332.06%,而细菌和微生物总数减小了26.04%和24.20%(表1)。
WB中除土壤真菌数量呈先增加后减少趋势之外,其余均呈逐渐增大趋势,并且增加程度较大;AWB中真菌、细菌和微生物总数呈先减小后增大的趋势,放线菌则呈逐渐增大趋势。在4月28日,WB较AWB真菌和放线菌增加了166.67%和15.38%,而细菌和总数减小了68.85%和68.50%;在5月14日WB较AWB四项指标分别平均增加了 6 223.18%、116.13%、1 461.39% 和1 245.61%;5月28日分别增加了129.13%、38.91%、91.17%和89.02%(表1)。
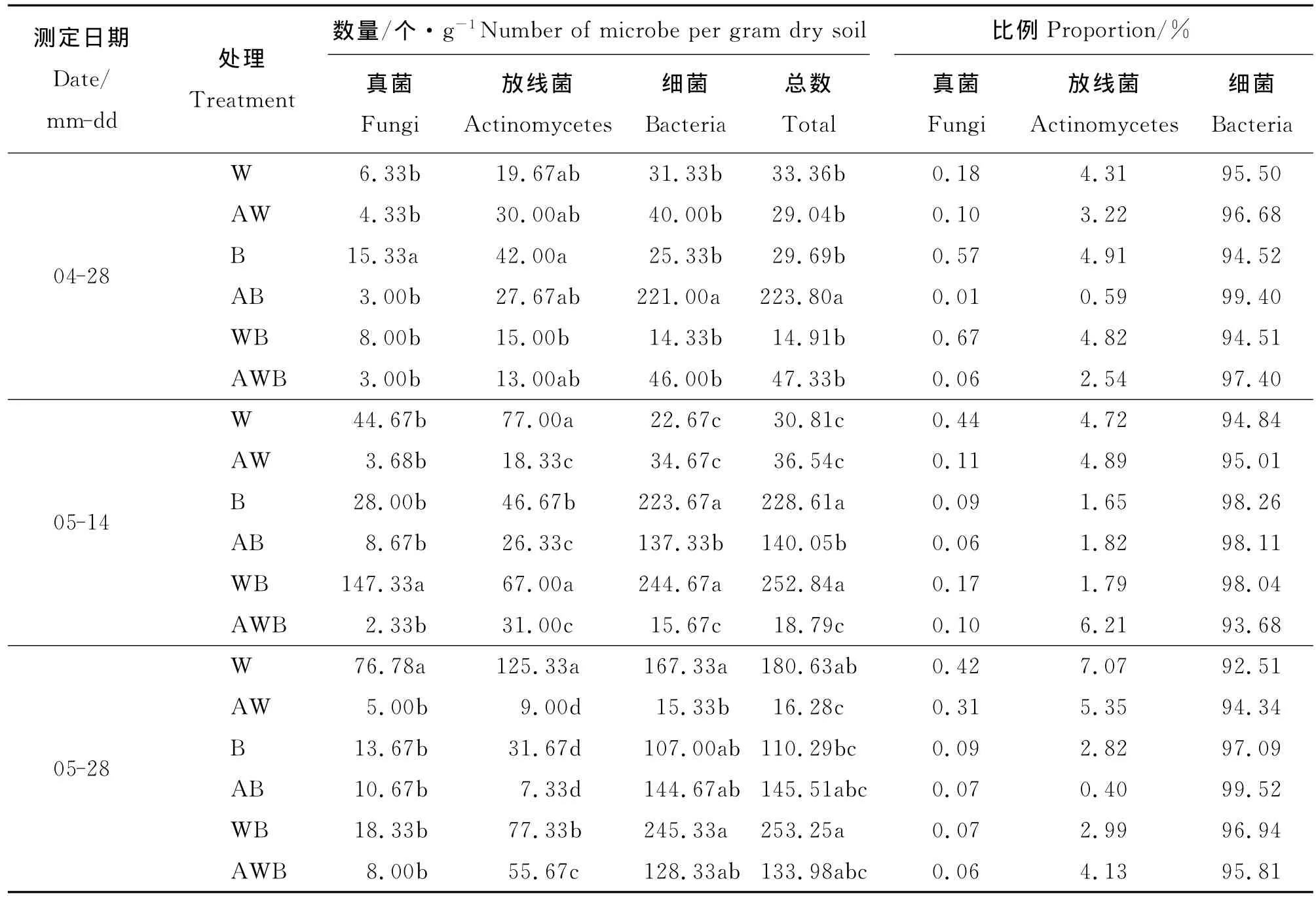
表1 丁香酚及间作对土壤微生物数量及种群结构的影响Table 1 Effects of cropping systems and eugenol on soil microbe number and population
2.2 化感效应 在3个生育时期内,丁香酚对土壤真菌和放线菌数量总体上表现为化感抑制作用(表2)。在5月14日,丁香酚对土壤细菌数量表现为化感促进作用。在5月28日,单作小麦和间作土壤细菌数量受丁香酚的影响表现为化感抑制作用,单作蚕豆表现为化感促进作用。产生这种现象的原因可能是,在作物生长盛期,土壤微生物数量主要受外源丁香酚的影响,小麦在生长过程中不断分泌化感物质丁香酚,从而使土壤中化感物质的浓度超过了对细菌的界限浓度,表现为抑制作用。单作蚕豆与单作小麦不同的是,单作蚕豆在生长过程中不存在丁香酚浓度的累积,而小麦间作蚕豆中小麦数量相对比较少,故产生的累积量较小。
2.3 不同处理对土壤微生物种群结构的影响 在3个不同生育时期中,细菌数量占土壤微生物总数的92%以上,其次是放线菌,真菌数量最少(表1)。无丁香酚作用下,以同一生育期的单作小麦和单作蚕豆土壤微生物所占比例之和的一半作对照,比较间作对土壤微生物种群结构的影响,结果表明,在3个生育时期,单作土壤真菌、放线菌和细菌数量的比例相对于间作的增减量分别为-44.03%~0.53%、-1.52%~77.93%和-2.21%~264.29%。
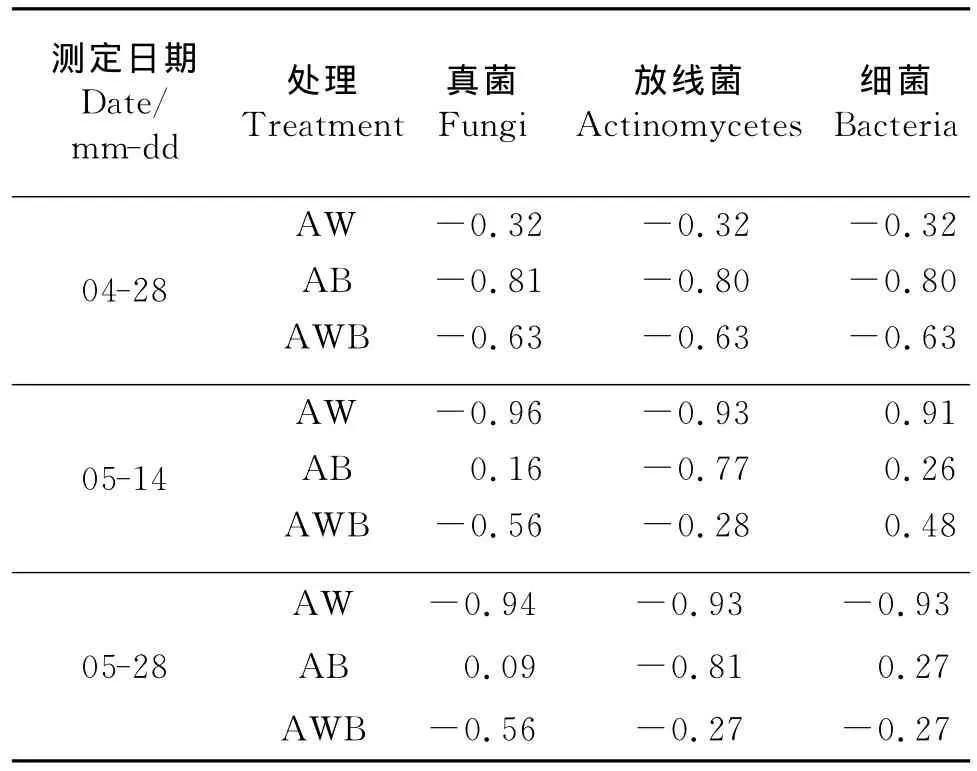
表2 丁香酚对土壤微生物数量的化感效应Table 2 Allelopathic effects of eugenol on soil microbial number under different treatments
经丁香酚处理的单作小麦、单作蚕豆和间作土壤根际真菌所占比例明显小于未处理的小麦、蚕豆和间作,例如AW较W根际真菌在3个生育时期减小了44.44%、75%和26.19%,说明丁香酚对土壤真菌产生的化感作用比较明显;丁香酚对细菌的影响与对真菌的基本相反,经过处理的单作小麦和单作蚕豆明显高于未处理的,在3个生育时期的增减量分别为1.24%、1.78%、1.98%和5.16%、-0.15%、2.50%,这一结果说明丁香酚对土壤细菌和真菌产生化感作用的界限浓度存在较大的差异。在5月14日丁香酚处理的单作小麦、单作蚕豆和间作土壤根际放线菌所占比例大于未处理小麦、蚕豆和间作,而在小麦拔节期和灌浆期,土壤根际放线菌所占比例与孕穗期基本相反(灌浆期间作除外),这说明土壤根际放线菌受丁香酚和种植模式交互作用的影响(表1)。
2.4 微生物多样性指数 微生物多样性呈先增大后减小的趋势,土壤微生物多样性DI在5月14日明显增大,单作和间作DI的大小关系为单作小麦>小麦间作蚕豆>单作蚕豆,在5月28日,单作小麦>单作蚕豆>小麦间作蚕豆,与小麦孕穗期比较,单作小麦、单作蚕豆和小麦间作蚕豆在灌浆期DI分别减小53.97%、66.67%和69.57%(表3)。丁香酚明显降低了土壤微生物的多样性,它对土壤微生物DI的影响规律是单作小麦>小麦间作蚕豆>单作蚕豆,较无丁香酚处理在3个生育时期使单作小麦、单作蚕豆、小麦间作蚕豆分别增减了28.57%、-36.36%、-12.5%、-44.44%、77.78%、-6.52%、-17.24%、-73.33%、57.14%,以上结果说明,间作在保持微生物多样性方面不存在优势。
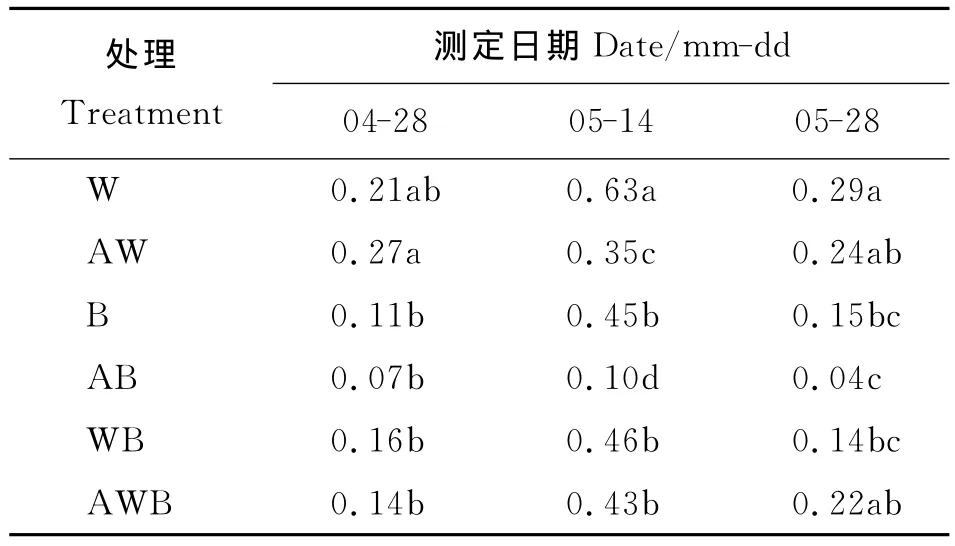
表3 不同处理对土壤微生物多样性(DI)的影响Table 3 Effects of soil microbial diversity(DI)under different treatment
3 讨论与结论
不同土地利用方式对土壤微生物数量及多样性具有显著影响[18-19]。本研究中,单作小麦根际土壤真菌、放线菌、细菌和微生物总数在3个生育时期总体呈增大的趋势;单作蚕豆土壤四项指标的数量变化呈先增大后减小的趋势;小麦间作蚕豆除土壤真菌数量呈逐渐减小之外,其余呈总体增大的趋势,单作与间作之间差异显著。有研究表明,玉米(Zea mays)/花生(Arachishypogaea)间作系统作物根区土壤的真菌、细菌、放线菌数量都比相应单作作物多[20-21]。但在本研究中,间作较单作土壤真菌、放线菌、细菌数量增减在3个生育时期不一致;而宋亚娜等[22]的研究表明,小麦与蚕豆间作能改变两种作物根际细菌和真菌群落结构。丁香酚对土壤真菌和放线菌数量均表现为显著的抑制作用,且在拔节期对根际土壤放线菌存在种植模式与化感效应的交互作用。
植物种的丰度和植物功能多样性对细菌活动的多样性和代谢多样性有呈正向影响,土壤细菌和代谢多样性随植物种数量的对数和植物功能组的数量呈线性上升[23]。不同处理对土壤微生物组成的影响来看,细菌是土壤微生物的主要类群,其次为放线菌数量,真菌数量最少,这与王月容等[24]的研究略有不同。与未用丁香酚处理对比,丁香酚对真菌和放线菌在微生物总数中所占的比例有降低作用,而且对放线菌数量所占的比重影响较大,这一结果说明,丁香酚对放线菌产生化感作用的范围界限比较小。丁香酚同时也降低了土壤微生物的多样性,可见,间作在保持生物多样性方面并不存在优势,这与柴强等[25]的研究结果一致。
酚类是土壤污染物质,许多微生物参与此类物质的生物降解反应[26],但产生作用的只是部分功能菌,因此,深入探讨化感物质在单作和间作群体中的作用机理以及微生物种群结构间的关系,将对构建通过化感作用途径调控复合群体的理论和技术产生积极的推动作用。
[1] Zelles L.Fatty acid patterns of phospholipids and lipopolysaccharides in the characterisation of microbial communities in soil:A review[J].Biology and Fertility of Soils,1999,29:111-129.
[2] 魏兰芳,董艳,汤利,等.小麦蚕豆间作条件下不同施氮量对作物根际微生物数量的影响[J].云南大学学报,2008,23(5):368-374.
[3] Picard C,Baruffa E,Bosco M.Enrichment and diversity of plant-probiotic microorganisms in the rhizosphere of hybrid maize during four growth cycles[J].Soil Biology and Biochemistry,2008,40:106-115.
[4] 林雁冰,薛泉宏,刘海斌,等.旱地不同栽培模式及施氮量对小麦根区土壤微生物区系的影响[J].西北农业学报,2005,14(2):38-43.
[5] 周陈,李许滨,杨明开,等.冬小麦不同生育期土壤微生物及养分动态变化[J].西北农业学报,2008,17(3):113-116.
[6] 王树起,韩晓增,乔云发.根系分泌物的化感作用及其对土壤微生物的影响[J].土壤通报,2007,38(6):1219-1226.
[7] 林雁冰,薛泉宏,颜霞.覆膜条件下小麦和玉米根系化感作用对土壤微生物的影响[J].西北农业学报,2010,19(1):92-95.
[8] Wu H W,Haig T,Pratley J,etal.Allelochemicals in wheat(TriticumaestivumL.):Variation of phenolic acids in shoot tissues[J].Journal of Chemical Ecology,2001,27:125-135.
[9] Swain T,Harborne J B,Sumere C F.Biochenmistry of Plant Phenolics[M].New York:Plenum Press,1979.
[10] Inderjit.Plant phenolics in allelopathy[J].Botanical Review,1996,62:186-202.
[11] 马瑞霞,刘秀芬,袁光林,等.小麦根区微生物分解小麦残体产生的化感物质及其生物活性的研究[J].生态学报,1996,16(6):632-639.
[12] 孔垂华.植物化感作用研究中应注意的问题[J].应用生态学报,1998,9(3):332-336.
[13] Williamson G B,Richardson D.Bioassays for allelopathy:measuring treatment responses with independent controls [J].Journal of Chemical Ecology,1988,14(1):181-187.
[14] 胡恒觉,黄高宝.新型多熟种植[M].兰州:甘肃科学技术出版社,1999:1-3.
[15] 张辉,黄鹏,柴强,等.不同供水条件下小麦根系分泌物及典型化感物质的生物学效应[J].甘肃农业大学学报,2010,45(1):52-57.
[16] 中国科学院南京土壤研究所微生物室.土壤微生物研究法[M].北京:科学出版社,1985.
[17] Magurran A E.Ecological Diversity and Its Measurement[M].New Jersey:Princeton University Press,1988.
[18] 陈锡时,郭树凡,汪景宽,等.地膜覆盖栽培对土壤微生物种群和生物活性的影响[J].应用生态学报,1998,9(4):435-439.
[19] 孙秀山,封海胜,万书波,等.连作花生田主要微生物类群与土壤酶活性变化及其交互作用[J].作物学报,2001,27(5):617-621.
[20] 章家恩,高爱霞,徐华勤,等.玉米/花生间作对土壤微生物和土壤养分状况的影响[J].应用生态学报,2009,20(7):1597-1602.
[21] 董艳,汤利,郑毅,等.小麦-蚕豆间作条件下氮肥施用量对根际微生物区系的影响[J].应用生态学报,2008,19(7):1559-1566.
[22] 宋亚娜,Petra M,张福锁,等.小麦/蚕豆,玉米/蚕豆和小麦/玉米间作对根际细菌群落结构的影响[J].生态学报,2006,26(7):2268-2274.
[23] 肖辉林,郑习健.植物多样性对土壤微生物的影响[J].土壤与环境,2001,10(3):238-241.
[24] 王月容,周金星,周志翔,等.洞庭湖退田还湖区不同土地利用方式下土壤微生物数量与酶活性特征[J].生态学杂志,2010,29(5):910-916.
[25] 柴强,黄高宝,黄鹏,等.间甲酚及施磷对小麦间作蚕豆土壤微生物和酶活性的影响[J].生态学报,2006,26(2):383-390.
[26] Yang Y H,Yao J,Hu S,etal.Effects of agricultural chemicals on DNA sequence diversity of soil microbial community:A study with RAPD marker[J].Microbial Ecology,2000,39:72-79.
