替米考星β-CDP载药微球的制备及释药性能研究
2013-10-15杨黎燕余丽丽
杨黎燕,余丽丽,姚 琳,尤 静
(西安医学院药学院,陕西 西安710021)
替米考星(Tilmicosin)是一种以泰乐菌素为前体半合成的畜禽专用抗生素,在兽医临床上具有广阔的应用前景,但水溶性差,导致药物在动物体内的吸收及生物利用度低,用药成本较高,容易造成药物残留、过敏反应等,并诱发耐药菌株的产生,很大程度上限制了其在兽医临床上的推广应用[1]。
β-环糊精(β-CD)经高分子化后既保持了环糊精原有的空腔结构及缓控释、催化和识别能力,又具有三维空间网络结构,增强了空穴的疏水性,促进了包合作用的进行[2-4]。随着高分子科学的发展,对β-环糊精聚合物(β-CDP)的研究及应用已成为关注热点[5,6]。
作者采用共沉淀法制备替米考星β-CDP载药微球,以期为研制具有缓释性能、应用更安全更广泛的兽用替米考星β-CDP载药微球提供理论基础。
1 实验
1.1 试剂与仪器
β-CDP,自制;替米考星(批号2007 060 015,湖北武穴龙翔药业有限公司);磷酸、无水乙醇等均为分析纯,实验用水为蒸馏水。
PHS-25型pH计,上海济成仪器有限公司;DZF型真空干燥箱,北京科伟永兴仪器有限公司;JJ-1型电动搅拌器,金坛华峰仪器有限公司;85-I型恒温磁力搅拌器,常州国华电器有限公司;JSM6460型钨灯丝扫描电子显微镜,日本电子公司;TDL-40B型离心机,上海安亭科学仪器厂;SKC-2000型激光粒度分析仪,日本SEISHIN公司;UV-265型紫外可见分光光度仪、UV-265FW型傅立叶红外光谱仪,日本岛津公司。
1.2 方法
1.2.1 空白β-CDP微球的制备[7]
向三口瓶中加入10mL质量浓度为40%的氢氧化钠溶液和6gβ-CD,使其完全溶解。在30℃、恒速搅拌(500r·min-1)条件下,缓慢滴加7.34g环氧氯丙烷(ECH),交联反应1.5h。加入0.8g含有乳化剂(Span80∶Tween20=3∶1)的煤油,升温至一定温度,合成微球。依次用稀盐酸、乙醇、蒸馏水、丙酮充分洗涤,除去各种杂质,于60℃真空干燥箱干燥至恒重,得空白β-CDP微球。
1.2.2 替米考星β-CDP载药微球的制备
称取2.5g替米考星溶解于1000mL 100mg·L-1的磷酸水溶液中配成标准溶液,取该溶液100mL放入250mL的烧杯中,然后加入定量空白β-CDP微球,恒温磁力搅拌(400r·min-1)一定时间,反应结束后静置冷却至室温,并在冰箱中冷藏24h,过滤,充分洗涤,抽滤,于50℃真空干燥至恒重,得替米考星β-CDP载药微球。
1.2.3 替米考星β-CDP载药微球的体外释药性能测试
精密称取替米考星β-CDP载药微球适量,转入已处理好的长度约10cm的透析袋中,两端系紧,分别置于200mL pH 值为7.4和1.2的溶液中,在(37±0.5)℃、50r·min-1下进行溶出,分别于不同时间点取样5mL,同时补充等量同温度的溶液,定容,于最大吸收波长293nm处用紫外可见分光光度仪测定吸光度,计算累积释药率,绘制累积释药曲线。
1.2.4 替米考星β-CDP载药微球的质量评价
取0.5g替米考星β-CDP载药微球和10mL 10g·L-1的α-淀粉酶加入100mL蒸馏水中。在60℃下充分降解,然后取滤液稀释到一定浓度范围,用紫外可见分光光度仪检测其浓度。替米考星包封率(Y1)和产率(Y2)按下式计算:

以包封率(Y1)和产率(Y2)为评价指标,综合考虑指标的优劣及重要程度,计算综合评分(Y),回归线性方程为:Y=0.162Y1+0.211Y2-8.204。综合评分越高,表明替米考星β-CDP载药微球的质量越好。
1.2.5 替米考星β-CDP载药微球的形态和粒径分析
取一定量的替米考星β-CDP载药微球真空冷冻干燥后喷金制样,用扫描电子显微镜观察其表观形貌;向激光粒度分析仪样品槽中加入一定量的替米考星β-CDP载药微球至遮光率约15%,检测其粒径分布;测定β-CD、β-CDP微球、替米考星β-CDP载药微球的红外光谱。
2 结果与讨论
2.1 替米考星β-CDP载药微球制备工艺的优化
2.1.1 投料比
取100mL 2.5g·L-1的替米考星溶液,在搅拌速度为400r·min-1、反应温度为60℃、反应时间为1.5h的条件下制备替米考星β-CDP载药微球,考察β-CDP微球质量对替米考星β-CDP载药微球的影响,结果见图1。
由图1可知,随着β-CDP微球质量的增加,替米考星β-CDP载药微球的综合评分升高;当β-CDP微球质量为3g[即β-CDP微球与替米考星投料比(g∶g)为3∶0.25]时,综合评分最高;当微球质量大于3g后,综合评分反而降低。因此,确定适宜的β-CDP微球与替米考星投料比为3∶0.25(g∶g)。
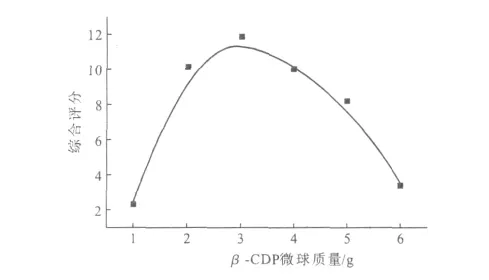
图1 β-CDP微球质量对替米考星β-CDP载药微球的影响Fig.1 The effect of quantity ofβ-CDP microspheres on tilmicosinβ-CDP microspheres
2.1.2 反应温度
β-CDP微球与替米考星投料比(g∶g)为3∶0.25、其它条件同2.1.1,考察反应温度对替米考星β-CDP载药微球的影响,结果见图2。
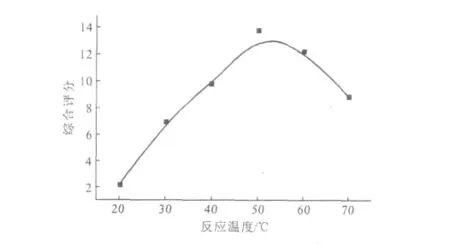
图2 反应温度对替米考星β-CDP载药微球的影响Fig.2 The effect of reaction temperature on tilmicosin β-CDP microspheres
由图2可知,随着反应温度的升高,替米考星β-CDP载药微球的综合评分升高;反应温度为50℃时,综合评分最高;反应温度高于50℃后,综合评分反而降低。因此,确定适宜的反应温度为50℃。
2.1.3 反应时间
反应温度为50℃,其它条件同2.1.2,考察反应时间对替米考星β-CDP载药微球的影响,结果见图3。
由图3可知,当反应时间为1.0h时,综合评分达到最高,此时包封率、产率达到最大,分别为66.05%、81.60%;继续延长反应时间,综合评分反而下降。因此,确定适宜的反应时间为1.0h。
2.2 替米考星β-CDP载药微球的表征
2.2.1 替米考星β-CDP载药微球的粒径和形貌
测得替米考星β-CDP载药微球的中位径(D50)为148.25μm,D97为366.94μm,粒径为正态分布,跨距为1.55。载药微球的粒径分布如图4所示。
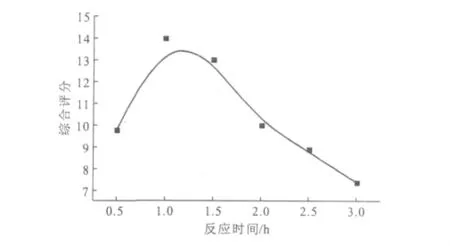
图3 反应时间对替米考星β-CDP载药微球的影响Fig.3 The effect of reaction time on tilmicosin β-CDP microspheres
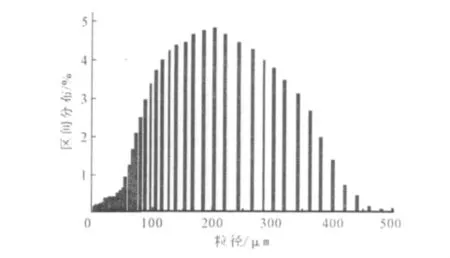
图4 替米考星β-CDP载药微球的粒径分布Fig.4 Particle size distribution of tilmicosinβ-CDP microspheres
替米考星β-CDP载药微球纯化前后的扫描电镜照片见图5。
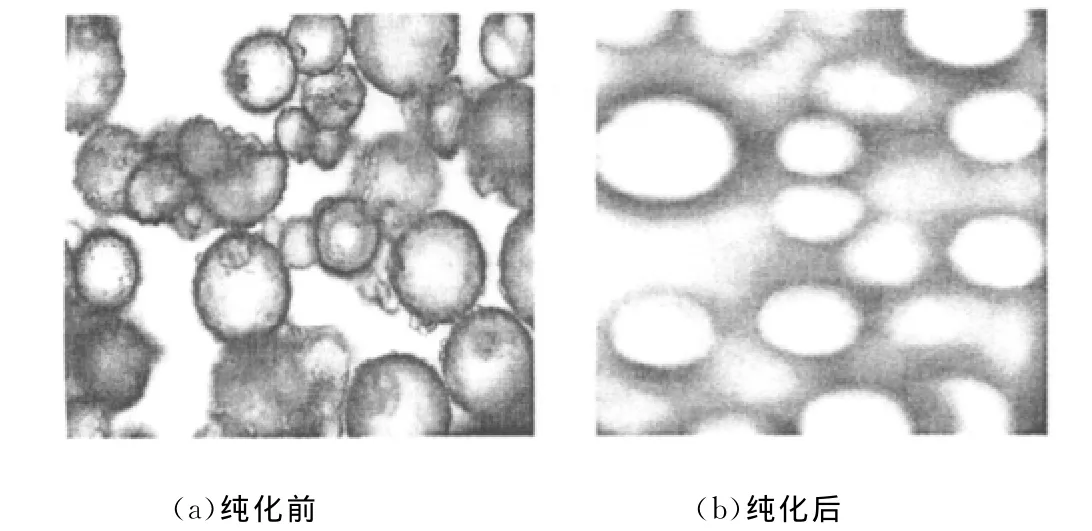
图5 替米考星β-CDP载药微球纯化前后的扫描电镜照片(放大200倍)Fig.5 The SEM images of tilmicosinβ-CDP microspheres before and after purification(magnification 200times)
由图5可知,纯化前,替米考星β-CDP载药微球的表面存在大量的附着物,这些是未反应的β-CD、ECH、分散剂以及没洗掉的煤油。而经过洗涤、抽滤及烘干处理后的微球,附着物大多已被除去了,微球的形态很好,表面比较圆整光滑,呈较好的圆球形。
2.2.2 红外光谱表征(图6)
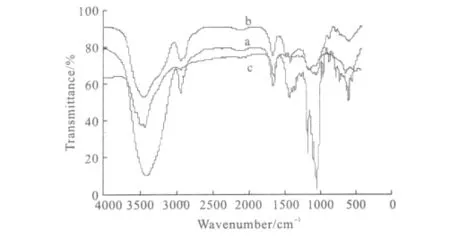
图6 β-CD(a)、β-CDP微球(b)与替米考星β-CDP载药微球(c)的红外光谱Fig.6 The IR spectra ofβ-CD(a),β-CDP microspheres(b)and tilmicosinβ-CDP microspheres(c)
由图6可知,3条曲线在3500~3400cm-1处都出现强的-OH伸缩振动吸收峰,替米考星β-CDP载药微球的-OH峰最强,β-CDP微球中-OH峰较β-CD明显减弱,说明含有大量-OH的替米考星和β-CDP微球已经结合;1300~1010cm-1处为醚键的特征峰,β-CDP微球的醚键峰又强又宽,表明β-CD和环氧氯丙烷很好地交联;与β-CDP微球相比,替米考星β-CDP载药微球在1200cm-1左右的酮基特征峰消失,可能是由于替米考星被β-CDP微球包载后替米考星进入到β-CDP微球的空腔内部。
2.3 替米考星β-CDP载药微球的体外释药性能(图7)
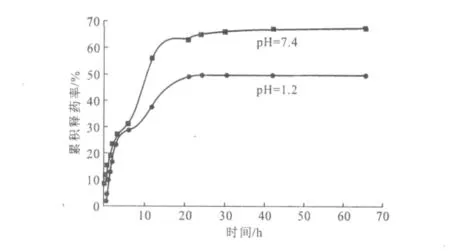
图7 替米考星β-CDP载药微球体外缓释累积曲线Fig.7 The cumulative curve of drug release of tilmicosin β-CDP microspheres in vitro
由图7可知,在pH值为7.4的PBS中,替米考星β-CDP载药微球刚开始的替米考星释放速率最快,继而变慢,整个过程呈持续缓慢释放的趋势。这可能是因为,刚开始替米考星的释放推动力大,同时吸附在微球表面的药物也快速溶解在水中,随着释放时间的延长,药物释放逐渐从微球表面过渡到微球内部,此时微球内部的药物缓慢而均匀向外扩散,40h以后基本达到平衡,24h时的释药率达64.37%,说明释药较好。而在pH值为1.2的PBS中,替米考星β-CDP载药微球24h时的累积释药率不到50%。因此,替米考星β-CDP载药微球在pH值为7.4的PBS中释药效果较好。
对替米考星β-CDP载药微球在pH值为7.4的PBS中的释药情况分别用零级、一级、Higuchi和Korsmeyer-Peppas公式进行拟合,结果见表1 。

表1 替米考星β-CDP载药微球体外累积释药曲线拟合结果Tab.1 The regression equation of cumulative curve of drug release of tilmicosinβ-CDP microspheres in vitro
由表1 可知,替米考星β-CDP载药微球的累积释药曲线与Korsmeyer-Peppas方程拟合较好。由释放指数0.32719可知,n<0.45,为菲克扩散。
3 结论
(1)在β-CDP微球质量为3g、替米考星质量为0.25g、反应温度为50℃、反应时间为1.0h、搅拌速度为400r·min-1的条件下制得的替米考星β-CDP载药微球的包封率为66.05%、产率为81.60%。
(2)替米考星β-CDP载药微球粒径分布均匀,外观圆整。
(3)替米考星β-CDP载药微球在pH值为7.4的PBS中释药效果较好。其累积释药曲线和Korsmeyer-Peppas方程拟合较好。
[1]Morise Z,Sugioka A,Kato R,et al.Transarterial chemoembolization with degradable starch microspheres,irinotecan,and mitomycin-C in patients with liver metastase[J].J Gastrointes Surg,2006,10(2):249-258.
[2]Yotaro Arakawa,Shigeru Kawakami,Fumiyoshi Yamashita,et al.Effect of low-molecular-weightβ-cyclodextrin polymer on release of drugs from mucoadhesive buccal film dosage forms[J].Biol Pharm Bull,2005,28(9):1679-1683.
[3]Liu Y,Yang Y W,Cao R,et al.Thermodynamic origin of molecular selective binding of bile salts by aminatedβ-cyclodextrins[J].Phys Chem B,2003,107(50):14130-14139.
[4]Romo A,Penas F J,Isasi J R,et al.Extraction of phenols from aqueous solutions by β-cyclodextrin polymers.Comparison of sorptive capacities with other sorbents[J].Reactive & Functional Polymers,2008,68(1):406-413.
[5]Zhang W F,Chen X G,Li P W,et al.Preparation and characterization of carboxymethyl chitosan and beta-cyclodextrin microsperes by spray drying[J].Drying Technology,2008,26(1):108-115.
[6]胡晖,刘郁杨,范晓东,等.温度及pH敏感的β-环糊精聚合物微球的合成及药物控制释放研究[J].高分子学报,2005,6(3):357-358.
[7]李仲谨,杨威,王培霖,等.β-环糊精聚合物微球的合成与表征[J].精细化工,2010,27(7):692-695.
