苯并芘B[a]P对泥蚶组织EROD、GST酶活力和MDA含量的影响
2013-10-13肖国强张炯明邵艳卿柴雪良吴洪喜滕爽爽
肖国强, 张炯明, 邵艳卿, 柴雪良, 吴洪喜, 刘 博, 方 军, 滕爽爽
(浙江省海洋水产养殖研究所,浙江省近岸水域生物资源开发与保护重点实验室,浙江 温州 325005)
多环芳烃(PAHs)是一类广泛存在于环境中的持久性有机污染物, 主要源于有机物的热解和石油、煤等化石燃料的燃烧, 通过地面径流、污水排放以及大气颗粒沉降进入海洋环境[1]。PAHs易被悬浮颗粒物所吸附结合在沉积物中, 很难发生光化学讲解或微生物氧化分解, 并且可能会重新释放进入到海水和生物体中对环境造成二次污染。苯并芘B[a]P是致癌性最强的一种 PAHs。已有研究表明[2]厦门西港表层海水中 16中 PAHs的含量, 其总浓度达到 103.4~2141.1 ng/L(B[a]P为5.5~23.4 ng/L), 而表层沉积物中PAHs的浓度在105.3~5118.3 ng/g。台州湾[3]海洋环境中表层、中层和底层水中16种PAHs总浓度的平均值为 3440.7、3067.1和 3726.9 ng/L(B[a]P为92.15、87.31和85.66 ng/L), 沉积物中PAHs含量为85.4~167.6 ng/g(B[a]P为0.06 ng/g)。研究表明, 生物体细胞、生物化学和分子水平上的变化可以最先反映污染物的毒性作用, EROD和GST是主要检测指标, 能够反映细胞色素P450依赖的混合功能氧化酶活性的变化, 用于检测多环芳烃亲脂性污染物的毒性效应; 而MDA是膜脂质过氧化反应的主要产物之一, 其含量的高低可以指示生物膜受氧化损伤的程度[4-5]。
双壳贝类与其他海洋生物相比, 具有分布广、富集能力强、采样和检测较容易等优点, 更重要的是其体内有机污染物水平能够较准确地反应出环境中的污染水平, 被广泛地应用于海洋环境中有机污染物的检测, 如全球性的“Mussel Watch”计划。目前, 一些学者开展了 B[a]P对贝类毒理学的研究,但是主要集中在牡蛎、贻贝和扇贝[6-8], 对营埋栖生活的滩涂贝类却未见报道。本文研究了B[a]P对代表性滩涂贝类泥蚶(Tegillarca granosa)的胁迫和释放2个阶段, 泥蚶消化盲囊和鳃丝EROD、GST活性和脂质过氧化物(MDA含量)的变化规律, 探讨EROD,GST和MDA作为泥蚶解毒代谢指标的可行性, 为滩涂贝类的健康养殖和养殖环境 PAHS污染监测提供理论基础。
1 材料与方法
1.1 实验材料
实验所用泥蚶取自温岭市乐海水产养殖场(国家贝类产业技术体系浙江综合试验站核心示范区),平均壳长(3.2±0.13)cm。实验在浙江省海洋水产养殖研究所清江基地开展, 实验开始前暂养7 d, 实验用海水为二级砂滤海水, 海水盐度 21~24, pH为7.9~8.1, 温度为(25±2)℃, 连续充气, 日换水100%, 每天早晚投喂适量的金藻或者角毛藻, 暂养密度为400个/m3。
1.2 实验方法
B[a]P胁迫浓度梯度设置为0.05、0.5、5和10μg/L,实验用B[a]P购自Sigma公司, 采用丙酮作为助溶剂配置成B[a]P储备液, 实验用时分别用砂滤海水配置成各浓度梯度, 以自然海水组为对照, 每个实验梯度均设3个平行。实验组丙酮的浓度小于 0.005 %,预实验结果显示, 自然海水组和含有 0.005%的丙酮实验组, 泥蚶的解毒代谢酶活力无显著差异。
实验在30 cm×40 cm×50 cm的塑料水槽内进行,实验水体为 50 L, 每个水槽放入活力好, 无损伤的泥蚶45只, 实验期间的养殖管理和暂养期间完全相同, 换水时分别加入对应各梯度的海水。实验分为然胁迫阶段15 d和清除阶段15 d, 实验开始后分别于0、1、5、10、15、20、25、30 d 取样, 每个平行随机取3只泥蚶个体, 分别取消化盲囊和鳃丝, 用预冷双蒸水洗净、滤纸吸干后, 置于1.5 mL离心管中, 保存于-80℃超低温冰箱中待测。
1.3 样品制备
将泥蚶消化盲囊和鳃丝分别置于预冷磷酸缓冲液(pH=7.6)和Tri-HCI缓冲液中(0.1 mmol的EDTA,pH=8.3), 冰浴12 000 r/min匀浆3 min, 将匀浆液3 000 r/min 离心20 min(4℃), 上清液即为待测酶液。
1.4 酶活性测定
EROD活性参照 Pohl[9]改进的快速终止荧光分光光度法, 活力单位用每分钟每毫克蛋白产生的异吩唑酮(resorufin)相对量的多少来表示, 单位:nmol/(min·mg)prot); 谷胱甘肽硫转移酶(Glutathione S-transferase,GST)和脂质过氧化物含量 LPO采用试剂盒测定(购自南京建成生物工程研究所), GST通过催化还原型胱甘肽(GSH)与 1-氯-2,4-二硝基苯(CDNB)结合的能力, 通过检测 GSH 浓度的高低反映 GST活力的大小, 单位:nmol/(min·mg); LPO含量通过检测MDA含量的变化, 定义为每毫克组织蛋白中所含有丙二醛的质量, 单位: (nmol/mg); 蛋白含量测定采用考马斯亮蓝比色法。
1.5 数据分析
实验数据用统计学方法分析, 数据平均值±标准偏差(Means ± SD)表示, 并用单因素方差分析对数据进行统计, 以P<0.05 为显著性差异, 以P<0.01 为极显著性差异。
2 结果
2.1 B[a]P对泥蚶组织EROD活力的影响
图1可看出, 泥蚶消化盲囊和鳃丝低浓度组(0.05 μg/L)EROD 活力随时间变化不明显(P>0.05),其他各处理组EROD活性均被诱导, 其中0.5μg/L处理组 EROD活性与对照组相比差异显著(P<0.05),而5μg/L和10μg/L处理组与对照组相比差异极显著(P<0.01), 5 d后达到峰值并处于稳定。在清除阶段,0.5μg/L处理组5 d后与对照组无显著差异, 而5μg/L和10μg/L处理组10 d无显著差异。
2.2 B[a]P对泥蚶组织GST活力的影响
泥蚶消化盲囊和鳃丝GST活力的变化如图2所示, 呈逐渐下降趋势, 5 d后基本趋于稳定, 除低浓度组(0.05 μg/L)与对照物无明显差异, 其他处理组与对照组差异显著(P<0.05)。清除阶段 0.5 μg/L处理组5 d即与对照组无显著差异(P>0.05), 而5 μg/L和10 μg/L处理组10 d时恢复至对照组水平。
2.3 B[a]P对泥蚶组织LPO水平的影响
B[a]P染毒和清除阶段, 泥蚶消化盲囊和鳃丝MDA含量的变化如图3所示。MDA含量随时间呈上升趋势, 在染毒1 d后, 除低浓度组(0.05 μg/L)外,各处理组MDA含量与对照组差异显著(P<0.05), 并在第10 d基本达到峰值并趋于稳定。清除5 d后, 5 μg/L处理组鳃丝和10 μg/L仍显著高于对照组, 清除10 d后,各处理组与对照组无显著差异。
3 讨论
3.1 B[a]P对泥蚶组织EROD, GST活力和MDA含量的影响
许多学者研究发现一些鱼类受到 PAHs的影响,能够明显诱导EROD的活力, EROD活力越大, 污染物的毒性效应越高[10-12]。研究表明, 青鳉的 EROD活力能够被PAHs显著诱导, 可以作为污染监测的标志物[13], 黑鲷的肝脏的 EROD活力也与 B[a]P浓度呈较好的线性关系[14]。本研究中, 低浓度处理组(0.05μg/L)EROD活力变化不大, 而在5 μg/L和10 μg/L处理组EROD活力则被极显著诱导(P<0.01), 5 d后趋于稳定, 表现出一定的剂量效应关系, 但是有研究发现长期暴露在大剂量的 PAHs的环境中, 会破坏CYP1A的结构, 导致EROD的活性下降[15]。本实验中在清除阶段EROD活力在5~10 d即恢复到了对照组水平, 表明B[a]P对泥蚶造成的损伤可以可逆的,未超出生物体的自我修复能力。鳃丝的EROD活力小于消化盲囊, 可能是由于B[a]P在鳃丝积累程度和敏感度均较低。
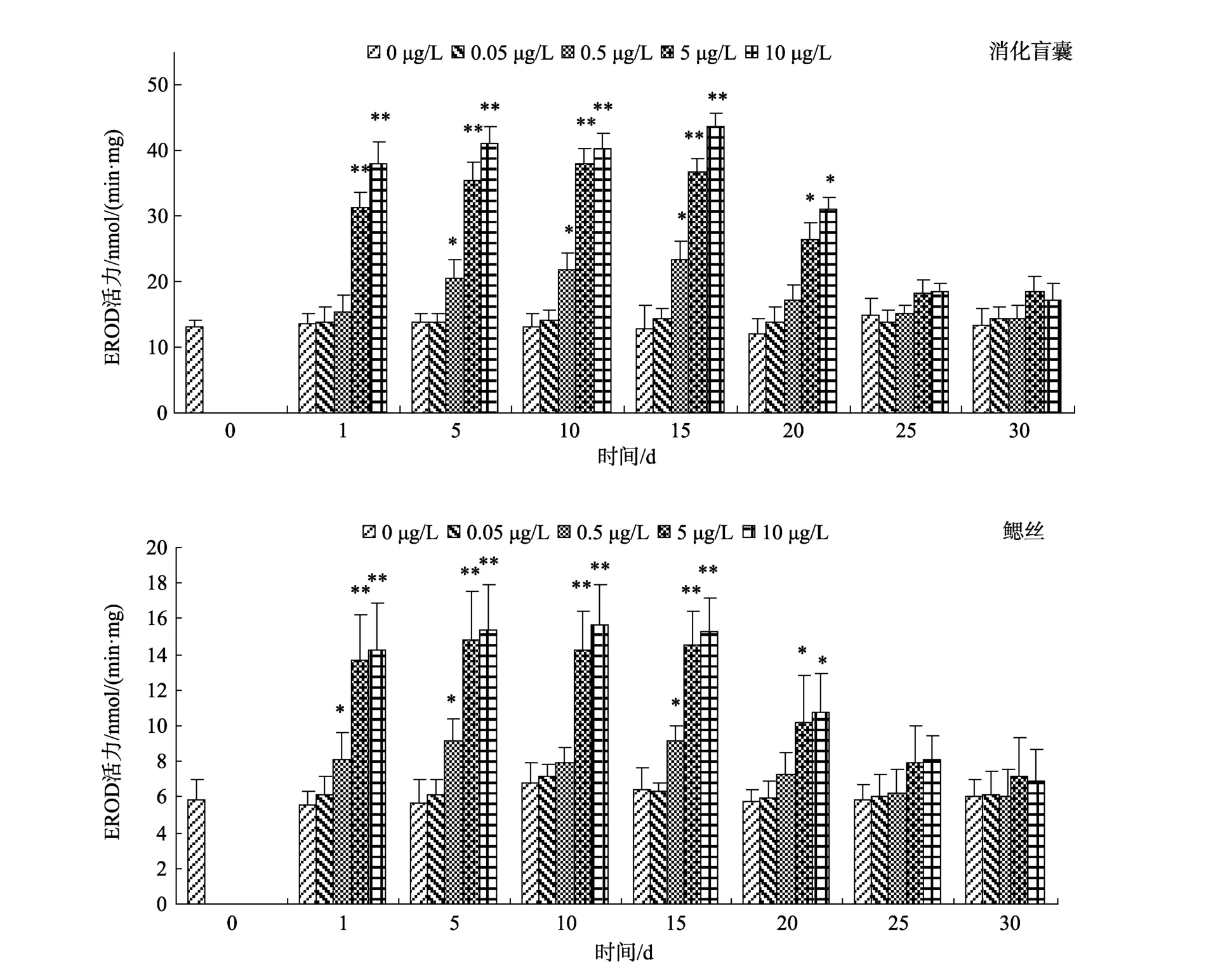
图1 不同浓度B[a]P对泥蚶组织EROD活力的影响Fig. 1 Effect of B[a]P on EROD activities of tissues in Tegillarca granosa
研究表明,PAHs进入生物体经过I相代谢, 形成的中间产物可产生大量的活性氧物质[16], GST是 II相代谢抗氧化酶的代表成分可催化中间代谢物的结合, 使之形成水溶物排出机体外。一些研究表明[17-18]生物受到PAHs胁迫时, GST活力在低剂量短时间内会被诱导, 但是长时间或者高剂量的胁迫下会呈下降趋势, 表现出一定的时间效应和剂量, 通过一定时间的清除能够恢复对照组水平。从本实验结果来看, 除低浓度组(0.05 μg/L)与对照物无明显差异, 其他处理组与对照组差异显著(P<0.05)。清除阶段0.5 μg/L处理组5 d即与对照组无显著差异(P>0.05),而5 μg/L和10 μg/L处理组10 d时恢复至对照组水平, 这与上述结果基本一致, 但是各处理组未表现出先诱导后抑制的变化趋势, 作者认为可能泥蚶对B[a]P的胁迫响应较为迅速, 短时间内表现出被诱导效应(小于24 h)。通过清除恢复处理, 各实验组5~10 d即恢复正常水平, 有些生物需要15~20 d, 才能完全恢复到正常水平, 虽然不同生物对PAHs胁迫的响应略有差别, 但均能有效的反应生物受胁迫, 解毒和恢复的过程。
本实验的高浓度处理组MDA含量随时间一直呈上升趋势, 在10 d后基本达到了峰值, 这表明泥蚶受到B[a]P的胁迫后, GST活力和抗氧化酶系统活力下降, 不能被及时清除的活性氧物质对机体产生一定的损伤, 泥蚶处于中毒状态。清除5~10 d后各处理组与对照无显著差异, 这与杨涛研究苯并(b)荧蒽对翡翠贻贝的胁迫结果相似[7]。
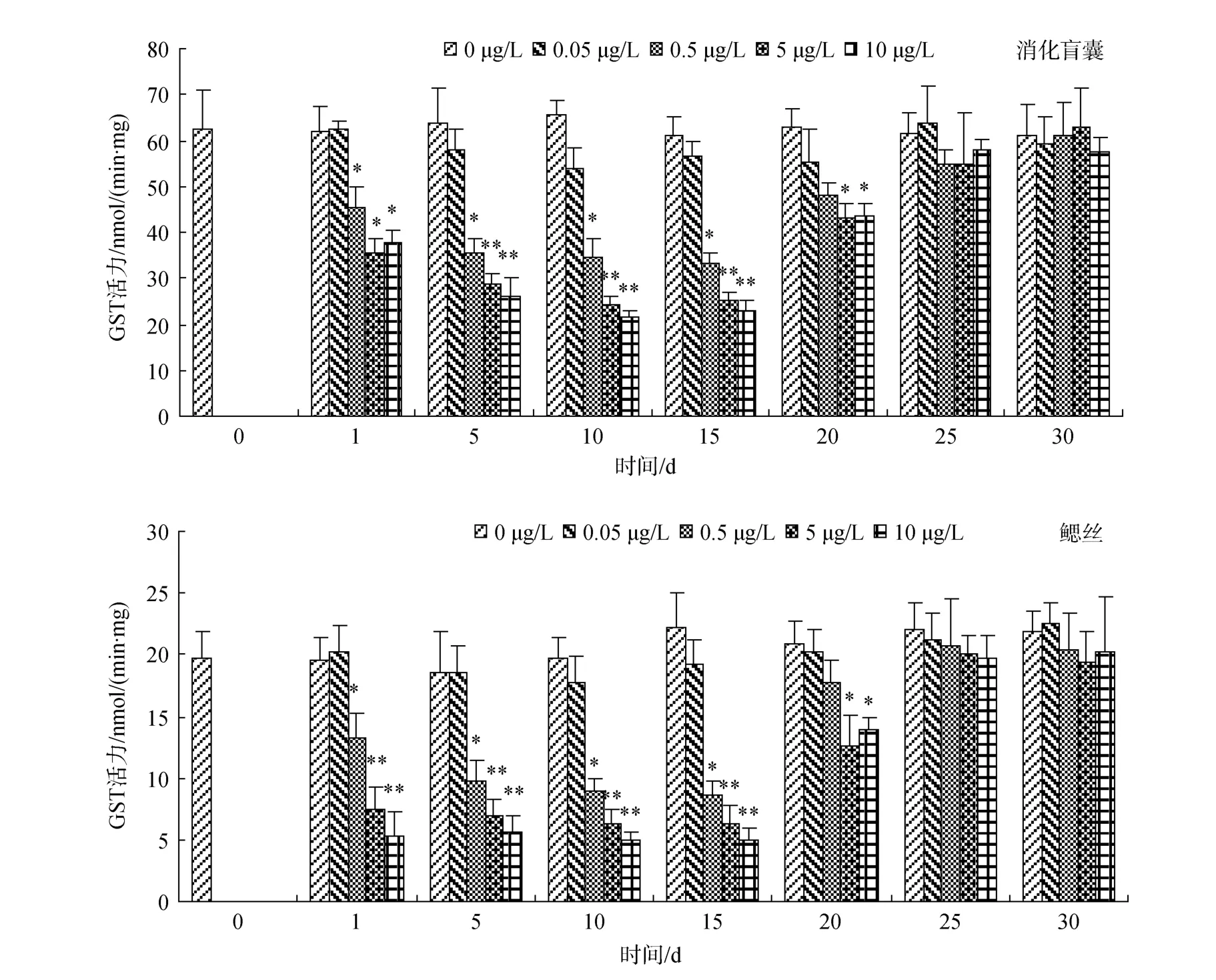
图2 不同浓度B[a]P对泥蚶组织GST活力的影响Fig. 2 Effect of B[a]P on GST activities of tissues in Tegillarca granosa
3.2 EROD, GST和MDA作为泥蚶解毒代谢指标的探讨
本实验中无论是 B[a]P的胁迫阶段还是清除阶段, 泥蚶组织中EROD、GST和MDA含量都表现出很强的规律性。高浓度处理组 EROD活力和 MDA含量随着浓度的升高和胁迫时间的延长呈上升趋势,但是在5~10 d左右会达到峰值, 而GST活力则明显被抑制, 5 d达到最低值, 均具有一定的时间效应和剂量效应。这种效应关系在Huang Zhouying[19]利用B[a]P和TBT对蛤的胁迫研究, Kristine[20]利用B[a]P 2种鲶鱼的胁迫研究, 任加云[18]利用苯并(a)芘和苯并(k)荧蒽混合物对栉孔扇贝的胁迫研究中得到了验证。研究表明, 生物在污染物的胁迫下, 组织细胞中的褐脂质小粒和过氧化物酶体密度变大, 从而导致EROD活力升高[21]。本实验 5 μg/L和 10 μg/L处理组 5 d后 EROD活力达到峰值并趋于稳定, 这表明EROD活力被诱导达到极限, 而XU Wenju[22]研究表明,超高剂量菲(Phe 100~400μg/L)长时间胁迫罗非鱼(4 d以上)会导致EROD活力诱导后被抑制, 泥蚶是否会在超高剂量的胁迫下EROD活力出现诱导后被抑制有待进一步认证。
GST活力受到抑制表明, 当机体受到重度胁迫,产生的氧化压力超过机体的调节能力时, 此时不能被及时清除的活性氧物质就会对机体产生一定的损伤, 抗氧化酶活力可能会下降[23], 需氧生物的细胞膜磷脂分子不断受到氧化压力的攻击, 导致膜和脂质的过氧化。通过测定MDA含量能够有效评价脂质过氧化的程度, 比较准确的反映PHAs对生物体的胁迫和自我解毒作用。
本研究选择的EROD, GST和MDA表现出较强的敏感性, 并且在海洋无脊椎动物的抗氧化防御系统已广泛用作污染检测的指标[24-25]。但是泥蚶作为滩涂贝类的典型代表, 主要营埋栖生活, 不仅受海水中PHAs的影响, 可能还受到海洋沉积物中PHAs的影响, 因此要综合考虑两方面的因素进一步开展相关研究。

图3 不同浓度B[a]P对泥蚶组织MDA含量的影响Fig. 3 Effect of B[a]P on MDA content of tissues in Tegillarca granosa
[1]朱利中, 松下秀鹤.空气中PAHs的研究现状[J]. 环境科学进展, 1997, 5: 19-29.
[2]刘岩, 张祖麟, 洪毕生. 厦门西港表层海水中 PAHs含量分布特征和来源进行分析[J].海洋通报, 1999, 18:38-43.
[3]江锦花.近海海洋环境中多环芳烃的浓度水平及来源分析 [D]. 杭州: 浙江大学硕士学位论文.2009.
[4]Au D WT, Wu R S S, Zhou B S, et al. Relationship between ultra-structural changes and EROD activities in liver of fish exposed to benzo[a]pyrene[J]. Environ Pollut, 1999, 104: 235-247.
[5]王菊英, 霍传林, 韩庚辰.多氯联苯 CB-28对牙鲆肝脏中EROD活性的诱导作用研究[J]. 海洋学报, 2003,25(增2): 35-40.
[6]Goldberg E D. The Mussel Watch: a first step in global marine monitoring[J]. Mar Pollut Bull,1975, 6: 111-120.
[7]杨涛, 陈海刚, 蔡文贵, 等.翡翠贻贝内脏团抗氧化酶活性及脂质过氧化物含量对苯并(b)荧蒽胁迫的生物响应研究[J]. 生态毒理学报, 2011, 6(5): 539-545.
[8]潘鲁青, 刘娜. 栉孔扇贝在 B[a]P胁迫下生物标志物筛选的研究[J]. 水生生物学报, 2012, 36(2): 299-306.
[9]Pohl R J, Serabjit-Singh C J. Hepatic microsomal nadph-cytochromeP-450 reductase from little skate,Raja erinacea, comparison of thermo-lability and other molecular properties with a mammalian enzyme [J].Chem Biol, 1983, 45: 283-294.
[10]Goksoyr A, Forlin L. The cytochromeP-450 syestem in fish, aquatic toxicology and environmental monitoring[J].Aquat Toxicol,1992,22:287-312.
[11]David F V, Loannides L C. CytochromesP450 and species differences in xenobiotic metabolism and activation of carcinogen[J]. Environmental Health Perspectives, 1998, 106(10): 633-640.
[12]Bucheli T D, Kent K. Induction of cytochromeP450 as a biomarker for environmental contamination in aquatic ecosystem[J]. Critical Review of Environmental Science Technology, 1995, 52: 201-268.
[13]Orkuma J C, Jiro K. Comparative study of bioconcentration and EROD activity induction in the Japanese flounder, red sea bream, and java medaka exposed to polycyclic aromatic hydrocarbons[J]. Environ Toxicol,2008, 23: 354-362.
[14]穆景利, 王新红, 王淑红, 等.苯并(a)芘影响黑鲷肝脏 EROD活性变化的动力学研究[J]. 2009, 33(1),68-71.
[15]Stegeman J J, Hahn M E. Biochemistry and molecular biology of monooxygenase: current perspective on forms, functions, and regulation of cytochrome P450 in aquatic species[J]. Boca Raton: Lewis Publishers, CRC Press, 1994, 87-206.
[16]Winsten G W,Thomas P. Prooxidant and antioxidam mechanisms in aquatic organisms[J]. Toxicol, 1991, 19:137-161.
[17]WANG Chonggang,ZHAO Ying, ZHENG Ronghui,et al.Effects of tributyltin, benzo[a]pyrene, and their mixture on antioxidant defense systems inSebastiscus marmoratus[J].Environ Toxicol, 2006, 65: 381-387.
[18]任加云, 潘鲁青, 苗晶晶.苯并(a)芘和苯并(k)荧蒽混合物对栉孔扇贝毒理学指标的影响[J].环境科学学报,2006, 26(7): 1180-1186.
[19]Zhouying Huang, Yixin Chen, Yang Zhao. Antioxidant responses in Meretrix meretrix exposed to environmentally relevant doses of tributltin[J]. Environ Toxicol,2005, 20: 107-111.
[20]Kristine L W, Piero R G, Laila A. Lienesch. Comparative metabolism and excretion of benzo(a)pyrene in 2 species of lctalurid catfish[J]. Toxicological Sciences,2000, 58: 68-76.
[21]Krisknakumar P K, Casillas E, Varanasi U. Effect of ehemical contaminants on the health ofMytilus edulisfrom Puget Sound, Washington. Ⅱ Cytochemical detection of subcellular changes in digestive cells[J].Marine Biology, 1995, 124: 251-259.
[22]XU Wenju, LI Yuanyou, WU Qingyang. Effects of phenanthrene on hepatic enzymatic activities in tilapia [J].Journal of Environmental Sciences, 2008, 6: 854-857.
[23]王丽平, 郑丙辉, 孟伟.环境污染物对水生生物产生养化压力的分子生物标志物[J].生态学报, 2007, 27(1):380-388.
[24]Brown R J, Galloway T S, Lowe D, et al .Differential sensitivity of three marine invertebrates to copper assessed using multiple biomarkers[J]. Aquati Toxicology, 2004, 66(3): 267-278.
[25]Gorinstein S, Moncheva S, Katrich E, et al.Antioxidants in the black mussel (Mytilus galloprovincialis)as an indicator of black sea coastal pollution[J]. Marine Pollution Bulletin, 2003, 46(10):1317-1325.
