Mg2Al-Cl-LDH载体转染细胞的研究
2013-10-11林嘉鹏吴阳升汪立芹田永芝黄俊成
刘 莉, 林嘉鹏, 吴阳升, 汪立芹, 田永芝, 黄俊成
(1.新疆农业大学农学院,新疆 乌鲁木齐 830052;2.新疆畜牧科学院生物技术研究中心,新疆维吾尔自治区动物生物技术重点开放实验室,农业部草食家畜繁育生物技术重点开放实验室,新疆 乌鲁木齐 830000)
将DNA或者RNA转染入细胞中是生物化学和分子生物学目前主要的技术,导入的外源遗传物质会引起蛋白质合成抑制或者是基因沉默。单独的核酸物质是不能够穿过细胞壁的,所以需要有效的载体来运输[1]。常见运输载体有病毒、脂质体和聚合物等,尽管大多数有关研究都注重于用病毒介导的方法将基因于体外和体内送递进入细胞,然而非病毒基因载体由于其安全性高、易于制备和工艺放大、不会引起特异的免疫应答等优点而备受青睐。
Mg2Al-Cl-LDH是一种新型的潜在的投递外源基因的载体。最近的研究结果表明,由于LDH纳米颗粒具有独特的化学性质,所以具备一些独特的优势。首先一个明显的优势就是它具有可调节的阴离子夹层结构,使其具有强负载能力把具有生物活性的物质比如核酸分子插入其中[2];其次它表面带正电,能够明显地与细胞膜上带负电的基团发生吸附并跨过细胞膜;再次它具有单一的化学成分,所以显示出低细胞毒素和高生物相溶性[3]。
Xu等[4]用LDH与pEF-eGFP质粒共转染HEK 293T细胞,其转染效率是脂质体转染的7% ~15%。Ladewig等[5]用 Mg2Al(OH)6NO3LDH 纳米颗粒材料与质粒DNA共转染HEK293T、NIH3T3、COS-7和CHO-K1等贴壁细胞系,但无法转染悬浮培养的CHO-S细胞,还发现制备LDH复合溶液条件的改变会影响纳米粒子在悬浊液中的分散度。本研究利用合成的LDH悬浊液与pEGFP质粒共转染HEK293T细胞,设计不同LDH浓度和不同转染时间,并分别检测其转染效率,希望对今后纳米材料在细胞转染、运输干扰RNA及药物治疗载体等生物技术领域的进一步应用奠定基础。
1 材料与方法
1.1 试验材料
293T及C2C12细胞由新疆畜牧科学院绵羊中心实验室保存;培养细胞器皿及耗材购自上海生工生物公司;GFP质粒由新疆畜牧科学院绵羊中心实验室制备。标准胎牛血清FBS从Hyclone公司购买;DEME培养基、胰蛋白酶购自Gibco公司;甘氨酸购自Bio-Rad公司;脂质体Lipofectamine 2000从Invtitrogen公司购买;化学试剂购自天津市福晨化学试剂厂。
1.2 试验方法
1.2.1 LDH的制备 配制A溶液(含0.3 mmol/L MgCl2和 0.1 mmol/L AlCl3):称 取0.609 9 g MgCl2·6H2O 和 0.241 4 g AlCl3·6H2O,溶于 10 ml去离子水中;配制B溶液(0.15 mmol/L NaOH):称取0.240 g NaOH,溶于40 m l去离子水中。将10 ml A溶液边搅拌边加入40 m l B溶液中。将混合液隔绝空气磁力搅拌10 min。4 500 r/min离心10 min,将沉淀洗涤2次。将沉淀溶于40 ml去离子水中,37 ℃ 300 r/min搅拌10 min,并定容到45 ml,放入特制的不锈钢皿中。100℃加热16 h。将混合液自然冷却到室温,放置备用。
1.2.2 LDH表型的测定 将10μl LDH加入到90 μl无水乙醇中,振荡混匀10 min,然后进行透射电镜扫描。
1.2.3 LDH转染细胞 将冻存在液氮中的293T细胞取出,迅速加入到40℃的水中,快速搅动,待细胞完全融化,将其转移到15 ml离心管中,并加入5 m l D-Hanks溶液,3 000 r/min离心10 min,弃上清,将底层细胞分散在7 ml 10%FBS培养基中。在5%CO2、37℃培养箱中培养。C2C12细胞同法处理。待细胞生长融合度达到95%以上时进行传代,小心倒掉原有培养基,用4 ml D-Hanks溶液轻轻晃动清洗细胞后将液体倒掉,重复此步骤;再加入500μl胰酶,上下、左右轻轻晃动,37℃培养箱中培养放置2 min;取出后从培养瓶底部轻拍至所有细胞完全脱离瓶壁,加入5 ml DMEM吹散细胞,使其充分悬浮后弃去2ml悬浮液,将剩余细胞悬浮加入到7ml10%FBS培养基中,上下、左右、前后晃动至分散均匀,放入培养箱继续培养,传至3~4代。C2C12细胞的培养方法同293T细胞的培养方法,将复苏的C2C12细胞中加入10%FBS+100 U/mg青霉素+100 mg/L链霉素,培养至G3代。提取含有eGFP基因的质粒,取 LDH(0.80%)100 μl和质粒(1.6 μg/μl)20 μl混合30 min。将混合物离心10 min,将沉淀重悬于1 ml 10%血清培养基中,静置10 min。与此同时,将6孔板中的细胞用1%Dhanks冲洗细胞2遍后,加入2 ml 10%血清培养基。将LDH混合液加入孔中,摇动培养板,轻轻混匀。在37℃、5%CO2中保温3 h。之后,更换含有10%血清的培养基,在37℃、5%CO2中保温12~72 h检测转染水平。根据不同DNA/LDH的质量比(0/50~10/50),根据不同的培养时间(12 h、24 h、36 h、48 h、56 h),设计梯度试验。
1.2.4 流式细胞仪检测 在平板中加入胰蛋白酶将细胞消化下来,用1×PBS洗1遍,4 500 r/min离心10 min,重复此步骤3遍。之后将细胞重悬于10 ml双蒸水中,上流式细胞仪进行检测。
2 结果
2.1 Mg2 Al-Cl-LDH颗粒的结构
Mg2Al-Cl-LDH是层状双氢氧化物,由二价的镁离子和三价的铝离子组成,化学组成式为Mg2Al(OH)6(Cl)·1.5H2O,它是具有水滑石层状晶体结构的混合金属氧化物,其基本结构单元是镁铝氢氧化物六边形结构层,其片面重叠形成水滑石晶体颗粒。在150 000×透射电镜下观察,Mg2Al-Cl-LDH颗粒大小有差异,颗粒直径主要分布在100 nm左右(图1)。
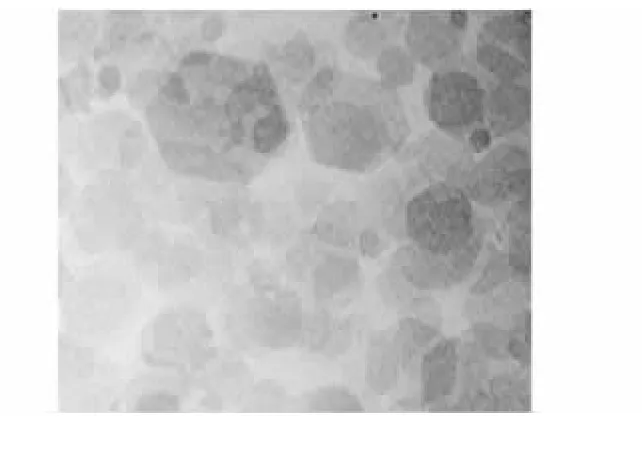
图1 M g2 A l-Cl-LDH颗粒在透射电镜下的结构Fig.1 Structure of Mg2 Al-Cl-LDH particles in a transmission electron microscope
2.2 Mg2 Al-Cl-LDH的细胞毒性
以不同浓度(0~500μg/ml)的LDH悬液加入到每孔含有4×105个细胞的平板中,在CO2培养箱中37℃培养24 h后,检测细胞活性。纳米颗粒在转染细胞时,随着颗粒浓度的增加,细胞活性呈先下降后上升再下降的趋势(图2)。当LDH浓度过高时,细胞无法胞吞过多的纳米颗粒,过多的颗粒分散在细胞培养基中,使细胞的呼吸和生长都受到影响,最终使细胞活性下降甚至死亡。LDH浓度为200 μg/ml时,细胞活性比较强,但是与其他浓度之间的差异不大,当LDH浓度为500μg/ml时细胞活性下降非常快。
比较脂质体和纳米转染结果可见,纳米材料与脂质体同转染10μg/ml荧光质粒时,纳米材料的转染效果不如脂质体理想。
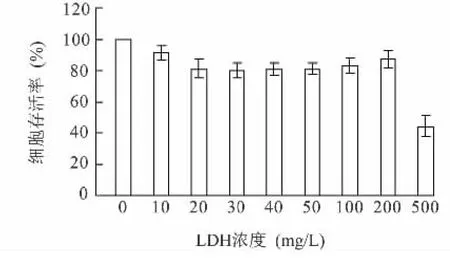
图2 不同LDH浓度下的细胞毒性测定Fig.2 Cytotoxicity in different concentrations of LDH
2.3 Mg2 Al-Cl-LDH纳米材料转染细胞体系的建立
LDH作为投递基因的载体,携带eGFP基因进入细胞,其表达的蛋白质具有荧光,因此可以用流式细胞仪进行检测,从而判断转染效率的水平。以不同DNA/LDH质量比(0/50~10/50)进行试验,流式细胞检测结果显示4/50的比例下转染效率最高,达到了11.17%(图3)。
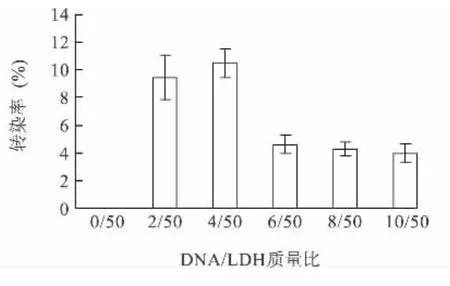
图3 不同DNA/LDH质量比下的转染效率Fig.3 The efficiency of transfection of the system with differentmass ratios of DNA/LDH
在LDH和质粒DNA混合反应的过程中,时间对反应是有影响的,随着时间从5 min到30 min,两者相互吸附的数量呈先上升后下降的趋势(图4)。在15 min时相互吸附的数量最多,转染后表达的荧光蛋白质也最多,转染率达到最高值(6.07%)。
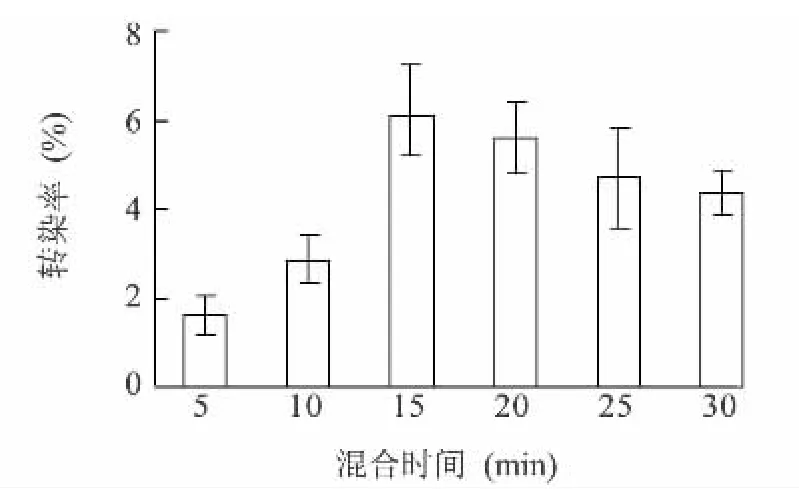
图4 不同的DNA和LDH反应时间下的转染效率Fig.4 Transfection efficiency of the system with different reaction time of DNA and LDH
当转染细胞放入培养箱中培养时,随着培养时间的增加,从12 h时的转染率3.5%上升达到48 h时的最大值12.6%,随后出现下降的趋势(图5)。在72 h时由于细胞培养时间过久,密度过大,细胞无法正常呼吸和生长,活性降低,活细胞数量降低,表达出的GFP蛋白质也减少。当转染C2C12细胞时也呈现随着时间的延长先上升后下降的趋势,但是C2C12细胞的平均转染率比293T细胞高,平均转染率达到13.6%,最大值为17.4%。
因此确定Mg2Al-Cl-LDH纳米材料转染细胞体系:DNA/LDH的质量比为4/50,DNA与LDH的混合时间为15 min,细胞培养时间为48 h,纳米颗粒浓度为200 mg/L。

图5 HEK 293T和C2 C12细胞在不同培养时间下的转染效率Fig.5 Transfection efficiencies of HEK 293T cells and C2 C12 cells cultured for different time
3 讨论
3.1 Mg2 Al-Cl-LDH颗粒的结构和性质
有研究结果表明Mg2Al-Cl-LDH中由于高价的Al3+取代了部分低价的 Mg2+,使得正电荷过剩,Mg2Al-Cl-LDH带正电,这些过剩的正电荷由反离子平衡,反离子和部分水分子存在于两个类水镁石片中间的间隙里而层板上有氢氧基团,它的碱性位可使其与其他化合物反应,从而提供了丰富的碱中心,使其更稳定。另外LDH间层的阴离子可在一定条件下与各种功能阴离子进行交换,使LDH成为具有应用性能的超分子插层结构材料[6]。通过插层使体积较大的阴离子取代体积较小的阴离子进入层间,得到更多的反应空间和暴露更多的活性中心,使它的催化性能更为显著[7]。并且其粒子大小及粒子分布可以通过合成方法和条件进行控制,本试验中Mg2Al-Cl-LDH颗粒直径主要分布在100 nm左右。
然而纳米颗粒制作后,在透射电镜下还是可以看到一些没有结合的分子晶体,说明结合效率不能达到100%。并且Mg2Al-Cl-LDH颗粒是不稳定的,放置一周之内,颗粒状态比较稳定,颗粒分散均匀,悬液颜色清澈,但是时间超过一周,随时间的延长,颗粒出现团集,形成大分子的颗粒,悬液也变得浑浊,从而影响转染效率。
3.2 Mg2 Al-Cl-LDH颗粒与质粒DNA的作用
Mg2Al-Cl-LDH颗粒有“质子海绵效应”,因此能够通过静电吸附作用携带带负电荷的基因物质如寡核苷酸,通过空间位阻效应,防止体内DNA酶对寡核苷酸的降解,并且能够将复合的 DNA运送到细胞核内,实现有效的基因转染[8]。在复合的过程中,由于纳米颗粒整体呈现碱性,带负电荷的Cl-离子位于双层结构的中间,带正电荷的离子会延展到双层结构的外部,与带负电的DNA双螺旋结构相互复合。因此当纳米颗粒与核酸物质相结合的时候,核酸物质的负电荷与纳米颗粒的正电荷随着浓度的变化,两者的结合能力也发生着变化,本试验中DNA/LDH质量比为4/50时转染效率最高,可能就是因为此时的正负电荷比例最恰当。同时两者电荷比例的变化还会降低由过强正电荷产生的载体本身的细胞毒性,也可增加转染效率,本试验中200 μg/m l纳米颗粒浓度下细胞活性还可达到83%。随着时间的变化,两者的复合数量先增加然后减少,说明两者的复合作用是不稳定的,在15 min时,稳定性比较高。Mg2Al-Cl-LDH是可生物降解的高分子材料,当浓度达到200μg/ml时细胞活性还是比较强的,然而达到500μg/ml时细胞活性下降非常快,说明即使纳米颗粒可降解,但是还是有细胞毒性的。
3.3 Mg2 Al-Cl-LDH颗粒与细胞膜的相互作用
因为Mg2Al-Cl-LDH颗粒与DNA分子相互结合后形成的团聚体正好能够被细胞胞吞,并且能够在细胞浆内释放DNA分子进入细胞,有人认为,纳米颗粒进入细胞主要取决于颗粒的粒径大小[9]。当颗粒粒径在小于200 nm时,细胞容易以网格蛋白质介导的主动胞吞方式将颗粒胞吞入细胞;而500 nm左右的颗粒以细胞质膜微囊的胞吞方式进入细胞。Mg2Al-Cl-LDH颗粒大小为100 nm左右,因此推测本试验纳米颗粒进入细胞的过程应该与网格蛋白质的介导有关[10]。然而不同细胞的网格蛋白质数量和介导能力可能不同,所以出现了293T和C2C12细胞的转染效率不同,也有可能是细胞培养时用的都是六孔板,C2C12的细胞形态大,相对生长密度就小,相对转染效率就高。与脂质体相比,无论是使用293T细胞还是C2C12细胞,纳米颗粒的转染效率都还是比较低的,然而纳米载体具有安全性高、易于制备和工艺放大、不会引起特异的免疫应答等优势。
[1] XU Z P,ZENG QH,LU G Q,et al.Inorganic nanoparticles as carriers for efficient cellular delivery[J].Chemical Engineering Science,2006,61:1027-1040.
[2] DESIGAUX L,BELKACEM M B,RICHARD P,et al.Self-assembly and characterization of layered double hydroxide/DNA hybrids[J].Nano Lett,2006,6(2):199-204.
[3] WONG Y,MARKHAM K,XU Z P,et al.Efficient delivery of siRNA to cortical neurons using layered double hydroxidenanoparticles[J].Biomaterials,2010,31:8770-8779.
[4] XU Z P,WALKER T L,LIU K L,et al.Layered double hydroxide nanoparticlesas cellular delivery vectors of supercoiled plasmid DNA[J].International Journal of Nanomedicine,2007,2(2):163-174.
[5] LADEWIG K,NIEBERTM,XU Z P,et al.Efficient siRNA delivery to mammalian cells using layered double hydroxide nanoparticles[J].Biomaterials,2010,31:1821-1829.
[6] VAGVOLGYIV,PALMER S J,KRISTOF J,et al.Mechanism for hydrotalcite decomposition:a controlled rate thermal analysis study[J].JColloid Interface Sci,2008,318(2):302-308.
[7] ZEJIANG Z,CHENGHUA X,FALIQ,et al.Study on fire-retardant nanocrystalline Mg-Al layered double hydroxides synthesized by microwave-crystallization method[J].Science in China Ser B Chemistry,2004,47(6):488-498.
[8] SONAWANE N D,SZOKA FC,VERKMAN A S.Chloride accumulation and swelling in endosomes enhances DNA transfer by polyamine-DNA polyplexes[J].J Biol Chem,2003,278(45):44826-44831.
[9] REJMAN J,OBERLE V,ZUHORN IS,et al.Size-dependent internalization of particles via the pathways of clathrin-and caveolae mediated endocytosis[J].Biochem J,2004,377(1):159-169.
[10] MAYOR S,PAGANO R E.Pathways of clathrin-independent endocytosis[J].Nat Rev Mol Cell Biol,2007,8(8):603-612.
