鹅副粘病毒YF株的分离鉴定与生物学特性研究
2013-10-09舒秀伟陈生雷刘艳霞苗玉和李学志
舒秀伟,陈生雷,周 丽,刘艳霞,苗玉和,李学志
(辽宁益康生物股份有限公司,辽宁辽阳 111000)
鹅副粘病毒病(Goose Paramyxovirus Disease)是由禽副粘病毒Ⅰ型引起的一种烈性、高度接触性、致死性传染病。自1997年由王永坤和辛朝安两位教授报道该病发生以来,国内许多地区先后发现该病的发生和流行[1]。本病以呼吸困难、肿头、流泪、喜卧、下痢、脾脏和胰腺肿大、散布大小不一坏死灶、消化道黏膜出血、溃疡、坏死、结痂为主要特征[2],各种年龄的鹅都可发生本病,雏鹅的发病率和死亡率最高可达100%,是危害我国养鹅业发展的重要传染性疾病。本实验室对2000年3月辽宁彰武某养鹅场采集的病死鹅的肝、脾、肺、脑等病料进行了病原分离与鉴定,并对分离毒的生物学特性进行研究。
1 材料与方法
1.1 材料
1.1.1 试验动物 SPF鸡和10日龄SPF鸡胚,由辽宁益康生物股份有限公司提供;非免疫鹅(HI≤1∶4)、鹅胚,由辽宁省畜牧科学研究院豁鹅原种场提供。
1.1.2 NDV 标准抗原和血清、AI(H9、H5)血清由辽宁益康生物股份有限公司研发中心提供。
1.1.3 康复鹅血清 由辽宁益康生物股份有限公司研发中心提供。
1.2 方法
1.2.1 病毒的分离 以无菌方法采取病死鹅的肝脏、脾脏、心血直接涂片,革兰氏染色后镜检。采集病死鹅的肝、脾、肺、脑组织进行研磨,加入双抗,将病料悬液4℃作用4 h后,尿囊腔接种10日龄SPF鸡胚(鸭胚),0.2 mL/枚,弃去24 h 内死亡鸡胚(鸭胚),将24~96 h死亡的鸡胚(鸭胚)置4℃过夜后无菌采集尿囊液,并观察鸡胚(鸭胚)病变情况,收集的尿囊液进行HA、HI测定。取尿囊液,送解放军军事医学科学院军事兽医研究所进行电镜观察。
1.2.2 病毒的血清学鉴定 将分离毒用灭菌生理盐水稀释至 105.0ELD50/0.1mL,分别与 10 倍稀释并经56℃30 min灭活的抗鹅副粘病毒高免血清、NDV阳性血清、AI(H9、H5)血清等量混合,在24~30℃中和1 h,尿囊腔内接种10日龄SPF鸡胚10枚,每胚0.2mL,置37℃观察120 h,对照组接种生理盐水。记录鸡胚死亡情况,活胚取尿囊液,测定HA效价。
1.2.3 毒力测定
1.2.3.1 ELD50测定 将鹅副粘病毒尿囊液进行10倍系列稀释,选定 3 个稀释度即 10-7、10-8、10-9,将每个稀释度分别接种5枚10日龄SPF鸡胚和5枚10日龄非免疫鹅胚(CAM接种,0.1 mL/枚),并设对照组接种生理盐水 0.1 mL/枚。37℃孵育120 h,弃去24 h内死亡的鸡胚,记录鸡胚死亡情况,用Reed-Muench法计算ELD50[3]。
1.2.3.2 最小致死量的平均致死时间(MDT)测定
用无菌生理盐水将新收获的含毒尿囊液做10倍系列稀释,取 10-7、10-8、10-93 个稀释度,分别接种10日龄SPF鸡胚和10日龄非免疫鹅胚,上午9点每个稀释度接种5个鸡胚或鹅胚,每胚尿囊内注射0.1 mL做记号A。下午3点每个稀释度分别接种5个鸡胚或鹅胚,做记号B。接种后,每日上午9点、下午3点,A、B组各照蛋1次,记录鸡胚或鹅胚死亡时间,计算最小致死量的平均死亡时间。并测定每胚血凝活性[4]。
1.2.3.3 脑内致病指数(ICPI)的测定 取1日龄SPF雏鸡10只和非免疫雏鹅(HI≤1∶4)10只,各脑内注射10-1稀释的新鲜含毒尿囊液0.05 mL。另取2只以同样方法注射稀释病毒用的生理盐水各0.05mL。接种后,每日在相应接种的时间观察,记录雏鸡和雏鹅的情况,观察8 d,计算正常、发病、死亡鸡或鹅的总数,根据不同的权值(正常为0,发病为 1,死亡为 2)累计总分数[4]。
其中,zi和zi′分别为像素i和i′的光谱测度;‖zi-zi′‖用以计算zi与zi′间的欧氏距离;σi为像素i的尺度参数.令zi={‖zi-zi″‖,i″Ni}且‖zi-zi″‖按增序排列,取σi=zi(#Ni / M),为取整操作符,#为计算集合所含元素总数操作符,M[2,6]为指定整数[22],控制σi的取值,可根据待分割影像选取不同的M值.
1.2.3.4 静脉致病指数(IVPI)的测定 取6周龄SPF鸡10只和非免疫鹅(HI≤1∶4)各10只,静脉接种10-1稀释的含毒尿囊液0.1 mL,另各取2只接种生理盐水作对照。每日在接种的相应时间观察、记录接种鸡或鹅情况,观察10 d后,累计正常、发病、麻痹和死亡动物数,根据不同权值(正常为0,发病为 1,麻痹为 2、死亡为3)累计总分数[4]。
1.2.4 动物回归试验 取10日龄鹅、30日龄SPF鸡各10只,取收集的鸡胚尿囊液,10倍稀释后每只肌肉注射0.1 mL。并各设5只空白对照。严格隔离饲养,观察接种后的发病和死亡情况,并从病死鹅和鸡中分离病毒。
1.2.5 分子生物学鉴定 根据国外发表的NDV的F基因序列设计一对引物,进行RT-PCR鉴定,预期目的片段大小1660 bp。引物序列如下:
上游引物P1:5’-AATATGGGCTCCAAACC-3’
下游引物P2:5’-ATGCTCTTGTGGTGGCT-3’
1.2.6 免疫原性测定 将鹅副粘病毒分离毒做10-4稀释,然后接种于10日龄SPF鸡胚,收获鸡胚尿囊液(HA≥27),经0.1%甲醛灭活后,与白油以1∶1.5的比例混合,制成油乳苗。用10日龄SPF鸡和5日龄非免疫鹅(HI≤1∶4)各20只(微量法,按《中国兽药典》进行),每只胸部肌肉注射灭活疫苗0.2 mL,21 d后连同对照鸡和鹅各10只,胸部肌肉注射105ELD50强毒,观察14 d。
2 结果
2.1 病毒的初步分离 以无菌方法采取病死鹅的肝脏、脾脏、心血直接涂片,革兰氏染色后镜检,未见致病菌。初次分离病毒时,病毒可直接适应鸭胚,但不能直接适应于鸡胚,需经一代或一代以上的鸭胚传代后才适应鸡胚。取适应鸡胚的病毒接种于10日龄的鸡胚尿囊腔,0.1 mL/枚,鸡胚于48~60 h全部死亡,鸡胚胚体出现的病变与鸭胚基本一致。死亡鸡胚病变均为全身表面点状弥漫性出血,胚体明显矮小,体表和内脏严重出血(图1)。取胚液进行微量法HA试验,结果表明收集的尿囊液能凝集鸡红细胞,凝集价(HA)在27~29之间。而且该凝集作用能被NDV阳性血清和康复鹅血清所抑制,抑制价(HI)为29和27。而禽流感阳性血清(H5、H9)则不能抑制分离毒凝集红细胞的作用。
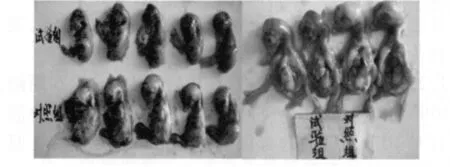
图1 接种后48 h死亡鸡胚病变
2.3 形态学观察结果 电镜下呈现典型的副粘病毒形态,大量大小不一的病毒粒子多数呈圆形,表面有密集的纤突结构,病毒粒子大小在50~200 nm之间。电镜照片见图2。

图2 鹅副粘病毒YF株电镜照片
2.4 血清学鉴定结果 NDV阳性血清和康复鹅血清能特异性中和分离毒,接种鸡胚未见死亡;而禽流感H9、H5标准血清中和组接种鸡胚则全部死亡,其尿囊液具有血凝性;生理盐水对照组则没有血凝性。
2.5 毒力测定结果 此毒株对鸡胚半数致死量可达 10-8.3/0.1mL,对鹅胚的半数致死量可达到10-8.7/0.1mL;对鸡胚最小致死量为 10-7稀释度,平均死亡时间为51.6 h,鹅胚最小致死量为10-7稀释度,平均死亡时间为68.6 h;对鸡的脑内致病指数(ICPI)为 1.75,鹅的脑内致病指数(ICPI)为1.70,对鸡的静脉致病指数(IVPI)为 1.68,鹅的静脉致病指数(IVPI)为1.72。
2.6 动物回归试验 将分离毒的鸡胚尿囊液10倍稀释后接种10日龄鹅、30日龄SPF鸡,接种后第2天和第3天全部发病,发病症状与病变与自然病例特征相似,至第14天观察结束时,均全部死亡。从病死的鹅和鸡中都分离到具有血凝性的病毒。
2.7 RT-PCR结果 以分离毒鸡胚尿囊液提取的总RNA为模版,进行RT-PCR扩增,产物经1%琼脂糖凝胶电泳,结果得到一条1.7 kb左右的特异性条带,与预期的扩增片段大小相符,见图3。说明分离毒是与NDV相关的副粘病毒。

图3 分离毒RT-PCR扩增结果
2.8 免疫原性测定 免疫鸡和鹅均100%保护,对照鸡100%死亡;对照鹅100%发病,80%死亡。结果表明该分离毒具有良好的免疫原性,可激发SPF鸡、非免疫鹅产生保护性抗体。
3 小结与讨论
3.1 本试验应用SPF鸡胚从发病鹅群中分离到一株病毒,经HA和HI试验、血清中和试验、电镜观察、动物回归试验、RT-PCR鉴定等确认为鹅源副粘病毒,并命名为YF株。该病毒具有血凝活性,能使SPF鸡胚、非免疫鸭胚、鹅胚100%死亡。一般认为,鹅可以感染副粘病毒,但感染后一般只带毒和排毒,不使鹅致病。但国内学者先后分离到了能使鹅发病和致死的同类病毒[5-8],本实验分离的病毒,通过人工感染SPF鸡和鹅,证实该分离株对鸡和鹅具有高度的致病性。
3.2 对分离株分别应用实验动物,SPF鸡和非免疫鹅(HI≤1∶4)进行了 MDT、ICPI和 IVPI等项生物学致病性测定,应用SPF鸡测定的结果,MDT为51.6h、ICPI为 1.75、IVPI为 1.68,应用非免疫鹅测定的结果,MDT 为 68.6h、ICPI为 1.70、IVPI为1.72,结果表明分离株对鹅的致病性指标与应用SPF鸡测定的指标具有一定的相关性。参照国际上规定的NDV毒力判定标准,该分离株为强毒,进一步证实所分离到的野毒属禽副粘病毒的成员,即鹅副粘病毒I型。
3.3 免疫原性试验表明,该病毒在实验动物鸡和鹅上都具有良好的免疫原性,并且具有很高的保护率。
[1] 左玉柱.鹅源副粘病毒病[J].山东家禽,2004,(4):27 -28.
[2] 钱 晨,张建军.鹅副粘病毒感染的诊断[J].安徽农业科学,2007,35(36):11837.
[3] 殷 震,刘景华.动物病毒学[M].第2版.北京:科学出版社,1997.
[4] 中华人民共和国农业部.中华人民共和国兽用生物制品质量标准[M].北京:中国农业出版社,2001:316-318.
[5] 辛朝安,任 涛,罗开健,等.疑似鹅副粘病毒感染诊断初报[J].养禽与禽病防治,1997,1:5.
[6] 周继宏,田慧芳,王永坤,等.鹅副粘病毒感染鸡试验[J].中国预防兽医学报,2000,22(1):3 -4.
[7] 周继宏,田慧芳,王永坤,等.鹅副粘病毒的人工感染试验[J].中国预防兽医学报,1999,21(1):51 -52.
[8] 黄淑坚,白挨泉.鹅副粘病毒病病原的分离及初步鉴定[J].中国兽医杂志,2000,26(3):20 -21.
