围产期克罗米酚处理改变雄性小鼠性取向
2013-09-21何凤琴张恒睿
何凤琴,张恒睿
1. 西安文理学院 生物技术学院,陕西 西安 710065
2. 中南大学 交通运输学院,湖南 长沙 410012
生殖季节,雌、雄哺乳动物通常会寻求与异性同种交配,但同时也存在对同性产生兴趣的个体。研究发现性取向和性行为与大脑发育关键时期类固醇激素控制神经发育的机制有关(Bakker,2003)。激素作用导致非人灵长类和啮齿类大脑发育出现性差的最大敏感时期为围产期,即产前及产后一周(Viemari et al,2003;Baum,1979;Wallen,2005)。该阶段,性激素对脑结构及功能产生不可逆影响,较高浓度雌激素产生雄性化的脑,使个体成年后出现雄性化性行为,如较多的爬跨、插入及攻击行为等,且性取向为雌性,而较低浓度雌激素则产生雌性化的脑,个体成年后出现雌性化接受性性行为,如脊柱前凸等,且性取向为雄性(Cohen-Bendahan et al,2005)。例如,有研究显示,若雌性大鼠在大脑发育期暴露于高浓度类固醇激素或激素代谢物,则成体不仅缺乏脊柱前凸行为(Barraclough &Gorski,1961),且产生同性取向(Henley et al,2009)。同样,雌性小鼠若产前暴露于雌激素,成年时则将显示完全去雌性化,脊柱前凸行为减少,但性取向不明确(Brock & Bakker,2011)。
在脑性二型分化的分子机制研究中,克罗米酚(clomiphene citrate)作为雌激素受体阻断剂(Giannakopoulou et al,2001),可抑制雌激素活性。新生雄性大鼠经克罗米酚处理后,其成年个体的生殖生理和性行为将受到长期影响(Pereira et al,2003)。但克罗米酚与雄性动物性取向间的关系尚未见报道。此外,除围产期外,青春期也是性激素影响神经发育的关键时期,该时期性激素对神经结构的影响建立于发育早期性激素对大脑性差的影响。在青春期发育阶段被阉割或给予抗雄激素处理的雄性将显示比其他雄性更加典型的雌性化行为,如较少的少年时期野蛮行为、较多的成年期脊柱前凸行为及减少的攻击行为等(Cohen-Bendahan et al,2005),但其对性取向的影响目前尚不明确,需借助于同性取向模型进行研究。
1 材料与方法
1.1 实验对象
性成熟健康雌、雄昆明小鼠各40只(体重20~23 g),购于西安交大医学院,饲养于西安文理学院生物技术学院鼠房。室温24~26 ℃,自然光照(12L:12D),饲养箱(40×30×20 cm)以锯木作底物,饲喂常规鼠饲料。
1.2 实验过程
1.2.1 围产期药物处理
雌、雄小鼠合笼3 d后,检查雌鼠阴道是否出现阴道栓(表明动物处于动情期并发生过交配行为),从第四天起计算怀孕天数(He et al,2008),鼠类一般怀孕21 d,即从合笼到分娩共25 d。根据皮下注射药物时长将实验动物分为4组,第一、二组分别于分娩当天对雄性幼鼠连续注射药物3 d和6 d,第三、四组首先对孕鼠分别注射药物3 d和6 d,以期通过胎盘血液循环将所注射药物作用于胎儿,待分娩后再分别对雄性幼鼠连续注射药物6 d和7 d,即第三、四组药物处理时间分别为9 d和14 d。每一组根据所注射药物的不同又分为对照组(注射芝麻油,MC,n=10),克罗米酚-芝麻油混合组(MT1,n=10)(clomiphene citrate,C 6272-1G,Sigma,2 mg/kg),及雌二醇组(MT2,n=10)(β-Estradiol,E 2758-250MG,Sigma,5 mg/kg)。第三、四组中每小组孕鼠的药物注射剂量均为1 mL/次,每组新生小鼠的药物注射剂量均为0.3 mL/次。观察各组3月龄后代的性取向行为。
1.2.2 青春期阉割处理
九只孕鼠不作药物处理,自然分娩,对21日龄雄性F1代进行阉割并与亲代分离。阉割F1代分为对照组(假手术组,n=10)和实验组(去除睾丸组,n=10)。观察3月龄F1代的性取向行为。
1.3 实验刺激
雄性刺激鼠为双侧睾丸下降,雌性刺激鼠通过皮下注射雌二醇苯甲酸(0.00075 mg/g,实验前24 h)和孕激素(0.015 mg/g,实验前4~6 h)进入发情期(He et al,2008),取少量雌性阴道分泌物制成涂片,硫堇染色,通过显微镜观察确定个体是否进入动情期。若阴道涂片中大多数细胞为无核角化细胞或存在少量上皮细胞,则认为个体处于动情期,反之,则未进入动情期(He & Tai,2009;Meek et al,2006)。仅选择处于动情期的雌性作为刺激鼠。雌、雄性刺激鼠被放置于不同的鼠箱,且实验动物实验前从未接触过刺激鼠的任何气味。每个实验动物均设置相对应的刺激鼠,即刺激鼠无重复使用。

表1 雌性亲代和雄性子代的药物注射分组Table 1 Grouping of female parents and male of fspring under treatments
1.4 行为观察
性取向实验装置为一个三室的”Y”字形有机玻璃装置,各室(30 cm×61 cm×41 cm)内壁均设置开口,允许实验鼠在三室间自由活动。雌、雄性刺激鼠分别置于两个外室,中间室不设置刺激动物。用线绳在刺激鼠颈部打结,并将其活动限制于外室,以防止刺激鼠主动接近实验鼠或相互接近。将实验鼠放入中间室适应5 min,于08:00—10:00进行行为测试。
实验鼠的性取向实验行为发生过程(20 min)被数码相机(Panasonic NV-GS15EG)记录,包括接近、嗅闻、抱团、脊柱前弯、爬胯与交配等性取向行为及性行为,同时,包括静止、看、爬墙、移动及咬绳子等非社会行为。用 Noldus Observe 9.0(Noldus Information Tech nology,Wageningen,Netherlands)分析行为持续时间。
各实验鼠测试完成后,用肥皂、水及70%乙醇洗涤整个实验装置。
1.5 数据处理
用配对t-检验(paired t test)检测同一小组内实验雄鼠在“Y”字形装置中的性取向行为和性行为数据,用单因素(one-way factorial analysis of variance)和Post Hoc 检验(Post Hoc tests)分析不同处理小组之间各种行为的差异性。所有数据用mean±SE表示,P<0.05为显著性差异。统计分析采用SPSS10.0(SPSS Inc.,Chicago,USA)。
2 结果
2.1 围产期药物对雄性鼠性取向行为的影响
注射药物 3 d(t9=2.562,P=0.027)、6 d(t9=2.661,P=0.025)、9 d(t9=2.862,P=0.021)和 14 d(t9=4.862,P=0.001)雄鼠的性取向选择行为显示,对照组取向雌、雄的时间不同,但都明显取向雌性。其他两组雄鼠的性取向在注射药物 3 d(clomiphene:t9=1.490,P=0.174;Estradiol:t9=1.612,P=0.115)和 6 d(clomiphene:t9=1.590,P=0.164;Estradiol:t9=1.722,P=0.095)时无明显差异,注射克罗米酚9 d(t9=2.933,P=0.012)及 14 d(t9=3.936,P=0.008)的雄鼠均明显取向雄鼠,而注射雌二醇 9 d(t9=2.543,P=0.031)和 14 d(t9=4.377,P=0.007)的 雄鼠则明显取向雌鼠。
注射药物3 d和6 d,三组动物在性取向雌(3 d:F(2,27)=1.554,P=0.083;6 d:F(2,27)=1.704,P=0.072)、雄(3 d:F(2,27)=1.354,P=0.091;6 d:F(2,27)=1.854,P=0.066)及非社会行为(3 d:F(2,27)=1.654,P=0.073;6 d:F(2,27)=1.774,P=0.069)等方面均无明显差异(图1)。
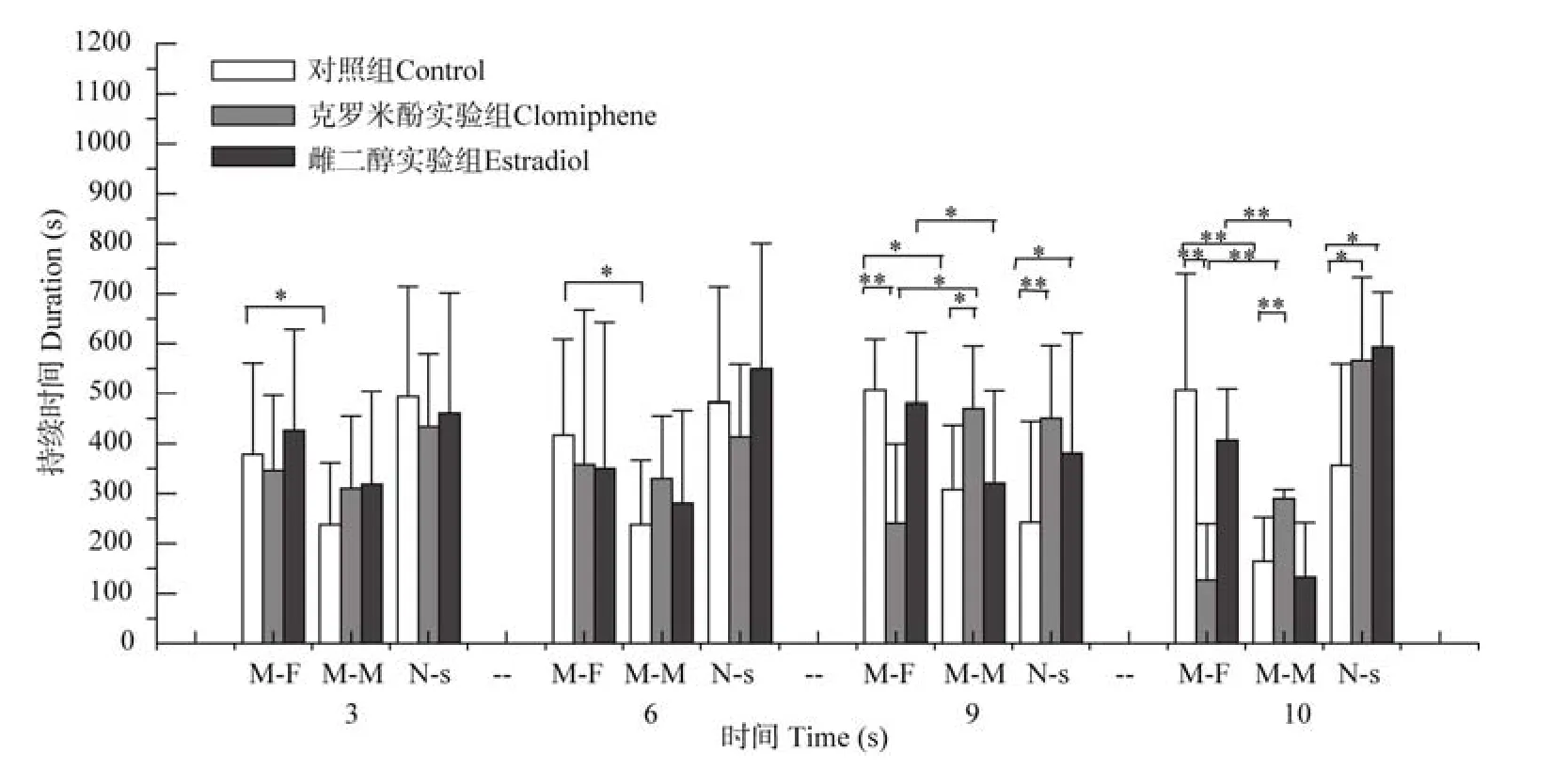
图1 分别注射药物3、6、9、14 d的雄鼠行为Figure 1 Behavior of male mice under 3,6,9,14 days’ drug treatment
与对照组相比,注射9 d和14 d克罗米酚的雄鼠取向雌鼠的时间明显减少(9 d:F(2,27)=4.245,P=0.008;14 d:F(2,27)=5.245,P=0.001),取向雄鼠的时间明显增多(9 d:F(2,27)=3.245,P=0.032;14 d:F(2,27)=3.045,P=0.043),而注射 9 d和 14 d雌二醇的雄鼠取向雌(9 d:P=0.124;14 d:P=0.064)或雄鼠(9 d:P=0.087;14 d:P=0.107)的时间与对照组之间均无显著性差异,且注射克罗米酚雄鼠(9 d:P=0.005;14 d:P=0.035)和注射雌二醇(9 d:P=0.045;14 d:P=0.015)雄鼠的非社会行为均明显多于对照组(图1)。
2.2 阉割对性取向行为的影响
阉割后,假手术组明显性取向雌性(t9=3.852,P=0.009),而阉割后的雄性鼠虽然对雌鼠的性取向明显减少(F(1,18)=3.983,P=0.011),但其对雌、雄的性取向仍不明显(t9=1.852,P=0.072),且非社会行为明显增多(F(1,18)=3.083,P=0.042)(图 2)。
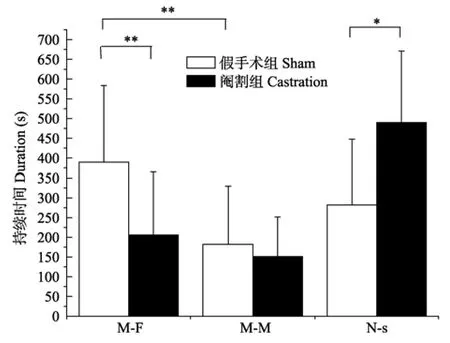
图2 阉割后的雄鼠行为Figure 2 Behavior of the castrated male mice
3 讨论
3.1 围产期雌激素阻断剂处理改变雄性小鼠性取向
以上各组动物的行为显示,早期雌激素拮抗剂——克罗米酚处理后,成年雄性动物性取向于雄性刺激鼠。与对照组相比,产后注射克罗米酚3 d及6 d时,雄鼠性取向于雄鼠的行为增多,到第9天出现明显差异,到第 14天出现极显著性差异。可见,围产期雌激素拮抗剂不仅影响成年雄鼠的性取向行为,且该影响随天数的增多而增大。雌激素拮抗剂及雌激素与ERα竞争性结合,影响雄性化大脑结构的形成并形成雌性化的大脑(Cushing et al,2008),进而影响个体成年后的性取向行为。围产期克罗米酚处理、脑区ERα数量减少以及个体成年后出现的同性取向行为之间的联系是我们今后的研究内容。
虽然,围产期(产前7 d和产后7 d)是影响个体大脑发育的关键时期,但在我们的实验中产前3 d到产后的6 d注射雌激素拮抗剂已对成年雄鼠的性取向造成了影响,表明在这9 d中激素的作用已影响了脑结构的发育,并进而影响成年个体的行为。由此,我们推断激素影响大脑的发育由雄性化到雌性化是逐步形成的,是量变到质变的过程。因此,具有雄性性取向和雌性化性行为的雄性个体与早期暴露于低浓度的性激素水平有关。这一研究结果也与其他研究者的结果一致,围产期脑内雌激素较少的雄性大鼠产生雌性化的大脑结构,使成年期的雄鼠产生雌性化行为,即容易导致成年期的雄鼠产生性取向雄鼠的行为(Cohen-Bendahan et al,2005)。
在脑的发育过程中,雌激素无疑能效仿雄激素的某些作用,并影响促性腺激素的周期性分泌和性行为等。对出生后几天的雌性大鼠幼体注射雌激素,当其成年时,促性腺激素的周期性分泌将受到抑制,并丧失周期性卵巢活动,同时,雌激素对促性腺激素分泌应有的正反馈性刺激作用也将消失(Garzo et al,1988),即性行为不但去雌而且雄性化。性激素通过两种方式作用于脑神经元:(1)间接作用,即通过与脑内特定部位的细胞内受体相结合形成复合物,经核转位,与基因上特异的激素反应元件结合,影响特定基因表达及蛋白质合成;(2)直接作用,即通过改变某些脑区神经元的膜通透性,影响神经递质的释放、摄取、灭活、合成以及突触后膜受体的敏感性,性激素与多种神经递质之间相互作用,形成特殊的神经内分泌效应,从而影响脑的性分化及个体的性取向(McCarthy & Arnold,2011)。另外,大脑发育的关键时期是围产期,是否仅产前克罗米酚处理,即可改变成年个体的性取向行为,这是我们下一步需要进一步验证的。
与对照组相比,注射雌二醇3 d的雄鼠性取向于雌鼠略微增多,注射6、9、14 d的雄鼠性取向于雌鼠略微减少,而注射3、6、9 d的雄鼠性取向于雄鼠略微增多,注射14 d的雄鼠性取向于雄鼠略微减少。由此可见,围产期雄鼠的外来雌激素水平上升与个体成年后的性取向无紧密联系,并不能使得雄鼠更加雄性化或增加其雌性化行为,而个体性取向略倾向于雌性或雄性可能仅为个体差异。早期雌激素暴露对雄性大脑发育的影响,并不影响成年个体的性取向行为,表明超过生理水平的雌激素并不能使得雄性更加取向雌性或提高雄性的性行为,而可能反而起到相反的作用。研究发现,雌激素处理后的新生个体,其成年时睾丸产生的睾酮减少(Delbès et al,2007)。这可能是由于早期雌激素暴露将直接抑制有关酶的产生,从而抑制睾酮的产生(Goyal et al,2003;2004),并进而影响雄性化的性行为(Sakuma,2008)。
围产期注射雌激素或雌激素拮抗剂所引起的体内激素水平或功能异常均可影响雄鼠的非社会行为。与对照组相比,注射药物第3天、第6天时,雄鼠的非社会行为无明显变化,第9天、第14天时,非社会行为显著增多。这可能是由于药物作用时间过长,动物个体之间的交流减少等,目前还不明确。
3.2 阉割对个体性行为的影响
行为实验中,假手术雄性小鼠明显性取向雌性,而青春期(生育后21 d)阉割小鼠成年后的性取向无明显差异,这可能与阉割后激素未影响大脑发育有关。激素对人和动物的影响表现在组织结构及活性作用两方面。对组织结构的影响很可能发生在大多数神经结构建立时的早期发育中,即围产期,对脑的神经环路和敏感性将产生永久影响。青春期大脑结构进一步发育完善,成年后,青春期激素和大脑的相互作用将影响个体对社会刺激的神经反应及其社会行为的表达(Sisk & Zehr,2005;Cohen-Bendahan et al,2005)。对活性作用的影响伴随循环水平激素的变化而变化,雄激素增加雄性化行为,雌激素增加雌性化行为(He & Tai,2009)。青春期前、后被阉割的雄性仓鼠,六个星期后,经过长达17 d的睾酮处理后暴露于三个雌性个体,青春期前被阉割雄性的爬跨、插入和射精行为等明显少于青春期后阉割的雄性。因此,青春期的大脑发育期间若缺乏性激素,即使在成年后用雄激素处理,个体仍不能显示雄性化的行为。相反,青春期的大脑发育期间的性激素刺激可提高成年时期雄激素诱导的生殖行为,即提高雄性化行为(Sisk &Zehr,2005)。除与性行为的关系外,青春期前暴露于性激素也会影响个体的性取向。Vega Matuszczyk et al(1997)发现,出生后第10天被阉割的雄性大鼠在成年后将缺乏对雌性伙伴的偏好。Brand & Slob(1988)发现,在 21日龄被阉割的雄性大鼠,即使于成年时期用雄激素处理,仍不能没有影响其性取向。本实验于生育后21 d阉割雄性大鼠,个体成年后既不明显取向雄性,亦不明显取向雌性,这可能与个体成年后未使用激素处理有关。循环激素水平可提高探究行为的动力,即提高性动机(Bonilla-Jaime et al,2006;Nyby,2008),若缺乏性动机,即可能出现以上现象。本实验中,阉割后的雄性大鼠的非社会行为较假手术鼠明显延长,该现象的可能原因是由于阉割导致个体体内激素水平下降,进而导致社会行为动机减少(He & Tai,2009)。
Bakker J. 2003. Sexual differentiation of the neuroendocrine mechanisms regulating mate recognition in mammals. Journal of Neuroendocrinology,15(6):615-621.
Barraclough CA,Gorski RA. 1961. Evidence that the hypothalamus is responsible for androgen-induced sterility in the female rat. Endocrinology,68(1):68-79.
Baum MJ. 1979. Differentiation of coital behavior in mammals:a comparative analysis. Neuroscience & Biobehavioral Reviews,3(4):265-284.
Bonilla-Jaime H, Vázquez-Palacios G,Arteaga-Silva M,Retana-Márquez S. 2006. Hormonal responses to different sexually related conditions in male rats. Hormone Behavior,49(3):376-382.
Brand T,Slob AK. 1988. Peripubertal castration of male rats,adult open field ambulation and partner preference behavior. Behavior Brain Research,30(2):111-117. Brock O,Bakker J. 2011. Potential contribution of prenatal estrogens to the sexual differentiation of mate preferences in mice. Hormone Behavior,59(1):83-89.
Cohen-Bendahan CC,van de Beek C,Berenbaum SA. 2005. Prenatal sex hormone effects on child and adult sex-typed behavior:methods and findings. Neuroscience & Biobehavioral Reviews,29(2):353-384.
Cushing BS,Perry A,Musatov S,Ogawa S,Papademetriou E. 2008.Estrogen receptors in the medial amygdala inhibit the expression of male prosocial behavior. The Journal of Neuroscience,28(41):10399-10403.
Delbès G,Duquenne C,Szenker J,Taccoen J,Habert R,Levacher C. 2007.Developmental changes in testicular sensitivity to estrogens throughout fetal and neonatal life. Toxicological Sciences,99(1):234-243.
He FQ,Tai FD. 2009. Mating behavior induces changes of expression of Fos protein,plasma testosterone and androgen receptors in the accessory olfactory bulb (AOB) of the male mandarin vole Microtus mandarinus.Current Zoology,55(4):288-295.
He FQ,Zhang JW,Shi J,Wang B. 2008. Changes of estrogen in serum and estrogen receptor β in the relevant brain regions following mating behavior of the male mandarin vole Microtus mandarinus. Zoological Research,29(5):529-536.
Henley CL,Nunez AA,Clemens LG. 2009. Estrogen treatment during development alters adult partner preference and reproductive behavior in female laboratory rats. Hormones and Behavior,55(1):68-75.
Garzo VG,Liu J,Ulmann A,Baulieu E,Yen SS. 1988. Effects of an antiprogesterone(RU486)on the hypothalamic-hypophyseal-ovarianendometrial axis during the luteal phase of the menstrual cycle. Journal of Clinical Endocrinology & Metabolism,66(3):508-517.
Giannakopoulou M,Bozas E,Philippidis H,Stylianopoulou F. 2001.Protooncogene c-fos involvement in the molecular mechanism of rat brain sexual differentiation. Neuroendocrinology,73(6):387-396.
Goyal HO,Braden TD,Williams CS,Dalvi P,Williams JW,Srivastava KK. 2004. Exposure of neonatal male rats to estrogen induces abnormal morphology of the penis and loss of fertility. Reproductive Toxicology,18(2):265-274.
Goyal HO,Robateau A,Braden TD,Williams CS,Srivastava KK,Ali K.2003. Neonatal estrogen exposure of male rats alters reproductive functions at adulthood. Biology of Reproduction,68(6):2081-2091.
McCarthy MM,Arnold AP. 2011. Reframing sexual differentiation of the brain. Nature Neuroscience,14(6):677-683.
Meek LR,Schulz KM,Keith CA. 2006. Effects of prenatal stress on sexual partner preference in mice. Physiology & Behavior,89(2):133-138.
Nyby JG. 2008. Reflexive testosterone release:a model system for studying the nongenomic effects of testosterone upon male behavior. Frontiers in Neuroendocrinology,29(2):199-210.
Pereira OCM,Coneglian-Marise MSP,Gerardin DCC. 2003. Effects of neonatal clomiphene citrate on fertility and sexual behavior in male rats.Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,134(3):545-550.
Sakuma Y. 2008. Neural substrates for sexual preference and motivation in the female and male rat. Annals of the New York Academy of Sciences,1129:55-60.
Sisk CL,Zehr JL. 2005. Pubertal hormones organize the adolescent brain and behavior. Frontiers in Neuroendocrinology,26(3-4):163-174.
Vega Matuszczyk J,Appa RS,Larsson K. 1997. Postnatal testicular secretions partially restore the disturbances in reproductive activity caused by prenatal hormonal manipulation. Physiology & Behavior,62(1):137-143.Viemari JC,Burnet H,Bévengut M,Hilaire G. 2003. Perinatal maturation of the mouse respiratory rhythm-generator: in vivo and in vitro studies.European Journal of Neuroscience,17(6):1233-1244.
Wallen K. 2005. Hormonal influences on sexually differentiated behavior in nonhuman primates.Frontiers in Neuroendocrinology,26(1):7-26.
