丙泊酚对大鼠肝缺血再灌注致急性肺损伤时Nrf2和HO-1表达的影响
2013-09-18高伟忠重庆医科大学附属大学城医院手术麻醉科重庆4033
张 殷 高伟忠 但 伶 (重庆医科大学附属大学城医院手术麻醉科,重庆 4033)
急性肺损伤(ALI)作为急性呼吸窘迫综合征(ARDS)的早期阶段越来越受到临床医师的广泛重视,它可产生于肝病及肠道病变、多发创伤、脓毒症等多种原因。肝缺血再灌注(IR)是创伤性休克、肝脏外科临床中常见的病理生理过程,IR不仅会导致肝脏损伤,还可导致远隔脏器的损伤及功能下降,其中肺脏是最容易受累的脏器之一〔1〕。核因子E2相关因子(Nrf2)通过与抗氧化反应元件(ARE)相互作用调节编码抗氧化蛋白,是内源性抗氧化应激的核心通路〔2〕。研究表明,静脉麻醉药丙泊酚可影响多种细胞因子和炎症反应通路,具有抗氧自由基、抗脂质过氧化反应的功能〔3〕及减轻炎症反应的作用〔4〕。丙泊酚能减轻肝IR对肺的损伤作用〔5〕,但其对肝IR所致ALI时转录因子红细胞系相关因子-抗氧化反应元件(Nrf2-ARE)通路的影响未见相关报道。本实验通过观察丙泊酚对Nrf2、血红素加氧酶-1(HO-1)蛋白表达的影响,进一步探讨丙泊酚对肝IR损伤所致ALI保护的机制。
1 材料与方法
1.1 材料
1.1.1 动物 健康SD大鼠24只购于重庆医科大学动物实验中心,雌雄不限,体重220~250 g。
1.1.2 主要试剂 丙泊酚(批号:JH714,公司:AstraZeneca),兔抗大鼠Nrf2、兔抗大鼠HO-1多克隆抗体和辣根酶标记山羊抗兔IgG购于北京博奥森生物技术有限公司,链霉亲合素-生物素复合物(SABC)免疫组化试剂盒和二氨基联苯胺(DAB)显色试剂盒购于武汉博士德公司。
1.2 方法
1.2.1 动物模型制备和分组 动物被随机分为三组(n=8):假手术组(SH组)、肝IR致ALI组(IR组)和丙泊酚组(P组)。大鼠术前禁食12 h,水合氯醛3 ml/kg经腹腔注射麻醉,参照Pringle法〔6〕建立肝IR模型:正中剖腹,用无创血管夹将肝动脉、门静脉及胆管一并夹闭,阻断肝门30 min,开放再灌注180 min。SH组仅暴露但不结扎;P组于阻断肝门前经尾静脉注射丙泊酚20 mg/kg,20 mg·kg-1·h-1静脉维持至处死。
1.2.2 标本采集及肺湿干重比(W/D)计算 模型制备成功后处死实验动物,取右上肺叶称湿重,置于80℃烘箱中48 h烘烤至恒重,取出后称干重,计算肺W/D。
1.2.3 免疫组化法检测肺组织Nrf2,HO-1蛋白表达及病理学观察 取右肺中叶置于4%多聚甲醛中固定,石蜡包埋,采用免疫组织化学检测Nrf2,HO-1的表达。石蜡切片常规脱蜡、水化,滴加0.3%H2O2,室温静置10 min以灭活内源性过氧化物酶,水洗2 min,进行高温水浴行抗原修复,山羊血清室温封闭30 min,滴加兔抗大鼠Nrf2和兔抗大鼠HO-1多克隆抗体(一抗,1∶100)于4℃过夜,37℃水浴复温30 min,滴加生物素化山羊抗兔过氧化物酶标记二抗(1∶200)37℃孵育30 min,加入SABC复合物37℃孵育30 min,DAB显色剂显色5~10 min后苏木素染核5~10 min,水洗,分化,蓝化,透明,封片,阴性对照以磷酸盐缓冲液(PBS)代替一抗。光镜下观察并拍照,染成棕色的细胞为阳性细胞。在400倍视野下计数5个不重复视野,得出5个视野的平均数。100倍光学显微镜下观察肺组织病理学结果。
1.2.4 Western印迹行肺组织Nrf2,HO-1蛋白检测 肺组织秤质量,用液氮研磨至粉末,加蛋白裂解液30 min,冰浴匀浆,4℃ 15 000 r/min离心15 min,取上清,Bradford法蛋白定量,置于-80℃冰箱保存备用。20 μg蛋白样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),电转膜至聚偏二氟乙烯(PVDF)膜,一抗(Nrf2 1∶100,HO-1 1∶100)4℃封闭过夜;Tris缓冲盐冲洗膜5 min,3次,加入辣根过氧化物酶标记二抗IgG(1∶2 000),室温下孵育1 h,Tris缓冲盐洗膜5 min,3次。以β-肌动蛋白(β-actin)为内参。化学发光试剂显影,暗室曝光冲片,胶片经凝胶成像分析系统扫描、成像,测定单位光密度,并将各组Nrf2、HO-1密度值分别与β-actin密度值的比值作为相对表达量。
1.3 统计学方法 应用SPSS17.0统计学软件,数据以±s表示,组间比较采用单因素方差分析,两两比较采用LSD-t检验。
2 结果
2.1 Western印迹表达及肺W/D 与SH组比较,IR组和P组Nrf2和HO-1蛋白表达水平及肺W/D升高(P<0.05);与IR组比较,P组Nrf2、HO-1表达水平升高(P<0.05),肺W/D降低(P<0.05)。见表1,图1。
表1 各组肺W/D、Nrf2、HO-1表达水平比较(n=8,±s)

表1 各组肺W/D、Nrf2、HO-1表达水平比较(n=8,±s)
组别 HO-1 NRF2 肺W/D SH组0.01±0.007 0.34±0.11 4.09±0.14 IR组 0.39±0.09 0.61±0.06 4.83±0.18 P组0.58±0.13 0.89±0.14 4.39±0.27

图1 Western印迹检测结果
2.2 免疫组化法检测 各组Nrf2、HO-1表达水平 三组、Nrf2、HO-1表达水平有统计学差异(P<0.05)。见图2。
2.3 病理学变化 SH组肺组织结构正常,IR组肺泡壁破坏严重,肺毛细血管明显扩张、充血,肺间质水肿,肺泡间隔增宽;P组肺泡间隔增宽,组织损伤较IR组明显减轻。见图3。
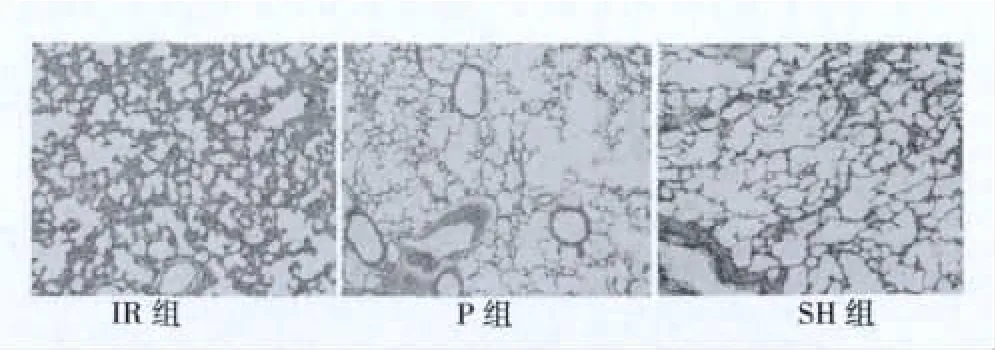
图3 各组病理学比较(HE,×100)
3 讨论
本实验参照 Pringle法,通过肝缺血 30 min,再灌注180 min,建立大鼠肝IR后ALI模型,实验结果表明,IR组大鼠肺W/D较SH组明显升高,病理学显示IR组肺组织结构明显出现破坏,提示肝IR后ALI模型制备成功。
肝IR损伤是由缺血的直接损伤及钙离子超载、中性粒细胞活化引发“呼吸爆发”,产生大量自由基和促炎症细胞因子〔白细胞介素-1和肿瘤坏死因子(TNF)-α等〕、内皮细胞等多种因素介导的多脏器功能受损的复杂病理生理过程。其中释放的自由基和促炎症细胞因子随血液循环到达全身各个组织器官造成组织损伤和血管通透性增加,引起全身炎症反应。肺组织作为受损的靶器官之一,表现为间质增生、中性粒细胞浸润、肺泡腔内各种炎性因子的释放,进而造成肺功能的严重受损。目前认为氧自由基及其引发的脂质过氧化反应是肝IR后ALI的主要机制。
HO-1又称热休克蛋白32(Hsp32),是一种限速酶,存在于多个器官与组织中,正常情况下表达较少,而在热休克、IR、缺氧等因素诱导下表达明显增加。HO-1可催化血红素生成一氧化碳(CO)、胆绿素和铁离子,在抗氧化应激、抗炎、抑制细胞凋亡等方面发挥重要作用〔7〕;同时有研究表明,HO-1的保护作用还可能与减轻脂质过氧化反应,降低半胱氨酸蛋白酶(Caspase-3)活性以对抗细胞凋亡和TNF-α水平有关。本实验结果提示丙泊酚能诱导HO-1在IR损伤中的表达增加。丙泊酚诱导HO-1表达的增加可能与Nrf2-ARE激活HO-1有关〔8〕。
近年来的研究表明,Nrf2-ARE相互作用调节编码抗氧化蛋白,是内源性抗氧化应激的核心通路。生理状态下,Nrf2在细胞质中与它的抑制蛋白果蝇肌动蛋白结合蛋白(Kelch)结合,并通过Keap1蛋白将其锚定于由激动蛋白构成的细胞骨架上,从而无法进入细胞核发挥转录活性〔9〕。而Nrf2-ARE的激活是通过非激酶依赖性途径和激酶依赖性途径来实现的。非激酶依赖性途径包括亲核物质、氧化应激反应中产生的活性氧(ROS)〔10〕等,激酶依赖性途径包括磷脂酰肌醇-3激酶(PI3K)途径〔11〕等。本实验结果提示IR组Nrf2蛋白含量明显高于SH组,可能与Nrf2的非激酶依赖性途径被激活有关。丙泊酚可活化PI3K/蛋白质丝氨酸苏氨酸激酶(PI3K/AKT)信号通路〔12〕,使PI3K表达上升,提示丙泊酚参与了Nrf2的激活,而该通路的激活与Nrf2的激酶依赖性途径有关。Okouchi等〔13〕发现胰岛素可以通过激活PI3K/AKT信号通路促进Nrf2的核转移和诱导靶基因的表达,与本实验结合相符。激活的Nrf2发挥转录活性,与ARE相互作用,启动下游编码抗氧化蛋白如HO-1,使HO-1表达上升,与本实验结果相符。
综上所述,丙泊酚预先给药可通过活化Nrf2-ARE信号通路,提高HO-1表达水平,从而减轻肝脏IR诱发大鼠的ALI。
1 Miranda LE,Capellini VK,Reis GS,et al.Effects of partial liver ischemia followed by global liver reperfusion on the remote tissue expression of nitric oxide synthase:lungs and kidneys〔J〕.Transplant Proc,2010;42(5):1557-62.
2 Yu X,Kensler T.Nrf2 as a target for cancer chemoprevention〔J〕.Mutat Res,2005;591(1-2):93-102.
3 Arslan M,Comu FM,Isik B,et al.Effects of the general anaesthetic agent,propofol,on erythrocyte deformability〔J〕.Bratisl Lek Listy,2010;111(3):126-8.
4 Nugroho AK,Romeljn SG,Zwier R,et al.Pharmacokinetics and pharmacodynamics analysis of transdermal iontophoresis of 5-OH-DPAT in rats:in vitro-in vivo correlation〔J〕.J Pharm Sci,2006;95(7):1570-85.
5 盖毅文,来柄祺,成少利,等.丙泊酚对大鼠肝缺血再灌注后肺组织损伤保护作用〔J〕. 现代肿瘤学,2009;17(11),2068-70.
6 Pannen BH,Al-Adili F,Bauer M,et al.Role of endothelins and nitric oxide in hepatic reperfusion injury in the rat〔J〕.Hepatology,1998;27(3):755-64.
7 李 航,段惠军.Nrf2/ARE信号通路及其调控的抗氧化蛋白〔J〕.中国药理学通报,2011;27(3):300-3.
8 邵建林,周银燕,陈华梅,等.七氟烷通过P70S6K/Nrf2信号通路诱导神经元HO-1mRNA表达〔J〕.中国药理学通报,2009;25(2):209-12.
9 Kobayashi A,Kang MI,Watai Y,et al.Oxidative and electrophilic stresses activate Nrf2 through inhibition of ubiquitination activity of Keap1〔J〕.Mol Cell Biol,2006;26(1):221-9.
10 Dietz BM,Liu D,Hagos GK,et al.Angelica sinensis and its alkylphthalides induce the detoxification enzyme NAD(P)H:quinone oxidoreductase 1 by alkylating Keap1〔J〕.Chem Res Toxicol,2008;21(10):1939-48.
11 江 刚,戴爱国,胡瑞成.Nrf2调控γ-谷氨酰半胱氨酸合成酶表达与慢性阻塞性肺疾病〔J〕.国际呼吸杂志,2007;27(4):265-9.
12 赵琳琳,李俊芳,朱珊珊,等.丙泊酚预处理通过活化PI3K/Akt通路减轻脂多糖诱导的大鼠急性肺损伤〔J〕.徐州医学院学报,2012;32(1):1-5.
13 Okouchi M,Okayama N,Alexander JS,et al.NRF2-dependent glutamate-L-cysteine ligase catalytic subunit expression mediates insulin protection against hyerglycemia-induced brain endothelial cell apoptosis〔J〕.Curr Neurovasc Res,2006;3(4):249-61.
