替米沙坦对糖尿病大鼠肾脏表达E-选择素的影响
2013-09-11邵凤明河南省人民医院肾内科河南郑州450003
马 旭 邵凤明 (河南省人民医院肾内科,河南 郑州 450003)
糖尿病肾病(DN)是糖尿病(DM)最为严重的慢性微血管并发症之一,严重影响患者的生活质量和威胁患者的生命,但其发病机制尚未完全清楚。研究提示,E-selectin介导的炎症反应参与了DN发生发展,能增加尿蛋白,促进细胞外基质的沉积,引起肾小球纤维化〔1,2〕。有学者观察血管紧张素受体Ⅱ(AngⅡ)拮抗剂(ARB)通过抑制黏附分子合成而减轻肾小球炎症〔3〕。本文旨在观察替米沙坦对DM大鼠肾小球E-selectin表达的影响,从黏附分子角度探讨替米沙坦对DN保护机制。
1 材料与方法
1.1 材料:全自动生化分析仪(美国Beckman公司,CX5CE);HIMAS-2000图像分析系统(湖北千屏影像有限公司);STZ(美国Sigma公司,批号:BF1003);替米沙坦(德国勃林格殷格翰制药有限公司);SP试剂盒(北京中山公司,);山羊抗大鼠ICAM-1和山羊抗大鼠VCAM-1抗体(Santa Cruz公司);Trizol试剂盒(美国GIBCO公司)。健康SD大鼠30只,雄性,体重(180±20)g(郑州大学医学院实验动物中心提供)。
1.2 方法
1.2.1 动物模型的建立与分组 健康雄性SD大鼠,于左肾切除后1 w,大鼠禁食10 h后,单次腹腔注射50 mg/kg链脲质毒素(STZ),用0.1 mol/lL无菌柠檬酸缓冲液配制,pH4.5)。72 h后取尾静脉血测血糖,尿糖试纸测尿糖。血糖≥16.7 mmol/L,尿糖(3+~4+)者选入DM大鼠模型〔2〕。正常对照组仅注射等量的柠檬酸缓冲液。DM大鼠随机分成DM组10只;替米沙坦组R组10只;正常对照组C组替米沙坦10只。各组以替米沙坦5 mg·kg-1·d-1ig给药;其他两组每天同体积生理盐水灌胃。所有大鼠在整个灌胃期间均饲以标准饮食,不使用胰岛素。12 w后处死并收集3 ml下腔静脉血及处死前24 h尿,留取右侧肾脏,称重,部分肾组织以10%甲醛固定,其余组织置于-80℃冰箱中冻存。
1.2.2 生化检查 留24 h尿检测尿蛋白定量。血标本检测血糖、血肌酐。并计算左肾重与体重之比。
1.2.3 肾组织病理学检查 肾小球PAS染色及病理程度分析:常规固定、包埋、3 μm切片PAS染色。高倍镜下顺序观察,每张切片观察5个肾小球,每组5张切片,用HIMAS-2000图像分析系统定量测量每个肾小球面积(GA),肾小球内细胞外基质面积(ECM),结果用ECM/GA表示,代表肾小球增生程度。
1.2.4 免疫组化 采用SP法。肾脏标本固定,石蜡包埋切片,分别按试剂盒说明进行E-selectin染色。再由两位免疫病理人员对染色标本进行评定并观察阳性细胞在肾小球内的分布。利用HIMAS-2000病理图像分析系统,测定E-selectin阳性着色的平均灰度×面积比。对E-selectin进行半定量分析。
1.2.5 肾组织总蛋白提取和Western-印迹检测 称取100 mg肾组织,剪碎,1 ml蛋白裂解液(50 mmol/L Tris〔pH7.5〕,150 mmol/L NaCl,5 mmol/L MgCl2,5 mmol/L EDTA,0.5%NP40,1 mmol/L PMSF,20 μg/ml Aprotintin)中匀浆后考马斯亮蓝G250测蛋白浓度。取肾组织蛋白100 μg经10%的SDSPAGE凝胶电泳后,转移至硝酸纤维素膜上,用含5%脱脂奶粉的TBST溶液4℃封闭过夜,加入山羊抗大鼠E-selectin 4℃过夜,再用AP标记的兔抗山羊IgG进行杂交,洗膜后进行NBT/BCIP显色。杂交结果MGIAS-1000凝胶成像分析系统测量吸光度值。
1.3 统计学分析 利用SPSS13.0软件,计量数据用表示,多组间比较采用方差分析,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 生化、肾重及病理改变 与正常对照组相比,DM组及替米沙坦组大鼠血糖、蛋白尿定量、血清肌酐均显著性升高(P<0.01)。与DM组相比,替米沙坦组大鼠蛋白尿定量与血清肌酐显著降低(P<0.01),血糖无明显变化。与正常对照组相比,DM组大鼠肾脏重量增大,替米沙坦组肾重小于DM组并大于正常对照组,但无显著性意义。见表1。大鼠肾组织光镜下可见DM组及替米沙坦组肾小球部分体积增大,系膜区有不同程度增生,间质可见中性粒及单核淋巴细胞浸润,正常对照组未见明显异常。见图1和图2。
表1 各组大鼠血、尿生化结果(,n=10)

表1 各组大鼠血、尿生化结果(,n=10)
与正常对照组相比:1)P<0.05,2)P<0.01;与DM组相比:3)P<0.05,4)P<0.01
组别 血糖(mmol/L) 尿蛋白(mg/d) 血清肌酐(μmol/L) ECG/GA 肾重/体重(×10-3)正常对照组 5.46±0.79 10.50±2.48 58.69±12.63 0.21±0.034.70±0.67 DM组 22.38±2.371) 59.03±11.371) 152.12±18.631) 0.63±0.041) 8.92±0.851)替米沙坦组 20.50±1.731) 38.21±3.71)2) 89.09±12.393)4) 0.41±0.033)4) 7.66±1.001)

图1 各组肾脏病理结果(PAS,×400)
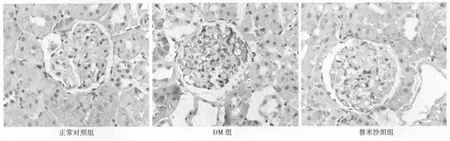
图2 各组E-selectin免疫组化检测结果(×10)
2.2 E-selectin免疫组化及Western印迹结果 E-selectin免疫组化及Western印迹结果示表达呈相同趋势,与正常对照组比较,DM组及替米沙坦组E-selectin表达增加(P<0.01),但R组表达显著低于DM组(P<0.01)。见表2,见图3。
表2 各组大鼠E-selectin免疫组化及Western印迹结果(,n=6)

表2 各组大鼠E-selectin免疫组化及Western印迹结果(,n=6)
与正常对照组相比:1)P<0.01;与DM组相比:2)P<0.01
组别 免疫组化 Western 0.18±0.06 0.02±0.03 M组 2.13±0.181) 0.23±0.261)R组 1.18±0.261)2) 0.07±0.181)2)印迹C组

图3 各组E-selectin免疫印迹结果
3 讨论
本实验模型成功,与文献〔4〕基本一致,大鼠尚处于DN早期。DN时白细胞在肾小球和肾间质的浸润是DN组织的特征性表现之一,并在肾小球硬化方面起重要作用。Hirata等〔5〕发现在DN患者中,E-selectin沿肾小球毛细血管及系膜区分布,DN组与其他肾病组(微小病变性肾病、膜性肾病、狼疮肾炎等)比较,肾组织中E-selectin表达增加有显著意义。由此认为E-selectin介导的肾小球、间质炎性细胞浸润可能是间质纤维化、细胞外基质增生、肾小球硬化的重要机制。Narumi等〔6〕通过原位杂交的方法检测DNkk-ay小鼠肾小球E-selectin表达,发现与对照组比较,E-selectin表达明显增加,说明E-selectin可能参与DN的发生发展。同时,Tailor等〔7〕发现在伴有微血管并发症〔DM视网膜病变(DR)和(或)DN〕的DM患者血清中可溶性E-selectin水平明显高于无糖尿病微血管并发症的患者。另外,Shestakora等〔8〕发现在不同阶段1型DM患者中,有DR、微量或大量蛋白尿患者的血循环E-selectin水平明显要比没有这些病变患者的高,而且增加的水平与患者的性别、血中胆固醇及甘油三酯的水平与明显关系。由此可见E-selectin是DN发展的重要环节。
本实验结果表明E-selectin可能在高糖状态下被激活,E-selectin属于黏附分子中选择素家族,主要分布于内皮细胞和系膜细胞,通过识别特异性的碳水化合物基团介导内皮细胞与单核/巨噬细胞和淋巴细胞的黏附,从而有助于这些炎症细胞游走到肾小球,产生一系列的细胞因子参与DM微血管病变的发生发展〔9,10〕。许多研究表明,内皮功能损伤与DM微血管病变的发生紧密相连,而Bernd等〔11〕发现黏附分子介导的内皮细胞与白细胞的相互作用在内皮损伤的发生发展中占重要地位。本实验进一步证实了E-selectin在DN发展中的作用。
有研究证实肾素-血管紧张素系统参与了DN的进展,其中AngⅡ起重要作用〔12,13〕。DM时高血糖使肾素-血管紧张素系统活性增高,尤其是肾组织中AngⅡ含量增加,导致血管通透性增加,炎症细胞浸润〔14〕。替米沙坦作为半衰期最长的受体拮抗剂,能够持久平稳地抑制AngⅡ,从而减少炎症因子的表达、肾小球系膜炎症细胞的浸润〔15〕。
替米沙坦是一种高活性高选择性的AngⅡ受体拮抗剂,AngⅡ通过与血管、肾脏、心脏、肾上腺上的AT1受体结合发挥其作用。本实验提示替米沙坦可直接或间接通过降低E-selectin表达来改善DM大鼠肾脏病变。但替米沙坦究竟是通过哪些环节影响E-selectin的表达,有待于进一步阐明。
1 王奕丽,刘国良.2型糖尿病患者早期肾脏改变与血清可溶性E-选择素的相关关系〔J〕.中国糖尿病杂志,2003;11(5):373-4.
2 刑玉波.黏附分子与糖尿病〔J〕.国外医学·内分泌学分册,2001;21(1):62.
3 郭志勇,崔若兰.细胞间黏附分子-1在肾小球炎症过程中的作用及氯沙坦对其影响〔J〕.第二军医大学学报,2000;21(1):42-4.
4 Sviglerova J,Kuncova J,Tonar Z.Streptozotocirrindudced model of type 1 diabetes mellitus〔J〕.Cesk Fysiol,2006;55(3):96-102.
5 Hirata K,Shikata K,Matsuda M,et al.Increased expression of selectins in kidneys of patients with diabetic nephropathy〔J〕.Diabetologia,1998;41(2):185-92.
6 Narumi S,Onozato ML,Tojo A,et al.Tissue-specific induction of E-selectin in glomeruli is augmented following diabetes mellitus〔J〕.Nephron,2001;89(2):161-71.
7 Tailor A,Granger DN.Role of adhesion molecules in vascular regulation and damage〔J〕.Curr Hypertens Rep,2000;2(1):78-83.
8 Shestakova MV,Kochemasova TV,Gorelysheva VA,et al.The role of adhesion molecules(ICAM-1 and E-selectin)in development of diabetic microangiopathies〔J〕.Ter Arkh,2002;74(6):24-7.
9 Blaha V,Andrs C,Smahelova A,et al.Effect of atorvastatin on soluble CD14,CD40 ligand,sE-and sP-selectins and MCP-1 in patients with type 2 diabetes mellitus:relationship to cholesterol turnover〔J〕.Pharmacol Res,2006;54(6):421.
10 Hirata F,Yoshida M,Ogura Y.High glucose exacerbates neutrophil to human retinal endothelial cells〔J〕.Exp Eye Res,2006;82(1):179.
11 Bernd J,Susanne D,Nicde H,et al.Effects of hyerinsulinemia on plasma levels of circulating adhesion molecules〔J〕.J Clin Endocrinol Metab,2000;85(5):1748-51.
12 刘志红,黎磊石.探索糖尿病肾病防治的新途径〔J〕.肾脏病与透析移植杂志,2002;11(1):120.
13 段建召,李慧芳,王 霞,等.伊贝沙坦对糖尿病肾病大鼠血浆中AngⅡ浓度及T-PA和 TAI-1活性的影响〔J〕.重庆医学,2004;33(10):1515.
14 曾龙驿,林可意.伊贝沙坦对糖尿病大鼠肾氧化应激、活性和ICAM-1表达的影响〔J〕.中山大学学报,2008;29(4):402-6.
15 Benson SC,Pershadsingh HA,Ho CI,et al.Identification of temisartan as a unique angiotensinⅡreceptor antagonist with selsctive PPARgammamodulating activity J〔J〕.Hypertension,2004;43(5):993-1002.
