大兴安岭不同退化阶段土壤和植物C、N、P浓度及其化学计量特征
2013-09-06甘秋妹孙海龙郝龙飞刘婷岩
甘秋妹,孙海龙,郑 红,郝龙飞,刘婷岩
(东北林业大学林学院,哈尔滨 150040)
大兴安岭地区分布着大面积的寒温带森林,是我国重要的林业基地之一[1]。长期以来因频繁的火灾和过度的采伐,导致该区出现了植被退化。特别是大兴安岭伊勒呼里山以南的干旱阳坡植被退化尤为严重,原生的蒙古栎(Quercus mongolica)兴安落叶松(Larix gmelini)混交林逐渐退化成蒙古栎林、灌丛、灌草丛和草丛,已严重制约该区森林的生态功能发挥[2-4]。C、N和P是生物体的重要组成元素[5-7],N和P又常常是森林生产力的主要限制因素[8]。近年生态化学计量学研究认为,植物叶片的N/P比值与群落结构和功能密切相关,并且可以用来判断植物个体、群落和生态系统的N、P养分限制状况[9-12]。目前,关于N、P化学计量特征的大量研究都集中在全球森林[6,8]、不同的生态系统[5,13-14],而针对不同退化阶段群落研究尚少,仅见于常绿阔叶林[7,15-16]、南热带森林[6]等。通过对不同退化阶段植物群落的叶片N/P比值研究,可判断出各退化阶段群落中的主要限制性元素[7,15-16],进而为退化植被的恢复提供科学指导。大兴安岭植被退化过程中,土壤N、P养分对不同退化阶段群落的限制状况如何,目前尚缺少该方面的研究。因此,本文以大兴安岭地区不同退化阶段的蒙古栎林、灌丛、灌草丛和草丛为研究对象,研究植被退化与土壤和植物C、N、P浓度的关系,并对各退化阶段群落的N、P养分限制作用进行判断,本研究旨在为大兴安岭地区退化植被的恢复提供理论依据。
1 研究地区概况
研究地点位于黑龙江省加格达奇地区的大兴安岭农业林业科学研究院实验基地,地理坐标为124°01'~124°07'E,50°15'~ 50°18'N。该区属寒温带大陆性季风气候,年平均气温为-1.2℃,一月平均气温 -25.5℃,≧10℃积温为 1 100~2 000℃,无霜期为85~130 d,年平均降水量为494.8 mm。该区位于大兴安岭伊勒呼里山南部东坡,地带性土壤为暗棕壤。原生植被为蒙古栎兴安落叶松混交林,经采伐、火烧后,形成了大面积的次生林,主要有蒙古栎林、白桦林(Betula platyphylla)、山杨林(Populus davidiana)等阔叶林。在干旱阳坡这些阔叶林一再遭破坏,则逐步退化为灌丛、灌草丛和草丛[2]。
2 研究方法
2.1 土壤和植物样品采集
于2012年8月选取位于山地阳坡、立地条件基本相似的蒙古栎林、灌丛、灌草丛和草丛群落,各群落的基本概况见表1。在每个群落类型随机设置5个20 m×20 m的样地,在各样地中按蛇形取样法设置9样点,分0~10 cm、10~20 cm两层采集土壤样品。土壤样品带回实验室,挑出其中的石砾和植物根系,土壤自然风干备用。

表1 各退化阶段群落基本概况Tab.1 The basic information of different degradation stages communities
在每个样地内选择各群落内的优势种采集植物叶片。在蒙古栎林内选择生长良好的10株蒙古栎,在树冠中部的东西南北4个方位采集生长旺盛的典型枝条,收集4个方位的新鲜叶片并等量混合,采用四分法取样放入信封。灌丛和灌草丛中灌木叶片的采集在地面借助剪刀完成,收集方法同上。采集草本植物叶片时直接用剪刀剪取成熟叶片。收集到的叶片带回实验室后,放入烘箱105℃杀青后在80℃恒温下烘干至恒重,然后粉碎、过筛、装信封待测定。
2.2 土壤和植物养分测定
土壤和植物全C、全N采用元素分析仪 (德国·Elementer,VARIO Macro)进行测定;土壤和植物全P用硫酸-高氯酸酸溶-钼锑抗比色法测定[17]。
2.3 数据处理
各退化阶段植物群落的叶片C、N、P浓度和化学计量比根据各优势种在群落内的重要值,利用加权平均计算。采用SigmaPlot10.0软件作图,采用SPSS18.0软件对数据进行统计分析,用单因素方差分析 (ANOVA)检验不同退化阶段土壤和植物C、N、P浓度及其化学计量比之间的差异性,然后用最小显著差数法 (LSD)检验差异显著性,并用Pearson分析土壤N、P浓度与植物N、P浓度之间的相关性。
3 结果与分析
3.1 不同退化阶段的土壤C、N、P浓度
植被退化对土壤全C浓度具有一定影响,土壤全C浓度随着退化表现出先增后减的变化趋势(见表2)。在4种退化阶段的土壤中,全C浓度由大到小的顺序为:灌丛>蒙古栎林>灌草丛>草丛。经检验灌丛的0~10 cm土壤全C浓度与草丛差异显著(P<0.05),其余退化阶段间差异不显著(P>0.05)。植被退化对土壤全N、全P浓度的影响规律是一致的,均表现为:蒙古栎林>灌丛>灌草丛>草丛(见表2)。经检验蒙古栎林的各层土壤全N浓度与灌草丛、草丛差异显著(P<0.05),蒙古栎林的0~10 cm土壤全N浓度与灌丛差异显著(P<0.05),其余退化阶段间差异不显著(P>0.05)。蒙古栎林的0~10 cm土壤全P浓度与草丛差异显著(P<0.05),其余退化阶段间差异不显著(P>0.05)。4种退化阶段的土壤全C、全N和全P浓度均随着土层加深而降低。

表2 不同退化阶段土壤的C、N、P浓度Tab.2 C,N,P concentrations of soil at different degradation stages
3.2 不同退化阶段植物群落的叶片C、N、P浓度及其化学计量比
各退化阶段植物群落的叶片C浓度平均值范围为439.42~464.71 g/kg,彼此之间有极显著的差异(P<0.01),各群落之间变化趋势为灌丛>蒙古栎林>灌草丛>草丛(见表3)。不同退化阶段植物群落的叶片N、P浓度均随着植被的退化而逐渐降低,N浓度平均值变化范围为16.25~21.66 g/kg,P浓度平均值变化范围为1.22~2.99 g/kg(见表3),不同退化阶段植物群落之间的叶片N和P浓度差异均达到极显著水平(P<0.01)。随着植被的退化,植物群落的叶片C、N、P浓度下降程度不同,从蒙古栎林退化到草丛,植物群落的叶片C、N、P浓度分别降低了 4.36%、24.98%和59.10%。这表明,在植被退化过程中,植物群落的叶片P浓度降低的程度大于叶片N浓度,而叶片C浓度降低的程度最小。因此,植物群落的叶片C/N、C/P、N/P比值均随着植被的退化而逐渐升高(见表3),且彼此之间的差异达到极显著水平(P<0.01)。

表3 不同退化阶段植物群落的叶片C、N、P浓度及化学计量比Tab.3 C,N,P concentrations and stoichiometry of plant communities at different degradation stages
3.3 不同退化阶段群落的共有物种叶片N/P比值
不同退化阶段群落共有物种有9个,虽然各共有物种在同一退化阶段群落内的叶片N/P比值大小不一,但从其在退化过程中的变化特征看,表现出了较高的一致性,即每个共有物种的叶片N/P比值均随着退化而升高(见表4)。在所列的9个共有物种中,蒙古栎林和灌丛群落中所有共有物种的叶片N/P比值小于14;在灌草丛群落中叶片N/P比值小于14的共有物种8个,在14~16之间的共有物种1个;在草丛群落中叶片N/P比值小于14的共有物种7个,大于16的共有物种2个。
3.4 植物N、P浓度与土壤N、P浓度的相关性分析
不同退化阶段植物群落的叶片N浓度与0~10 cm土壤全N浓度有极显著的正相关 (P<0.01)(如图1(a)所示),而与10~20 cm土壤全N浓度无显著的相关性(P>0.05)(如图1(b)所示)。不同退化阶段植物群落的叶片P浓度与0~10 cm土壤全P浓度具有极显著的正相关(P<0.01)(如图1(c)所示),而与10~20 cm土壤全P浓度无显著的相关性(P>0.05)(如图1(d)所示)。这说明,植物N、P浓度受表层0~10 cm土壤全N、全P浓度的影响较大。
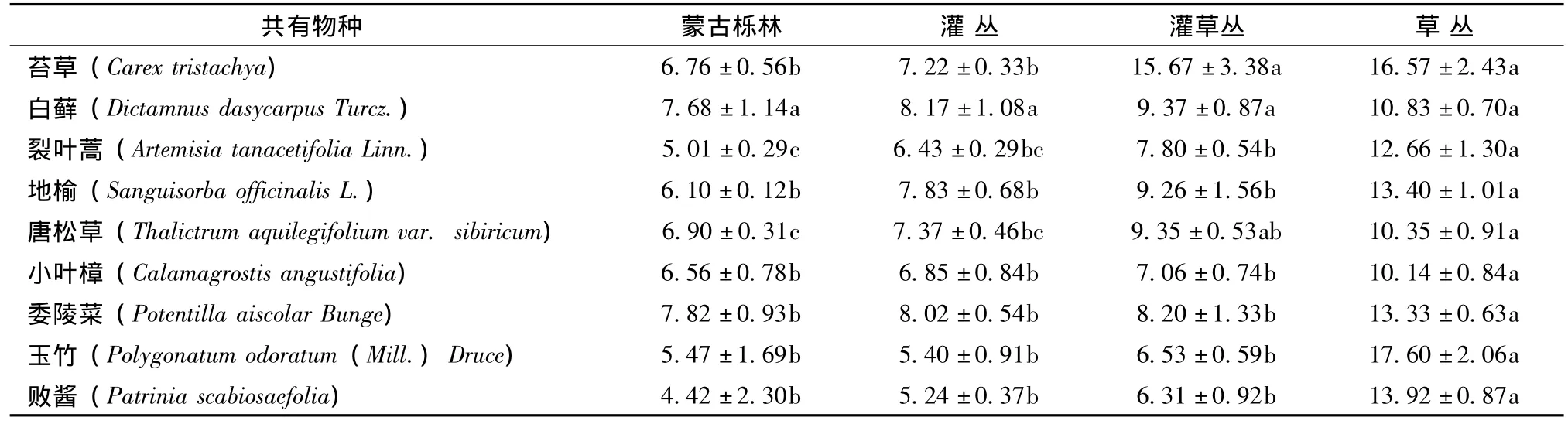
表4 不同退化阶段群落中共有物种叶片N/P比值Tab.4 N/P ratios of common species at different degradation stages

图1 不同退化阶段植物N、P浓度与土壤N、P浓度的Pearson相关分析Fig.1 Pearson correlations of concentrations of N,P in soil and plant at different degradation stages
4 讨论
各退化阶段植物群落的叶片C浓度平均值为451.93 g/kg,低于全球植物叶片的C平均浓度(464.00 g/kg)[18],近似于北京及周边地区植物叶片的C平均浓度 (451.00 g/kg)[13]。各退化阶段植物群落的叶片N浓度平均值为19.44 g/kg,低于全球植物叶片的N平均浓度 (20.60 g/kg)和中国陆生植物叶片的 N平均浓度 (20.20 g/kg)[19-20];而各退化阶段植物群落的叶片P浓度平均值为2.26 g/kg,高于全球植物叶片的 P平均浓度(1.99 g/kg)和中国陆生植物的P平均浓度 (1.46 g/kg)[19]。这表明本研究区域中的植物群落叶片具有较低的N浓度和较高的P浓度。本研究中,植物N、P浓度和土壤全N、全P浓度均随着退化逐渐下降,且植物N、P浓度分别与0~10 cm土壤全N、全P有极显著的正相关(如图1(a)和(c)所示)。这与刘万德等[7]的研究结果是一致的。这表明植物N、P浓度与土壤全N、全P浓度密切相关,土壤全N、全P浓度影响植物的N、P浓度。
植物叶片的N/P临界比值被认为可以作为判断环境对植物生长的养分供应状况的指标[12]。研究显示,当植物叶片的N/P比值小于14时,则表明植物生长主要受到N素的限制作用,而大于16时,则反映植物生长主要受到P素的限制,介于14和16之间则表明受到N、P两种元素的共同限制作用[12,16,21]。本研究中,蒙古栎林、灌丛、灌草丛和草丛植物群落的叶片N/P比值均小于14,且随着植被退化植物群落的叶片N/P比值逐渐升高。在植被退化过程中,各群落共有物种的叶片N/P比值升高,蒙古栎林和灌丛群落中所有共有物种的叶片N/P比值小于14;在灌草丛群落中叶片N/P比值小于14的共有物种8个,1个共有物种的叶片N/P比值在14~16之间;在草丛群落中叶片N/P比值小于14的共有物种7个,大于16的共有物种2个。无论从植物群落水平的叶片N/P比值分析,还是从物种水平的叶片N/P比值分析,都可以得出,各退化阶段群落中植物的生长主要受N限制。这与已有的一些研究结果一致[8,22]。Aerts等[8]研究表明温带森林的生产力主要受到N素的限制。土壤N素主要来源是凋落物的归还和大气氮沉降,而土壤P素的来源相对不易,主要是凋落物的归还和岩石的风化[6,23]。在植被退化过程中,随着环境条件和植被类型的改变,植物对土壤N、P的获得途径也受到影响。随着植被退化,地表裸露面积越来越大,地表径流增强,进而导致土壤中P素的流失加重,加之P素的矿化相对N素缓慢[7],因此随着植被退化的加剧,土壤P浓度降低的程度比土壤N浓度大。正是由于土壤中N和P浓度随着植被退化的这种变化规律,加之植物N、P浓度分别与土壤N、P浓度有明显的正相关,导致植物叶片N/P比值随植被退化而升高的变化规律。当然,影响植物叶片N/P比值的因素是复杂的,不同群落的养分限制状况受到众多因素的影响。因此,今后还需要利用其它辅助 (如施肥等)手段来诊断植物叶片N/P特征与养分限制性的关系。
【参 考 文 献】
[1]宋启亮,董希斌,李 勇,等.采伐干扰和火烧对大兴安岭森林土壤化学性质的影响[J].森林工程,2010,26(5):4 -7.
[2]周以良.中国大兴安岭植被[M].北京:科学出版社,1991:44-186.
[3]沈秋根.浅谈干旱阳坡造林[J].内蒙古林业,1982,(3):31-33.
[4]马克平,董世林,聂绍荃,等.大兴安岭草地的研究[J].齐齐哈尔师范学院学报(自然科学版).1990,10(3):27-31.
[5]杨惠敏,王东梅.草-环境系统植物碳氮磷生态化学计量学及其对环境因子的响应研究进展[J].草业学报,2011,20(2):244-252.
[6]刘兴诏,周国逸,张德强,等.南亚热带森林不同演替阶段植物与土壤中N、P的化学计量学特征[J].植物生态学报,2010,34(1):64-71.
[7]刘万德,苏建荣,李帅锋,等.云南普洱季风常绿阔叶林演替系列植物和土壤 C、N、P化学计量特征[J].生态学报,2010,30(23):6581-6590.
[8]Aerts R,Chapin Ⅲ F S.The mineral nutrition of wild plants revisited:a re - evaluation of processes and patterns[J].Advance in Ecological Research,2000,30:1 -67.
[9]曾德慧,陈广生.生态化学计量学:复杂生命系统奥秘的探索[J].植物生态学报,2005,29(6):1007 -1019.
[10]Reich P B,Oleksyn J.Global patterns of plant leaf N and P in relation to temperature and latitude[A].Proceedings of the National Academy of Sciences of the United States of America[C],2004,101:11001-11006.
[11]Thompson K,Parkinsin J A,Band S R.A comparative study of leaf nutrient concentrations in a regional herbaceous flora[J].New Phytologist,1997,136:679 -689.
[12]Güsewell S.N:P ratios in terrestrial plants:variation and functional significance[J].New phytologist,2004,164:243 -266.
[13]韩文轩,吴 漪,汤璐瑛,等.北京及周边地区植物叶的碳氮磷元素计量特征[J].北京大学学报(自然科学版),2009,45(5):855-859.
[14]仁书杰,于贵瑞,姜春明,等.中国东部南北样带森林生态系统102个优势种叶片碳氮磷化学计量学统计特征[J].应用生态学报,2012,23(3):581 -586.
[15]高三平,李俊祥,徐明策,等.天童常绿阔叶林不同演替阶段常见种叶片N、P化学计量学特征[J].生态学报,2007,27(3):948-952.
[16]闫恩荣,王希华,周 武.天童常绿阔叶林演替系列植物群落的N:P化学计量特征[J].植物生态学报,2008,32(1):13-22.
[17]南京农业大学.土壤农化分析[M].北京:中国农业出版社,1981:37-65.
[18]Elser J J,Stemer R W,Gorokhova E,et al.Biological stoichimometry from genes to ecosystems[J].Ecology letters,2000,3(6):540-550.
[19]贺金生,韩兴国.生态化学计量学:探索从个体到生态系统的统一化理论[J].植物生态学报,2010,34(1):2 -6.
[20]周桂香,张文元,胡冬南,等.土壤有机碳影响因素及测定方法探讨[J].江西林业科技,2011,21(6):31 -34.
[21]Drenovsky R E,Richards J H.Critical N:P values:predicting nutrient deficiencies in desert shrublands[J].Plant and Soil,2004,259:59-69.
[22]Reich P B,Oleksyn J.Global patterns of plant leaf N and P in relation to temperature and latitude[J].PNAS,2004,101(30):11001-11006.
[23]Hook P B,Burke I C,Lauenroth W K.Heterogeneity of soil and plant N and C associated with individual plants and openings in North American short grass steppe[J].Plant Soil,1991,138(2):247-256.
