白蚁木质纤维酶昆虫细胞表达体系的构建
2013-09-03张晓彦于德水沙长青
原 韬,王 钢,谷 军,张晓彦,于德水,沙长青,
(1.黑龙江省科学院微生物研究所,哈尔滨 150010;2.黑龙江省科学院,哈尔滨 150001;3.哈尔滨工业大学,哈尔滨 150001)
生物质能是一种重要的可再生能源,大力发展生物质能源,逐步取代传统不可再生能源势在必行。木质纤维原料是地球上最丰富、最廉价的可再生资源。木质纤维原料中纤维素及半纤维素约占干重的60% ~85%,纤维素、半纤维素经酶学降解生产单糖是公认的最理想的转化方法[1]。因此,纤维素酶和半纤维素酶的研究一直是生物学领域的重要课题之一。
自然界微生物对木质纤维的降解是一个缓慢的过程,虽然对木质纤维有较完整和彻底的降解能力,但降解效率却并不高,使之成为木质纤维材料利用的限速步骤和瓶颈环节。而白蚁由于自身对生长养分来源的需求[2-5],其内外源木质纤维酶的开发被认为是大量转化和利用木质纤维生物能源的重要参考途径[6]。
在研究白蚁内源木质纤维酶的过程中仍存在着许多问题有待解决,其中与传统微生物产纤维素、半纤维素酶的克隆表达不同,白蚁内源木质纤维酶区别于细菌、真菌内源酶,是一种昆虫内源酶,其合成后修饰系统区别于大肠杆菌、酵母菌等传统表达[7,8],利用这种传统微生物表达体系进行白蚁内源木质纤维酶的克隆和表达,很难保证表达产生的酶蛋白具有原始活性。因此,在白蚁内源酶蛋白表达过程中,需要一种接近白蚁自身蛋白表达加工的高效表达体系[9]。
昆虫杆状病毒表达系统利用昆虫杆状病毒作为传递媒介,可将外源蛋白基因整合在昆虫杆状病毒基因组中,并保证病毒的完整性,经过病毒的包装和侵染,外源基因进入昆虫细胞,利用病毒自身的中晚期强启动子,在昆虫细胞中高效表达外源蛋白基因,杆状病毒的宿主范围仅限于昆虫和少数其他无脊椎动物,其专一性使其对人和哺乳动物是安全的。杆状病毒除个别基因外绝大多数基因无剪接作用,能够最大程度保证外源基因的功能。
本研究以白蚁为目标,克隆白蚁内源木质纤维酶基因,利用昆虫杆状病毒表达体系构建重组杆状病毒,经过转染、扩毒,利用昆虫细胞高效表达白蚁内源木质纤维酶,最大程度接近白蚁自身内源木质纤维酶的表达环境,为提高表达产物活性提供最佳条件。
1 材料与方法
1.1 材料
1.1.1 菌种和质粒
E.coli DH5α、DH10Bac 由本课题组保藏;E.coli DH5α用于克隆转化,E.coli DH10Bac用于重组杆状病毒构建;Bac-to-Bac系统转移质粒pFastBac1,由黑龙江大学生命科学学院馈赠;克隆载体pMD18-T Vector,购自大连宝生物工程有限公司。

图1 携带白蚁内源木质纤维酶重组杆状病毒构建图Fig.1 Map of recombinant baculovirus construction of termite wood fibre enzyme
1.1.2 扩增引物
参照GenBank中收录的Odontotermes formosanus EG酶(GU326330.1)序列,通过比较分析,应用生物软件 Primer5.0设计引物,扩增约1.7kb的EG酶基因(表1)。

表1 引物序列Tab.1 Primer sequences
1.1.3 工具酶及试剂
Taq plus,rTaq酶购自天根生化科技有限公司;Bam HⅠ、Eco RⅠ、HindⅢ,T4DNA连接酶,RNA酶,蛋白酶 K购自宝生物工程有限公司;Sf900ⅡSFM培养基购自Invitrogen公司;DMEM培养基购自Hyclone公司;胎牛血清(Cat.No.A15-043)购自PAA公司;胰蛋白酶购自宝生物工程有限公司;Sf900ⅡSFM培养基购自Invitrogen公司;低熔点琼脂糖购自Promega公司;CellfectinⓇ Reagent购自 Invitrogen公司;Reverse Transcription System购自Promega公司;小量胶回收试剂盒(Gel Extraction Mini Kit)购自华舜生物试剂公司。LB液体、固体培养基;SOB培养基;SOC培养基。
1.2 方法
1.2.1 TRIzol法提取白蚁基因组RNA
在解剖镜下提取白蚁的唾液腺:50~100mg唾液腺加入400μL TRIzol,充分振匀后室温静置8min;加入80μL的氯仿,颠倒混匀,室温静置5min,然后10 000 r/min、4℃离心15min;取上清加50%终体积的异丙醇于-20℃沉淀1 ~2h,然后12 000r/min、4℃离心 15min;弃上清,用 200μL预冷的75%乙醇漂洗,12 000r/min、4℃离心15min;弃上清,干燥后用20μL DEPC水重悬,稀释适当倍数用紫外分光光度计测定RNA的浓度后备用。
1.2.2 反转录(RT)反应
在PCR管中准备以下RNA引物混合物:病毒RNA 1μg反转录引物 1μL,DEPC 处理水补加至 10.75μL,其中反转录引物为P1。70℃ 3min、冰浴5min;按顺序在PCR管中加入以下试剂:10 ×buffer 2μL,MgCl2(25mmol/L)4μL,dNTP Mixture(10mM)2μL 共8μL,加入 Recombinant Inhibitor 0.5μL 和 RT 酶 0.75μL;48℃ 40min;95℃加热 5min,冰浴 5min,-20℃保存[10]。
1.2.3 PCR扩增 EG 基因
50 μL PCR反应体系,PCR管中依次加入下列组分10×Taq Plus Buffer(Mg2+)5μL,dNTP Mixture 0.8mmol/L,primer各0.4μmol/L,Taq Plus DNA Polymerase 0.5μL,模板DNA 1μL,以P1、P2为引物,进行PCR反应:1个循环94℃120s;30个循环 98℃ 10s,55℃ 15s,72℃ 90s;1个循环72℃ 600s。取5μL反应产物,与1μL 10×Loading buffer混合均匀,用1%的琼脂糖凝胶电泳进行检测。
1.2.4 PCR 产物胶回收与T-Vector连接
PCR产物用上海华舜生物工程有限公司DNA胶回收试剂盒(Gel Extraction Mini Kit)进行回收。将纯化的PCR产物与克隆载体pMD18-T在16℃连接过夜,反应体系见载体说明书。
1.2.5 利用Bac-to-Bac体系构建重组Bacmid-EG
1.2.5.1 连接片段的制备与连接
用HindⅢ和EcoRⅠ对pFastBac1转移载体和p18EG1分别进行双酶切。反应条件为37℃水浴作用2h。根据胶回收目的条带时各产物的浓度,按照插入片段和载体的摩尔浓度比为5∶1进行连接,16℃连接过夜。
1.2.5.2 重组转移质粒pFastBac1的筛选
取2μL连接产物转化E.coli DH5α感受态细胞,其中使用的LB琼脂平板含氨苄青霉素(终浓度为100μg/mL),不含IPTG和X-gal。37℃培养过夜,挑取抗性菌落接种在5mL LB液体培养基(100μg/mL Amp)中,37℃振荡培养12~14h。用EcoRⅠ和HindⅢ双酶切鉴定。
1.2.5.3 重组 Bacmid DNA 的 PCR鉴定
以100ng重组Bacmid DNA为模板,以P1和P2为引物,对重组Bacmid DNA进行PCR鉴定。将含有EG基因的重组Bacmid命名为Bacmid-EG。
1.2.6 带有EG基因重组杆状病毒的构建
1.2.6.1 重组Bacmid转染Sf9细胞
将生长状态良好的Sf9细胞,以1 000r/min离心5min,弃上清,细胞沉淀用新鲜的SF900ⅡSFM培养液(含50U/mL青霉素和50μg/mL链霉素)重悬,调整细胞密度至4.5×105个/mL,每孔加入2mL接于6孔细胞培养板上。细胞贴壁1h后,即可以转染;将重组bacmid DNA与转染试剂于Eppendorf管中混合:
a.将1μg重组 bacmid DNA 用 100μL SF900ⅡSFM 培养液稀释。
b.用前将转染试剂(CellfectinⓇ Reagent)翻转5~10次,使之混匀。取6μL转染试剂用100μL SF900ⅡSFM培养液稀释。
c.将稀释的重组bacmid DNA和转染试剂混匀,制备DNA-脂质体混合物(总体积约为210μL)。室温静置15~45min。
弃去Sf9细胞的培养液,用2mL SF900ⅡSFM培养液洗涤细胞,弃去洗涤培养液;向含有DNA-脂质体混合物的各个Eppendorf管中加入0.8mL SF900ⅡSFM培养液,温和混匀,分别加入每个细胞培养孔中,27℃作用5h;移出DNA-脂质体混合物,向细胞中加入2mL SF900ⅡSFM培养液(含50U/mL青霉素和50μg/mL链霉素),27℃培养直至细胞出现明显的病变效应。
1.2.6.2 重组杆状病毒DNA的提取
将1mL病毒液以5 000r/min,4℃离心10min,沉淀细胞碎片,吸取上清至一新的离心管中,18 000r/min、4℃离心2h,弃去上清,用50μL TEN缓冲液重悬病毒沉淀;加入蛋白酶K(20mg/mL)至终浓度为1mg/mL和10%SDS至终浓度为0.5%,50℃温浴2h;加入等体积酚/异戊醇(25/1),混匀,室温3min,12 000r/min、4℃离心5min;上清移至一新的离心管中,加入等体积氯仿,上下颠倒混匀,室温3min,12 000r/min,4℃离心5min;上清移至一新的离心管中,加入1/10体积预冷3M NaAC和等体积预冷异丙醇,-20℃静置2h沉淀DNA;12 000r/min、4℃离心15min,弃上清,用100μL预冷 75%乙醇漂洗沉淀,12 000r/min、4℃ 离心15min,弃上清,用 10μL ddH2O 重悬 DNA 沉淀,-20℃保存。
2 结果与分析
2.1 EG基因的反转录及PCR扩增
以P1、P2为引物,以反转录产生的cDNA为模板,对EG基因进行PCR扩增,其扩增结果见图2,约1.7kb电泳带为PCR扩增产物。

图2 EG基因的PCR结果1 EG基因的PCR产物;2 DNA Marker DL15 000.Fig.2 The PCR result of EG;1 PCR product of EG;2 DNA Marker DL15 000.
2.2 p18EG1重组子的鉴定
EG基因的PCR产物经胶回收纯化后连接于pMD18-T载体以P1和P2为引物做PCR鉴定阳性克隆,扩增产物大小约在1.7kb处,与预期大小相符,结果见图3。
2.3 EG连于pMD18-T载体方向鉴定
根据后续重组质粒pFastBac1的构建策略(如图4),选择pFastBac1和pMD18-T载体共有的EcoRⅠ和HindⅢ两个酶切位点作为连接位点。由于“T-A”克隆是非定向克隆,所以EG片段可能以“正向”和“反向”两种方向连接到pMD18-T载体上,这里“正向”规定为EG基因的起始密码子ATG靠近pMD18-T载体多克隆位点中的EcoRⅠ位点,相反则为“反向”。依据构建策略要求,EG基因反向连接于pMD18-T载体才能使EG的表达方向与pFastBac1质粒载体上的PPH启动子方向一致。所以需要筛选反向连接于pMD18-T载体上的EG阳性克隆。
在EG基因中,位于1 316bp处具有EcoRⅠ单一酶切位点,而且pMD18-T载体多克隆位点中也具有BamHⅠ单一酶切位点。若经BamHⅠ单酶切,反向连接的p18EG1克隆应该切出约450bp和4 000bp两条条带,正向连接的VP2克隆应该切出约1 316bp和3 100bp两条条带。选取2个p18EG重组子,分别命名1、2,分别用BamHⅠ单酶切,结果1切出两条约为1 316bp和3 100bp的条带,结果2切出两条约为450bp和4 000bp的条带。同时使用EcoRⅠ和HindⅢ两个酶对1、2两组质粒进行双酶切,结果都出现了与EG基因相符的约1.7kb的条带和与pMD18-T质粒大小相符的约2.7kb的条带。(如图5),说明1号为EG正向连接的阳性克隆,2号为反向连接的阳性克隆。
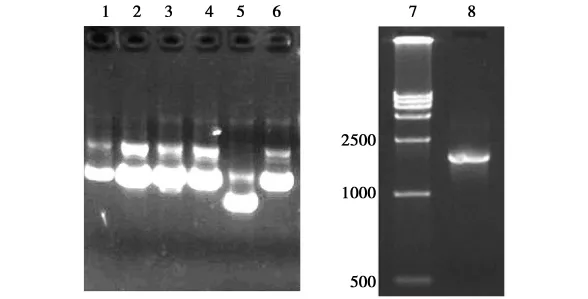
图3 p18EG的鉴定结果1-6 p18EG1重组质粒电泳结果;7 DNA Marker DL15 000;8 p18EG的PCR鉴定结果。Fig.3 The identification result of p18EG 1-6 plasmid;7 DNA Marker DL15 000;8 PCR amplification of p18EG.
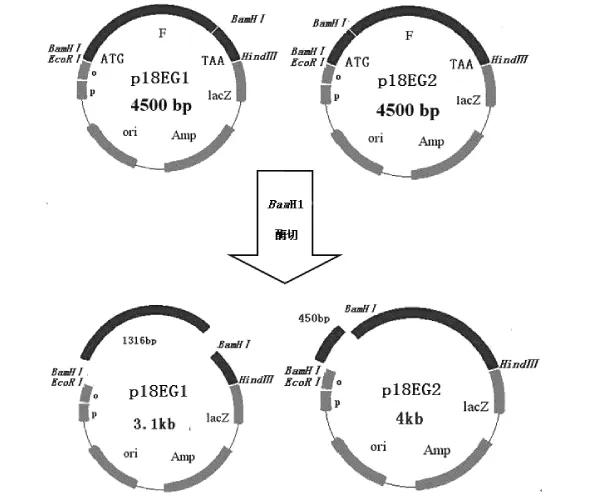
图4 构建重组质粒p18EGFig.4 The construction of recombinant plasmid p18EG
2.4 携带EG基因重组Bacmid的构建
2.4.1 黏性末端pFastBac1和EG基因片段的制备
pFastBac1-EG的构建策略如图4所示。对pFastBac1转移质粒和p18EG1分别进行HindⅢ和EcoRⅠ双酶切。酶切产物经0.8%琼脂糖凝胶电泳鉴定后,分别胶回收pFastBac1质粒载体(4.8kb)和EG基因(1.7kb)的目的条带,结果见图6。

图5 p18EG的鉴定结果1 DNA Marker DL2 000;2,3 Bam HI单酶切产物;4,5 EcoRI和HindⅢ双酶切产物。Fig.5 The identification result of p18EG 1 DNA Marker DL2 000;2,3 Product digested with Bam HI;4,5 Product digested with EcoRI and HindⅢ.

图6 pFastBac1、p18EG1双酶切胶回收结果1DNA Marker DL15 000;2 p18EG的EcoRⅠ和HindⅢ双酶切胶回收产物;3 pFastBac1的EocRⅠ和HindⅢ双酶切胶回收产物。Fig.6 The gel extraction result of pFastBac1 and p18EG1 1DNA Marker DL15 000;2 Gel extraction product of pFastBac1 digested with EcoRⅠand HindⅢ.3Gel extraction product of pFastBac1 digested with EcoRⅠand HindⅢ.
2.4.2 含有EG基因重组Bacmid的鉴定
重组质粒pFBEG1转化E.coli DH10Bac感受态细胞,碱裂解法提取重组Bacmid DNA,以P1和P2为引物对其进行PCR鉴定,扩增产物约在1.7kb处,与预期大小相符,结果见图7。
2.5 重组杆状病毒的构建
2.5.1 Sf9昆虫细胞正常及病变形态区别
利用倒置显微镜观察正常Sf9昆虫细胞及重组Bacmid-EG转染Sf9细胞后产生的细胞病变,生长良好的Sf9昆虫细胞呈现圆形、明亮且边缘整齐,观察病变细胞初期(转染后3~5d)出现细胞体积变大,细胞内部出现颗粒,后期(转染后7~10d)病变细胞破裂,结果见图8。

图7 重组Bacmid的PCR鉴定结果1-2重组Bacmid的PCR产物;3 DNA Marker DL15 000。Fig.7 The PCR identification of recombinant Bacmid 1-2 PCR product of recombinant Bacmid;3 DNA Marker DL15 000.

图8 不同状态的Sf9细胞(40×)(a)正常状态的Sf9细胞;(b)重组病毒感染后的Sf9细胞4d;(c)重组病毒感染后的Sf9细胞9d。Fig.8 The different states of Sf9 cells(40 × )(a)Normal Sf9 cells;(b)Pathological Sf9 cells infected by recombinant baculovirus after 4days;(c)Pathological Sf9 cells infected by recombinant baculovirus after 9 days.
2.5.2 带有EG基因重组杆状病毒的鉴定
重组Bacmid DNA转染Sf9昆虫细胞后,当细胞出现明显病变效应时收获上清即为重组杆状病毒,以P1和P2为引物PCR鉴定带有EG基因重组杆状病毒的DNA,其扩增产物大小为1.7kb,与预期相符,结果见图9。
3 讨论
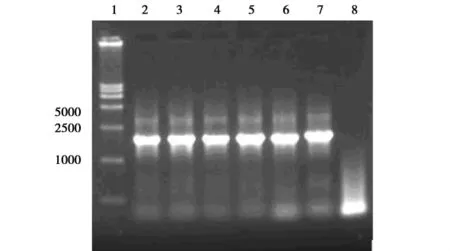
图9 F重组杆状病毒PCR鉴定1 DNA Maker DL15 000;2-7重组杆状病毒PCR产物;8未携带EG基因的重组杆状病毒PCR产物。Fig.9 PCR analysis of F recombinant baculovirus 1 DNA Maker DL15 000;2-7 The PCR product of EG recombinant baculovirus;8 The PCR product of baculovirus without EG.
目前国内外对白蚁木质纤维消化能力的研究主要集中在对内源相关酶系的克隆、表达及功能鉴定、白蚁共生生物木质纤维酶及共同代谢机制的研究。国内对白蚁木质纤维消化的研究起步较晚,但目前已成为学术界的研究热点,近年来有多篇该方向的综述性论文相继发表,已有报道克隆得到了部分白蚁肠道纤维素酶基因并在菌体中表达。本研究从内源角度对白蚁自身产生的木质纤维酶基因进行克隆、鉴定、Bac-to-Bac重组构建、扩增病毒、昆虫细胞表达,证明了昆虫杆状病毒细胞表达体系能够成功携带白蚁内源木质纤维酶基因。为今后继续开展以白蚁作为模式生物开展木质纤维降解研究,充分利用秸秆等可再生木质纤维资源为底物,寻找高效、低成本的木质纤维转化体系,解决木质纤维生产乙醇等可再生能源过程中存在的瓶颈问题,以及我国面临的经济增长和环境保护的双重压力、建立可持续发展能源系统、促进社会经济的发展和生态环境的改善具有十分重要的现实意义和深远的历史意义。
[1]ARAKAWA G,WATANABE H,YAMASAKI H,et al.Purification and molecular cloning of xylanaaes from the wood-feeding termite,Coptotetmes Formosanus Shiraki[J].Blosci.Biotechnol,2009,(73):710-718.
[2]ENGEL MS,GROSS M.A giant termite from the late miocene of Styria,Austria(Isoptera)[J].Nalurwisstmsehaften,2009,(96):289-295.
[3]TIAN-CI YANG,JIAN-CHU MO,JIA-AN CHENGL.Purification and some properties of cellulase from Odontotermesformosanus(Isoptera:termitidae)[J].Entomologia Sinica,2004,11(1):1-10.
[4]GAKU TOKUDA,NATHAN LO,HIROFUMI WATANABE,et al.Major alteration of the expression site of endogenous cellulases in members of an apical termite lineage[J].Molecular Ecology,2004,(13):3219-3228.
[5]KEISUKE NAKASHIMA,HIROFUMI WATANABE,HITOSHI SAITOH,et al.Dual cellulose-digesting system of the woodfeeding termite,Coptotermes formosanus(Shiraki)[J].Insect Biochemistry and Molecular Biology,2002,(32):777-784.
[6]LIXH,YANG HJ,ROY B.WANG D,MIAOYG.The most stirring technology in future:Cellulase enzyme and biomass utilization[J].African Journal of Biotechnology,2009,8(11):2418-2422.
[7]TOKUDA G,LO N,WATANABE H,et al.Major alteration of the expression site of endogenous cellulases in members of an apical termite lineage[J].Mol.Ecol,2009,(13):3219-3228.
[8]FABER K H,HARDER WAB G.Methylotrophic yeast as factories for the production of foreign protein[J].Yeast,1995,11(4):1331-1344.
[9]FUJJTA A,MIURA T,MATSUMOTE T.Differences in cellulose digestive systems among castes in two termite lineages[J].Physiological Entomology,2008,(33):73-82.
[10]GAKUTOKUDA,NATHANLO,HIROFUMIWATANABE,et al.Mrtazoan cellulase genes from termites:intron/exon structures and sites of expression [J].Biochim.Biophys.Acta,1999,(1447):146-159.
