喉鳞癌中microRNA-197表达水平的研究
2013-09-01李俊王建中黄新生白广平童华
李俊 王建中 黄新生 白广平 童华
(1.复旦大学附属中山医院青浦分院耳鼻咽喉科,上海 201700;2.复旦大学附属中山医院耳鼻咽喉科,上海 200032)
近年来发现,microRNAs(miRNAs)作为表观遗传修饰的手段和结果之一,很可能在人类癌症的发生、发展和预后中起着重要作用[1]。喉癌是耳鼻咽喉科常见的恶性肿瘤,占全身恶性肿瘤的5.7%~7.6%,目前其发病率有明显增长趋势,其中喉鳞癌占全部喉癌的93%~99%。本研究采用miRNAs芯片技术检测喉鳞癌细胞株 Hep-2中miRNAs的表达,并采用实时定量聚合酶链反应(realtime quantitative reverse-transcriptase polymerase chain reaction,RT-PCR)在喉鳞癌组织中验证。
1 资料与方法
1.1 材料 20例喉鳞癌组织标本及10例癌旁正常组织标本均取自2010年7月—11月复旦大学附属中山医院耳鼻咽喉科手术标本。20例喉鳞癌病理诊断均为原发性喉鳞癌,所有患者均为首诊首治,未行术前放化疗。取材时,分别取癌旁正常组织(距癌组织大于3 cm)和癌组织,将组织块剪至约1 cm大小,10 min内迅速置于液氮中储存,后转至-80℃冰箱保存。喉鳞癌细胞株Hep-2及永生化正常人支气管上皮细胞株HBEAs-2B均购自中国科学院上海生物所细胞库。采用miRCURY LNATM U-niversal RT microRNA PCR芯片(丹麦Exiqon公司,由上海康成生物工程有限公司检测);RPMI 1640培养液和胎牛血清购自美国Hyclone公司;Trizol购自美国Invitrogen公司;SYBRTM Green master mix购自丹麦Exiqon公司;Taq聚合酶购自美国Promega公司;RNA酶抑制剂和MMLV反转录酶购自美国Epicentre公司;7900型PCR扩增仪购自美国Applied Biosystem公司;目的基因及内参引物均由上海英骏生物技术有限公司合成;其他常规试剂购自上海化学试剂有限公司。
1.2 方法
1.2.1 细胞培养 Hep-2和 HBEAs-2B细胞均用RPMI 1640培养液(10%胎牛血清、100 U/mL青霉素及100μg/mL链霉素)于37℃、5%CO2、饱和湿度下培养,每2~3 d换液,用0.25%胰酶消化传代。取对数生长期的细胞用于实验。
1.2.2 RNA提取及质量检测 采用Trizol法提取细胞总RNA,具体方法按说明书进行。采用紫外分光光度计分别测定波长为230、260和280 nm处的吸光度值(A值),确定总RNA的纯度和浓度;采用甲醛变性琼脂糖凝胶电泳检测总RNA样品中28S RNA和18S RNA的比例,鉴定其纯度和完整性。
1.2.3 miRNAs芯片检测 采用 miRCURY LNATM Universal RT miroRNA PCR芯片,内设6个内参,包括3个 miRNAs(hsa-miR-103、hsamiR-191和hsa-miR-423-5p)以及3个小RNA(U6、SNORD38B和SNORD49A)。采用Universal RT反应,对Hep-2细胞及HBEAs-2B细胞进行高通量miRNAs定量检测。将总RNA样品浓度调整至1.492~1.786 ng/μL,按以下20μL体系合成cDNA:5×反应缓冲液4μL,酶混合液2μL,总RNA 14μL;反应条件:42℃60 min,95℃5 min。cDNA稀释100倍后,将cDNA模板与SYBRTM Green Master Mix按1∶1的比例混合,以每孔10 μL加入384孔PCR板中。采用7900型PCR扩增仪进行反应,反应条件:95℃10 min;95℃10 s,扩增40个循环;60℃1 min;分析溶解曲线。采用GenEx qPCR分析软件(www.exiqon.com/mirnapcr-analysis)对数据进行标准和深入分析。
1.2.4 RT-PCR 检测 miRNA-197(miR-197)在喉鳞癌组织中的表达水平 内参U6引物序列:上游引物(F)为5′-GCTTCGGCAGCACATATACTAAAAT-3′; 下游引物 (R )为 5′-CGCTTCACGAATTTGCGTGTCAT-3′;目的基因 miR-197引物序列:F为5′-GGTTCACCACCTTCTCCA-3′;R为5′-CAGTGCGTGTCGTGGAGT-3′。RNA逆转录反应条件:16℃30 min,42℃40 min,85℃5 min。反应结束后,将反应产物cDNA放在冰上待用或-20℃保存。RT-PCR反应条件如下:95℃3 min;95℃15 s,60℃20 s,72℃20 s,40个循环;78℃20 s。为了建立溶解曲线,扩增反应结束后,按95℃15 s、60℃20 s、72℃20 s、99℃15 s,从72℃缓慢加热至99℃。各样品中的miR-197和内参U6分别进行RT-PCR反应。PCR反应结束后确认扩增曲线和溶解曲线,进行实验结果的分析。
1.2.5 数据分析 采用ΔΔCt方法,miRNA PCR Array计算公式:ΔΔCt=ΔCt(Hep-2)-ΔCt(HBEAs-2B);通过2-ΔΔCt计算 Hep-2与 HBEAs-2B对应基因的表达差异。
1.3 统计学处理 采用SPSS 13.0统计软件进行分析,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 RNA质检结果 采用紫外吸收测定法测定从各细胞和组织样本中分别提取的总RNA的浓度及纯度,结果显示,RNA纯度和浓度均合格,A260/A280为1.8~2.1,A260/A230>1.8,浓度为600~2500 ng/μL。变性琼脂糖凝胶电泳结果也提示,所提取RNA的浓度、纯度和完整性均符合实验要求。
2.2 miRNAs芯片结果 筛选条件为Fold Difference不低于2倍。与HBEAs-2B比较,Hep-2细胞中上调的miRNAs共166个,下调的miRNAs共47个。在 Hep-2细胞中,miR-197上调5.08倍,miR-133b上调21.79倍;miR-519d下调3.93倍,miR-20b下调21.49倍,经组间t检验比较,差异均有统计学意义(P均<0.05)。表达谱部分结果见表1。
2.3 RT-PCR检测结果 miR-197在喉鳞癌组织及癌旁正常组织中的RT-PCR结果见图1~4。目的基因miR-197和内参基因U6的扩增曲线从最大基线后开始出现指数增长期和平台期,说明产物扩增较好。目的基因miR-197和内参基因U6的溶解曲线都只有单一锐利的峰,说明所设计的引物有较高特异性,只扩增出单一产物。设置为由系统自动调整基线和阈值,首先分别求出每个样品3个重复孔中目的基因miR-197和内参基因U6的平均Ct值,然后用内参基因U6对各实验组样本进行校正(ΔCt),再取其对数,比较各样本中 miR-197表达的差异,对对照组和实验组样本的ΔCt进行归一化处理(2-△△Ct),最后根据2-△△Ct统计分析组间 miR-197的表达差异,见表2。结果显示,miR-197在喉鳞癌组织中的表达水平显著高于癌旁正常组织,差异有统计学意义(P<0.05)。

表1 Hep-2与HBEAs-2B中表达有差异的miRNAs谱



3 讨 论
本研究采用miRNAs芯片技术检测喉鳞癌细胞株Hep-2及正常人支气管上皮细胞株HBEAs-2B中miRNAs的表达,首次获得了喉鳞癌Hep-2细胞miRNAs表达谱,从中挑选出在Hep-2中显著高表达的miR-197,进一步在20例喉鳞癌组织及10例癌旁正常组织中检测其表达情况。本研究所用的丹麦Exiqon公司的miRCURY LNATM UniversalRT microRNA PCR芯片,实现了高通量高质量的miRNAs定量检测工作,采用一次单链cDNA合成反应制备的cDNA可作为芯片所有miRNAs PCR反应的模板,避免了用混合RT引物对扩增特异性的影响,实现了引物Tm值均一;并能有效区分序列仅有一个碱基差异的miRNAs,还能区分成熟miRNAs和miRNAs前体;具有灵敏度高、特异性强、准确性高、质控严格、高重复性的特点。
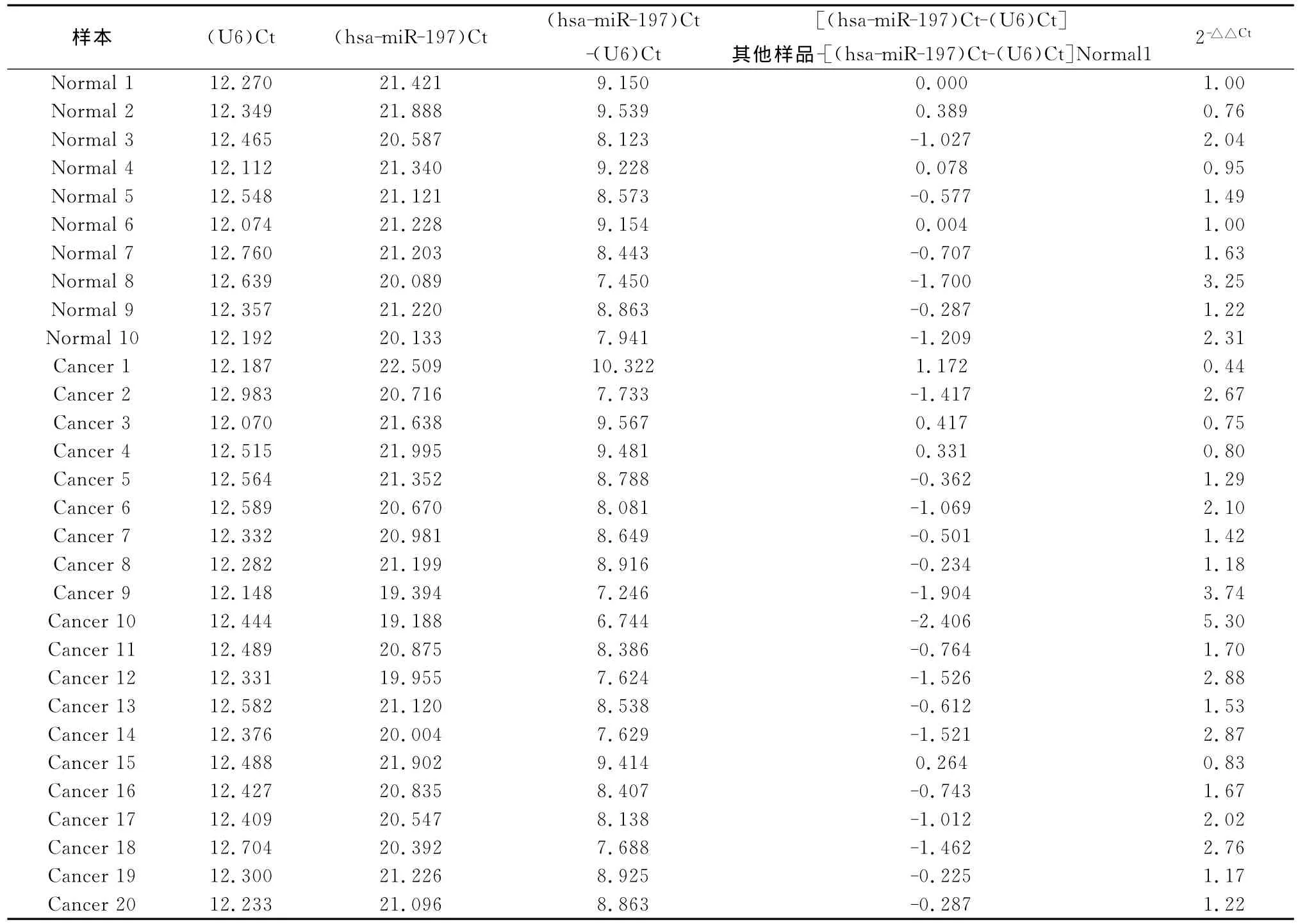
表2 RT-PCR检测结果
本研究发现,miR-197在人喉磷癌组织中表达水平显著升高。Du等[2]研究发现,miR-197在小细胞肺癌细胞株和非小细胞肺癌细胞株中表达水平高于人支气管上皮细胞。Wong等[3]发现,miR-197、miR-184等24个miRNAs在舌鳞癌高表达,研究还发现,miR-184表达水平与舌鳞癌的发生有关。Nikiforova等[4]、Weber等[5]研究发现,miR-197在甲状腺肿瘤中过表达,并且与其病理类型密切相关。Wang等[6]在妇女子宫肌瘤中发现 miRNA-21、miR-197等高表达。Hamada等[7]发现,miR-197在人胰腺癌呈显著性高表达。
综上所述,miR-197在体内外人喉鳞癌细胞中均呈现高表达状态,揭示其可能在维持喉鳞癌细胞恶性表型中起重要作用,提示miR-197可能是喉鳞癌的特异性表达标志物之一,为进一步研究miR-197在喉癌中的作用机制奠定了实验基础。
[1] Zhang B,Pan X,Cobb GP,et al.microRNAs as oncogenes and tumor suppressors[J].Dev Biol,2007,302(1):1-12.
[2] Du L,Schageman JJ,Subauste MC,et al.miR-93,miR-98,and miR-197 regulate expression of tumor suppressor gene FUS1[J].Mol Cancer Res,2009,7(8):1234-1243.
[3] Wong TS,Liu XB,Wong BY,et al.Mature miR-184 as potential oncogenic microRNA of squamous cell carcinoma of tongue[J].Clin Cancer Res,2008,14(9):2588-2592.
[4] Nikiforova MN,Tseng GC,Steward D,et al.MicroRNA expression profiling of thyroid tumors:biological significance and diagnostic utility[J].J Clin Endocrinol Metab,2008,93(5):1600-1608.
[5] Weber F,Teresi RE,Broelsch CE,et al.A limited set of human MicroRNA is deregulated in follicular thyroid carcinoma[J].J Clin Endocrinol Metab,2006,91(9):3584-3591.
[6] Wang T,Zhang X,Obijuru L,et al.A micro-RNA signature associated with race,tumor size,and target gene activity in human uterine leiomyomas[J].Genes Chromosomes Cancer,2007,46(4):336-347.
[7] Hamada S,Satoh K,Miura S,et al.miR-197induces epithelialmesenchymal transition in pancreatic cancer cells by targeting p120 catenin[J].J Cell Physiol,2013,228(6):1255-1263.
