超高压对α-CGTase 产物专一性的影响*
2013-08-12王田田周星柏玉香王金鹏谢正军金征宇
王田田,周星,柏玉香,王金鹏,谢正军,金征宇
(江南大学,食品组分与物性中心,江苏 无锡,214122)
环糊精葡萄糖基转移酶(CGTase,EC 2.4.1.19)是一种多功能性酶,属于α-淀粉酶家族。CGTase 可以同时催化4 种不同的反应,包括水解反应,环化反应,耦合反应,歧化反应[1,4]。利用CGTase 环化反应生产环糊精(CDs)是CGTase 的一种重要应用,随着环糊精在食品、医药等领域的应用越来越广,生产环糊精所必需的CGTase 越来越成为当今学者研究的热点[2-4]。然而利用CGTase 环化作用生产环糊精,得到的往往是α-CD,β-CD 及γ-CD3 种环糊精的混合产物,在工业生产中,产品的后续分离纯化操作复杂而耗时。因此,对CGTase 的产物专一性研究一直以来都是研究者们探究的热门课题[4-13]。荷兰格罗宁根大学的Dijkhuizen 团队以底物麦芽低聚糖中的葡萄糖基为参照,标记出了+2 ~-7 这9 个该酶与底物的结合亚位点[4,20-22](图1),确定了该CGTase 环化作用的主要产物与底物结合亚位点密切相关,只有当环化作用前伴随耦合反应时,才能产生其他种类的环状糊精。而根据CGTase 的酶与底物的结合模型分析,在CGTase 活性中心的底物结合位点附近存在一定的空间,反应过程中的生成受体糖苷储存在其中,导致耦合作用或歧化作用的发生,从而改变产物中3种环糊精的比例,影响产物专一性[15-16]。
综上可知,酶自身的结构的不同,以及反应过程中耦合歧化作用的发生,是影响CGTase 产物专一性的2 个重要因素。目前国内对于CGTase 产物专一性的研究大多集中于前者,通过抑制酶的耦合歧化作用来提高CGTase 产物专一性的研究目前还很少研究[17]。我们希望通过超高压作用压缩CGTase 底物结合位点附近空间大小,抑制耦合歧化作用的发生,最终提高CGTase 产物专一性。
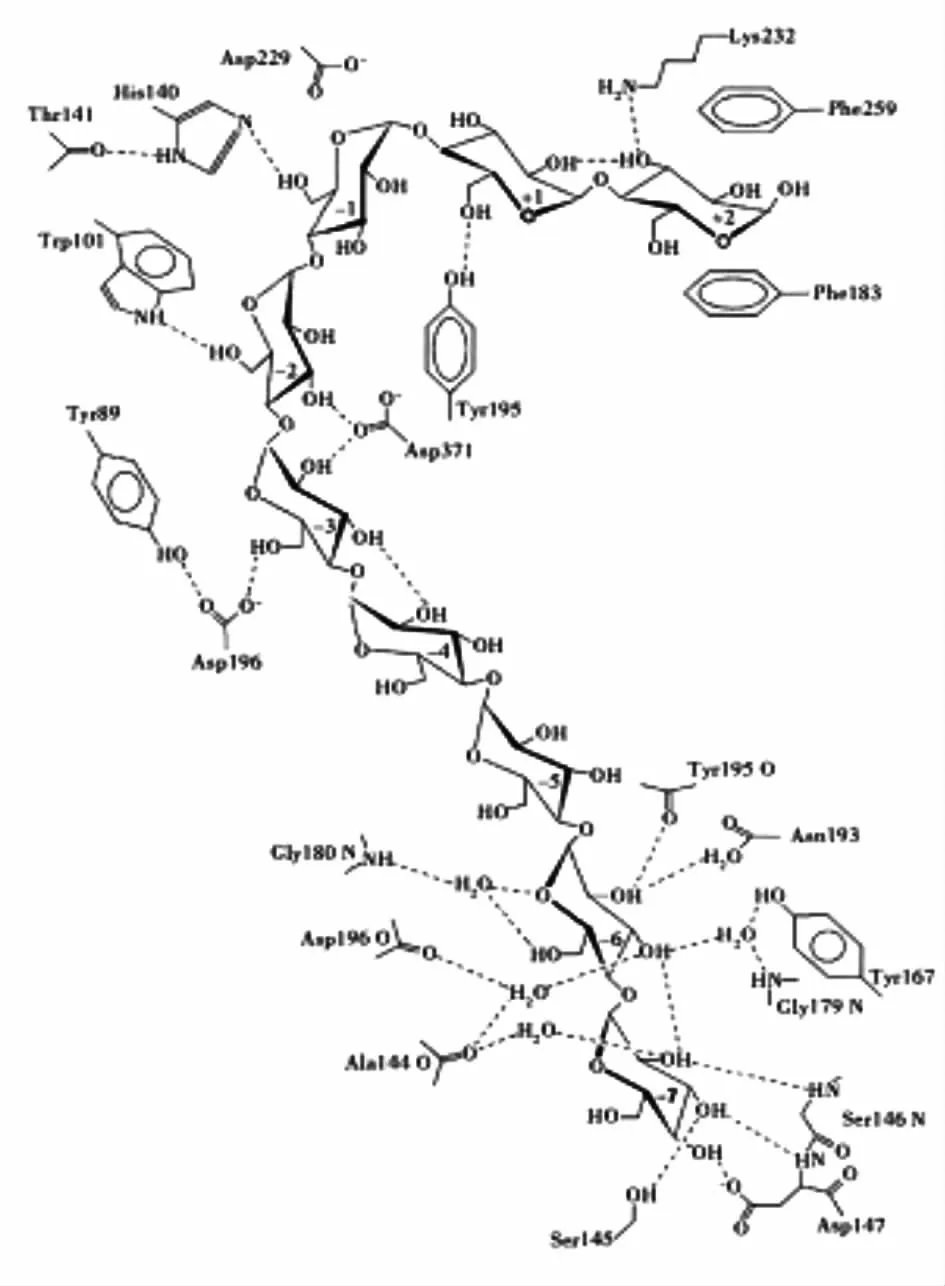
图1 来源于B. circulans 251 的CGT 酶与麦芽九糖抑制剂在活性位点上相互作用示意图[4,19]Fig.1 Schematic representation of the interactions between B. circulans strain 251 CGTase and a maltononaose at the active site[4,19]
食品超高压处理是指使用100 MPa 以上(100 ~1 000 MPa)的压力,在常温下或较低温度下对食品物料进行处理,从而达到灭菌、物料改性和改变食品某些理化反应速度的效果[18]。超高压能够影响非共价键的形成与破坏,但不破坏共价键,非共价键是维持酶分子高级结构的主要原因,因而超高压能够影响酶分子的高级结构[19]。
目前,还没有人研究超高压对CGTase 酶学性质及其产物专一性的影响。本研究旨在通过调整高压腔内介质的温度,压力,改变高压后酶反应的时间,探究高压过程对于α-CGTase 产物专一性的影响。
1 材料与方法
1.1 主要材料
软化芽孢杆菌α-CGTase,日本天野酶制品株式会社;α-CD、β-CD 及 γ-CD 标 准 样 品,SIGMAALDRICH 公司;可溶性淀粉,国药集团化学试剂有限公司;乙腈、超纯水均为色谱级;其他试剂均为分析纯。
1.2 实验设备
双光束紫外可见分光光度计(TU-1900),北京普析通用仪器有限责任公司;电热恒温水浴锅,上海浦东物理光学仪器厂;高效液相色谱仪(LC-20AT 230V),岛津公司;示差折光检测器(RID-10A),岛津公司;Hypersil NH2色谱柱(4.6 mm ×250 mm,5 μm APS-2 Hypersil 微粒),美国Thermo 公司;S-FL-085-09-W 超高压仪器,英国Stansted Fluid Power 公司。
2 实验方法
2.1 试样的准备
取一定量pH 6.0 磷酸缓冲液稀释的酶于2mL的甘油管中,保障甘油管中盛满酶液且残余气泡体积尽量少(防止高压过程中气泡的存在使得甘油管爆裂)。将甘油管4℃冰浴保存,等待高压处理或作为对照样等待检测酶活性。
为了避免实验数据受实验操作和酶的放置时间的影响,同批次试样均一次制作完成,放置在4℃的冰浴里,并在12 h 内高压处理完毕,处理后试样保存在4℃的冰箱里,在48 h 内完成过α-CGTase 活性检测。所有数据均为3 个试样测试后的平均值[23]。
2.2 超高压处理
高压处理:先将与超高压仪器相连的水浴锅设定到实验指定温度,待温度稳定20 min 后,将试样浸没于高压容器的传压介质中,按照实验设计,设定压力、保压时间等参数,进行超高压处理。
2.3 α-环化活力的测定
将适当稀释经高压处理过的α-CGTase 的酶液加入装有预先用50 mmol/L 磷酸缓冲液(pH 6.0)配制2 g/100 mL 可溶性淀粉溶液的试管中,充分混匀,在60 ℃反应10 min 后,沸水浴10 min 终止反应。以未经高压处理过的α-CGTase 做对照组进行反应。使用HPLC 测定产物中α-CD 含量。酶活力单位(U)定义为:在上述条件下每分钟生成1μmol α-环糊精所需的酶量[24-25]。
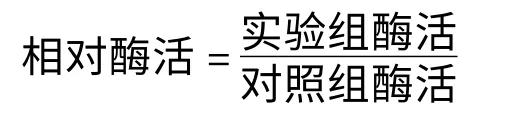
2.4 HPLC 法测定环糊精产量
采用HPLC 法进行酶产物分析。用磷酸盐缓冲溶液(pH6.0)配制2 g/100 mL 淀粉溶液,沸水浴中加热糊化10 min,冷却至反应温度后添加一定量的α-CGTase,充分混匀后在60 ℃、200 r/min 水浴摇床中反应一定时间,沸水浴10 min 灭酶后于12 000 r/min 离心20 min,上清液经0.45 μm 超滤膜过滤后取20μL 上机分析。采用HPLC 进行产物分析的色谱条件为:流动相为65%乙腈水溶液,流速1 mL/min;柱温40℃。
3 结果与分析
3.1 环糊精产量的HPLC 法测定
利用HPLC 对反应产物中α-CD,β-CD,γ-CD 进行检测,如图2 所示,α-CD,β-CD,γ-CD 3 种环糊精的出峰位置分别为7.557,8.709,10.369。
反应得率:
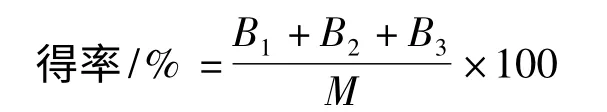
产物专一性:
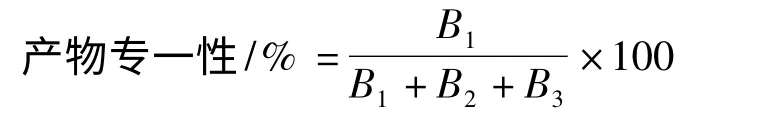
其中,B1,B2,B3分别表示α-CD,β-CD,γ-CD 的含量,mg/mL;M 表示参与反应的总淀粉的含量,mg/mL。
3.2 压力对α-CGTase 环化反应的影响
为了探究α-CGTase 在不同高压下的变化特性,在40 ℃、保压10 min、酶液pH 值为6.0 的条件下,进行5 种压力(100、200、300、400 和500 MPa)的高压处理,对照组为常压(0.1 MPa)40 ℃水浴10 min 后的酶。α-CGTase 催化淀粉反应10 h,利用HPLC 测得环糊精含量,从而得到压力对α-CGTase 产物专一性的影响,实验结果如表1 所示。

图2 α-CGTase 催化淀粉反应产物中的α-,β-,γ-CD 的液相图Fig.2 HPLC chromatogram of α-,β-,γ-CD from starch catalyzed by α-CGTase

表1 不同压力对于α-CGTase 的影响Table 1 Effect of different pressures on α-CGTase
由表1 可见,在40 ℃下,用不高于200 MPa 的压力处理CGTase,α-CGTase 的环化活力有一定的升高,当压力≥300 MPa,随着压力增大酶迅速失活;而随着压力的增大,α-CGTase 的产物专一性均有明显的提高;产物得率则随压力的升高而逐渐降低。推测造成以上现象的原因可能是:在40 ℃和200 MPa 左右的较低压力下,高压作用主要对酶起到压缩效应,改变酶蛋白的非共价结构,没有破坏酶蛋白骨架结构[18-19],对酶的环化活力有一定的增强作用,随着压力的逐渐增大,酶蛋白结构遭到破坏,酶逐渐失活;而高压过程导致α-CGTase 底物结合位点附近空间被压缩,反应过程中的耦合作用和歧化作用受到抑制,酶环化反应产物专一性得到增强。
3.3 温度对α-CGTase 环化反应的影响
为了考察α-CGTase 超高压处理时温度对酶环化反应的影响,实验设定压力为200 MPa、酶液pH 值6.0(酶的最适PH),保压10 min 的条件下,进行5 种保压温度(25、40、50、60 和70 ℃)的高压处理,对照组为常压(0.1 MPa)相应温度水浴10 min 的α-CGTase。α-CGTase 催化淀粉反应10 h,利用HPLC 测得环糊精含量,从而得到温度对α-CGTase 产物专一性的影响。实验结果如表2 所示。

表2 不同温度下高压对于α-CGTase 的影响Table 2 Effect of pressures on α-CGTase at different tempreture
由表2 可以看出,在200 MPa 下,不同温度处理α-CGTase 后,其环化活力随温度升高而降低,25℃时环化活力最大;而产物专一性随着温度的升高先增大后减小,在40℃时最大为55.9%;产物得率随着温度的升高在不断减小。由此可以推断,在200 MPa 低温(≦40℃)处理酶后,高压对于α-CGTase 底物结合位点附近空间有压缩效应,可以一定程度地抑制反应过程中的耦合作用和歧化作用,从而提高产物专一性;200 MPa 和较高温度(>40℃)作用后,由于温度与高压的协同作用,酶的结构发生破坏,环化反应减弱且产物专一性变差。而由于高压与温度的协同作用,破坏酶底物结合中心蛋白质的高级结构[18-19],使得α-CGTase 与淀粉的结合能力变弱,α-CGTase 得率随着温度的升高而下降。
3.4 高压后反应时间对α-CGTase 产物专一性的影响
由于α-CGTase 催化淀粉反应过程中,随着反应时间的不同,各种催化作用的强弱也各不相同,最终导致3 种环糊精比例随反应时间不同而不同[15-16]。为了进一步探究超高压对于α-CGTase 产物专一性影响,通过将超高压处理后的α-CGTase 设置不同的反应时间,来探究不同压力作用于α-CGTase 后该酶产物专一性的变化。实验设定保压温度为40℃、酶液pH 值为6.0(酶的最适pH),保压时间为10 min 的条件下,进行5 种压力(100、200、300、400 和500 MPa)的高压处理,对照组为常压(0.1 MPa)40℃水浴10 minα-CGTase。高压处理α-CGTase 后,酶与淀粉的反应时间分别为10 min,1 h,10 h。超高压处理酶后不同反应时间对α-CGTase 产物专一性的影响如图3 所示,产物得率的变化规律如图4 所示。
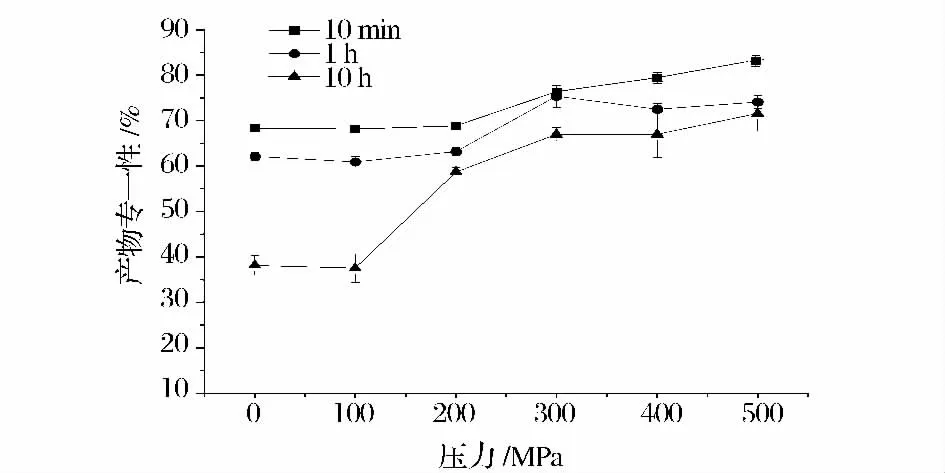
图3 高压后的α-CGTase 在不同反应时间下产物专一性的变化Fig.3 The changes of product specificities of α-CGTase treated by various pressures at different reaction times
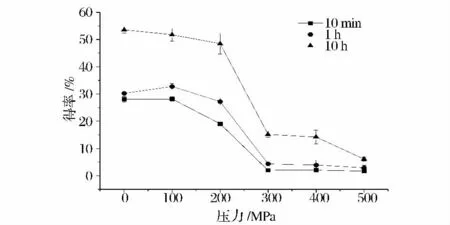
图4 不同高压处理后的α-CGTase 在不同反应时间下产物得率的变化Fig.4 The changes of production yields of α-CGTase treated by various pressures at different reaction times
由图3 可知,随着反应时间的延长,α-CGTase 产物专一性不断降低;在相同反应时间下,产物专一性随着处理α-CGTase 的压力增大而提高。由图4 可知,随着处理α-CGTase 压力的增大,α-CGTase 催化淀粉反应产物得率不断降低;而随着α-CGTase 催化淀粉反应时间的延长,α-CGTase 催化淀粉反应产物得率不断提高。这是由于α-CGTase 催化淀粉反应是一个动态的多催化作用反应过程,α-CGTase 同时发挥这4 种催化作用,尤其是在反应的后期,反应体系中有多种底物存在,耦合歧化作用增强,因此反应时间越长,产物的专一性越低,同时产物的得率越高。
4 结论
超高压处理α-CGTase,随着压力的增大,α-CGTase 的环化活力先有一定的升高,然后快速降低,且不论反应时间的长短,在同一反应时间下,产物专一性均随压力增大而不断提高,在500 MPa 时催化淀粉反应10 h,产物专一性将达到71.75%,但产物的得率均随着压力提高而减小。在200 MPa 下,不同温度处理α-CGTase 后,其环化活力随温度升高而降低,25℃时环化活力最大,为62.49 U/ mL;而产物专一性随着温度的升高先增大后减小,在40℃时最大为55.9%;产物得率随着温度的升高在不断减小。此外,在相同高压条件下,产物专一性随反应时间延长而降低,产物得率随反应时间延长而增大。本文主要讨论了不同压力,温度下高压处理α-CGTase 后环化反应产物专一性的变化,以及高压过后不同的反应时间下酶产物专一性的变化,对于高压处理后酶结构的变化还需进一步研究。
[1] Van der Veen B,van Alebeek G,Uitdehaag J,et al. The three transglycosylation reactions catalyzed by cyclodextrin glycosyltransferase from Bacillus circulans (strain 251)proceed via different kinetic mechanisms[J]. European Journal of Biochemistry,2000,267(3):658 -665.
[2] Li Z F,Wang M,Wang F,et al.γ-Cyclodextrin:a review on enzymatic production and applications[J].Applied Microbiology Biotechnology,2007,77(2):245 -255.
[3] van de Manakker F,Vermonden T,van Nostrum C F,et al. Cyclodextrin-based polymeric materials:synthesis,properties,and pharmaceutical/biomedical applications[J]. Biomacromolecules,2009,10(12):3157 -3175
[4] 李兆丰,顾正彪,堵国成,等. 环糊精葡萄糖基转移酶的结构特征与催化机理[J]. 中国生物工程杂志,2010,30(6):144 -150
[5] Tonkova A. Bacterial cyclodextrin glucanotransferase[J].Enzyme and Microbial Technology,1998,22(8):678-686.
[6] Li Z F,Zhang J Y,Sun Q,et al. Mutations of lysine 47 in cyclodextrin glycosyltransferase from Paenibacillus macerans enhance β-cyclodextrin specificity[J]. Journal Agricultural and Food Chemistry,2009,57(18):8 386-8 391.
[7] Li Z F,Zhang J Y,Wang M,et al. Mutations at subsite-3 in cyclodextrin glycosyltransferase from Paenibacillus macerans enhancing α-cyclodextrin specificity[J]. Applied Microbiology and Biotechnology,2009,83(3):483-490.
[8] Kelly R M,Dijkhuizen L,Leemhuis H. The evolution of cyclodextrin glucanotransferase product specificity[J]. Applied Microbiology Biotechnology,2009,84(1):119 -133.
[9] 丁闰蓉,李兆丰,李金根,等. 表面活性剂对大肠杆菌胞外生产α-环糊精葡萄糖基转移酶的影响[J]. 中国生物工程杂志,2009,29(7):61 -66.
[10] 李兆丰. 软化类芽孢杆菌α-环糊精葡萄糖基转移酶在大肠杆菌中的表达及其产物特异性分析[D]. 无锡:江南大学,2009.
[11] Leemhuis H,Kelly RM,Dijkhuizen L. Engineering of cyclodextrin glucanotransferases and the impact for biotechnological applications[J]. Applied Microbiology and Biotechnology,2010,85(4):823 -835.
[12] 曹新志,金征宇. 环糊精包合物的制备方法[J]. 食品工业科技,2003,24(10):158 -160.
[13] 曹新志,金征宇. 环糊精葡萄糖基转移酶高产菌株的快速筛选[J]. 中国粮油学报,2003,18(6):53 -55.
[14] Penninga D,van der Veen B,Knegtel R,et al. The raw starch binding domain of cyclodextrin glycosyltransferase fom Bacillus circulans strain 251[J]. Journal of Biological Chemistry,1996,271(51):32 777 -32 784.
[15] Uitdehaag J,Kalk K,van der Veen B,et al. The cyclization mechanism of cyclodextrin glycosyltransferase as revealed by a γ-cyclodextrin-CGTase complex at 1.8Å resolution[J]. Journal of Biological Chemistry,1999,274(49):34 868 -34 876.
[16] Schmidt A,Cottaz S,Driguez H,et al. Structure of cyclodextrin glycosyltransferase complexed with a derivative of its main product β-cyclodextrin[J]. Biochemistry,1998,37(17):5 909 -5 915
[17] Ramli N,Abd-Aziz S,Hassan M,et al. Potential cyclodextrin glycosyltransferase producer from locally isolated bacteria[J]. African Journal of Biotechnology,2010,9(43):7 317 -7 321.
[18] 陈复生. 食品超高压加工技术[M]. 北京:化学工业出版社,2005.
[19] Zhengyu Jin,Xiuting Hu,Xueming Xu,et al. Retrogradation properties of rice starch gelatinized by heat and high hydrostatic pressure (HHP)[J]. Journal of Food Engineering,2011,106(3):262 -266.
[20] Strokopytov B,Knegtel R M,Penninga D,et al.Structure of cyclodextrin glycosyltransferase complexed with a maltononaose inhibitor at 2.6 angstrom resolution. Implications for product specificity[J]. Biochemistry,1996,35(13):4 241 -4 249.
[21] Bender H. Studies of themechanism of the cyclisation reaction catalysed by the wild type and a truncated α-cyclodextrin glycosyltransferase from Klebsiella pneumoniae strain M5 al and the β-cyclodextrin glycosyltransferase from Bacillus circulans strain 8[J]. Carbohydrate Research,1990,206(2):257 -267.
[22] Wind R D,Uitdehaag J C M,Buitelaar R M,et al,Engineering of cyclodextrin product specificity and pH optima of the thermostable cyclodextrin glycosyltransferase from Thermoanaerobacterium thermosulfurigenes EM1[J].The Journal of Chemical Physics,1998,273(10):5 771-5 779.
[23] 曾庆梅,潘见,谢慧明,等. 超高压处理对多酚氧化酶活性的影响[J]. 高压物理学报,2004,18(2).
[24] Lejeune A,Sakaguchi K,Imanaka T.A spectrophotometric assay for the cyclization activity of cyclomaltohexaose(α-cyclodextrin)glucanotransferase[J]. Analytical Biochemistry,1989,181(1):6 -11.
[25] 刘虹,顾正彪,洪雁,等.甲基橙褪色分光光度法定量测定α-环糊精[J].中国粮油学报,2008,23(5):1 773 -1 776.
