壳聚糖对克氏原螯虾生长、血清相关免疫因子、肌肉成分和消化酶的影响
2013-08-07任秀芳周鑫赵朝阳水燕徐增洪沈怀舜张萍柏爱旭
任秀芳,周鑫,赵朝阳,水燕,徐增洪,沈怀舜,张萍,柏爱旭
(1.上海海洋大学水产与生命学院,上海201306;2.中国水产科学研究院淡水渔业研究中心,江苏无锡214081)
壳聚糖对克氏原螯虾生长、血清相关免疫因子、肌肉成分和消化酶的影响
任秀芳1、2,周鑫2,赵朝阳2,水燕2,徐增洪2,沈怀舜2,张萍1、2,柏爱旭1、2
(1.上海海洋大学水产与生命学院,上海201306;2.中国水产科学研究院淡水渔业研究中心,江苏无锡214081)
以体质量为 (21.55±1.62)g的克氏原螯虾Procambarus clarkii为研究对象,投喂壳聚糖添加量分别为0(对照)、0.5%、1.0%、1.5%、2.0%、3.0%的饲料,研究壳聚糖对克氏原螯虾生长、血清相关免疫因子、肌肉成分和消化酶活性的影响。试验共进行60 d。结果表明:1.0%壳聚糖添加组试验虾的特定生长率显著高于其他各组 (P<0.05),1.5%壳聚糖添加组试验虾的死亡率和蜕壳死亡率均最高,且显著高于对照组 (P<0.05);1.0%和2.0%壳聚糖添加组试验虾血清中的酚氧化酶 (PO)活性显著高于对照组(P<0.05),各添加组血清中碱性磷酸酶 (ALP)活性均显著高于对照组 (P<0.05);除1.0%、2.0%壳聚糖添加组外,其他添加组血清中谷丙转氨酶 (ALT)活性均低于对照组;各添加组血清中谷草转氨酶(AST)的活性均显著低于对照组 (P<0.05);除2.0%壳聚糖添加组外,其他添加组试验虾肌肉粗蛋白质含量较对照组均低;除2.0%壳聚糖添加组外,其他添加组粗脂肪含量较对照组均高,其中1.0%、1.5%和3.0%添加组显著高于对照组 (P<0.05);仅1.0%添加组肌肉灰分显著低于对照组 (P<0.05);仅2.0%添加组肌肉水分含量显著高于对照组 (P<0.05);1.0%添加组试验虾肝胰腺中胰蛋白酶和脂肪酶活性以及肠道中的脂肪酶活性显著高于对照组 (P<0.05);1.5%添加组试验虾肝胰腺和肠道中的淀粉酶活性均显著高于对照组 (P<0.05)。研究表明,在本试验条件下,建议成虾饲料中壳聚糖的添加量为0.5% ~1.5%,壳聚糖对克氏原螯虾起到一定的免疫保护作用,并能增强其消化生理机能。
克氏原螯虾;壳聚糖;酚氧化酶;消化酶;肌肉成分
壳聚糖是由甲壳素脱钙、去除脂肪和蛋白后脱乙酰基得到的一种带正电荷的高分子碱性多糖。通常将脱乙酰度为55%以上的甲壳素称作壳聚糖,由于壳聚糖成纤成膜性能好,能与动物的器官、组织和细胞有良好的生物相容性,没有免疫原性,并具有生物可降解性和可被吸收利用性等特点,在医药、环保、农业、饲料、水产等领域已被广泛应用。在水产养殖中,壳聚糖作为促生长剂添加到罗非鱼Oreochromis niloticus饲料中,通过提高罗非鱼肠道和肝胰腺的蛋白酶、淀粉酶和肝脏极低密度脂蛋白的活性,增强机体对营养物质的消化吸收和脂肪转化[1],从而达到促生长的作用。同时,壳聚糖作为免疫增强剂,可保护鲑科鱼类免遭细菌性疾病的侵染[2-3];增强乌颊鱼SparusaurataL.的呼吸暴发和吞噬细胞活性[4-5];可在短期内提高感染了溶藻弧菌的凡纳滨对虾Litopenaeus vannamei的存活率、血细胞数、呼吸暴发和吞噬细胞活性[6]。目前,壳聚糖用在经济甲壳动物中的研究报道较少。本研究中,通过在克氏原螯虾Procambarus clarkii基础饲料中添加一定量的壳聚糖,并检测克氏原螯虾摄食60 d后相关免疫因子的活性、消化酶活性和肌肉营养成分的变化,以探讨壳聚糖对促进克氏原螯虾生长及增强非特异性免疫功能的影响,旨在为壳聚糖在虾蟹养殖与饲料生产中的应用提供科学依据。
1 材料与方法
1.1 材料
试验用克氏原螯虾取自江苏盱眙恒旭科技有限公司,样品虾用基础饲料驯化,暂养10 d后用于试验。
阿拉丁®壳聚糖购自上海晶纯实业有限公司,为白色粉末,其相对分子质量为1 000 000,脱乙酰度≥95%,水分<8%,灰分<1%。
试验用饲料配方及营养成分见表1。

表1 基础配方的原料配比及营养水平(干物质基础)Tab.1 Ingredient and nutrition level of basal diet(dry matter) w/%
将试验原料粉碎,过60目筛,混合均匀,制成基础饲料。在基础饲料中分别添加质量分数为0、0.5%、1.0%、1.5%、2.0%、3.0%的壳聚糖,制成6种试验饲料,饲料配方组分用糊精调平。饲料颗粒直径为2 mm,自然晒干,置于-15℃下冷冻保存。
1.2 方法
1.2.1 试验设计 试验分为6组,每组设3个平行。取体色正常、大小均匀、附肢完好、健康活泼、体质量为 (21.55±1.62)g的克氏原螯虾,随机分配到18个水族箱 (100 cm×50 cm×50 cm)中,每箱放虾15只。水族箱水深15~20 cm,放入树枝和易拉罐作为隐蔽物。试验开始前和结束后均饥饿1 d,每日8:00和19:00投喂,投喂量为虾体质量的2% ~3%,根据摄食情况加以调整。试验期间,保持溶解氧≥6.0 mg/L,pH为7.5~8.0,水温为 (22±1)℃。饲养期为60 d,用增氧泵连续充气,每天换充分曝气的自来水1/3~1/2,用皮管虹吸出残饵和排泄物。
1.2.2 样品的采集与制备
1)生长指标的测定与计算。试验结束后用电子天平称量克氏原螯虾的体质量,试验过程中记录各组虾的死亡数和蜕壳死亡数。生长指标的计算公式如下:
特定生长率(%/d)=100×[ln(末均体质量)-ln(初均体质量)]/饲养天数,
死亡率(%)=100×(死亡虾总数/虾总数),
蜕壳死亡率(%)=100×(蜕壳死亡数/虾总数)。
2)血清的制备。试验结束后,从各组随机选取克氏原螯虾5尾,用滤纸吸干虾体水分,用1 mL的一次性注射器从虾的头胸甲后部刺入心脏,抽取血液,放入离心管内,置于冰箱 (4℃)中过夜,用冷冻离心机以5 000 r/min离心10 min,取上清液放入冰箱 (-20℃)中备用,24 h内测定。用迈瑞全自动生化分析仪BS-400测定血清中碱性磷酸酶、谷丙转氨酶和谷草转氨酶的活性。
3)粗酶液的制备。试验结束后,从各试验组随机选取克氏原螯虾6尾,用滤纸吸干虾体水分,取其肝胰腺和全肠,用去离子水清洗肠道内容物。每两尾虾的部分肝胰腺或全肠作为一个样本。将每个样本称重,置于玻璃匀浆器中,用移液器移取9倍于组织块的预冷匀浆介质 (pH 7.4,0.01 mol/L Tris-HCl,0.000 1 mol/L EDTA-2Na,0.01 mol/L蔗糖,0.8%的氯化钠溶液),充分匀浆后,用低温低速离心机以2 000 r/min离心10 min,取上清液即为粗酶液,于4℃下保存,24 h内测定。
4)肌肉样品的采集。将采集完血液和肝肠后的克氏原螯虾去除头胸甲和背甲,取虾肉剪碎,混合均匀,置于冰箱 (-20℃)中保存备用。
1.2.3 酚氧化酶的测定 综合王建国等[7]和Huang等[8]的方法,以0.1 mol/L的磷酸钾盐缓冲液 (将61.9mL 0.1mol/L KH2PO4溶液和38.1mL 0.1 mol/L K2HPO4溶液混合,稀释至1 L,调pH为6.6)为溶剂,配制浓度为3 mg/mL的L-DOPA (Sigma公司产品)溶液。室温下将40μL血清和1 960μL L-DOPA溶液混匀,置于1 cm光径的比色杯中,准确计时6 min时,于490 nm波长下测定吸光值OD,同时取2 mL L-DOPA溶液作为空白测定其吸光值OD0。酚氧化酶活性定义为:每毫升样品每分钟吸光度值增加0.001为一个酶活力单位(U)。
1.2.4 消化酶的测定 胰蛋白酶、淀粉酶和脂肪酶的活性均采用试剂盒 (南京建成生物工程研究所产品)测定[9]。于37℃水浴锅中水浴,用紫外分光光度计读取OD值。
于253 nm波长下读取胰蛋白酶反应体系中的OD值。胰蛋白酶活性定义为:在37℃条件下,每毫克蛋白中含有的胰蛋白酶每分钟使吸光度变化0.003即为一个酶活力单位 (U)。
于660 nm波长下读取淀粉酶反应体系中的OD值。淀粉酶活性定义为:7℃条件下,每毫克组织蛋白与底物作用30 min,水解10 mg淀粉为一个淀粉酶活力单位 (U)。
于420 nm波长下读取脂肪酶反应体系中的OD值。脂肪酶活性定义为:37℃条件下,每毫克组织蛋白与底物作用1 min,每消耗1μmol底物为一个酶活力单位 (U)。
1.2.5 肌肉常规营养成分的测定 采用常压干燥法测定水分含量,采用凯氏定氮法测定肌肉粗蛋白质含量,采用索氏抽提法测定粗脂肪含量,采用干灰化法测定灰分含量。
1.3 数据处理
试验数据均用平均值±标准误表示,用 SPSS 17.0软件对试验数据进行单因素方差分析 (Oneway ANOVA),用Duncan法进行多重比较,显著性水平设为0.05。
2 结果与分析
2.1 克氏原螯虾摄食不同含量壳聚糖饲料时的特定生长率和死亡率
从表2可见:试验结束时,各组克氏原螯虾平均体质量均无显著性差异 (P>0.05);各组试验虾的特定生长率、死亡率、蜕壳死亡率随着壳聚糖添加量的增加均呈先升高后降低的趋势,其中添加水平为1.0%的组试验虾特定生长率最高,显著高于除0.5%添加组外的其余各组 (P<0.05);添加水平为0.5%的组试验虾死亡率最低,显著低于其余各组 (P<0.05);添加水平为1.5%的组试验虾蜕壳后死亡率最高,显著高于其余各组 (P<0.05)。
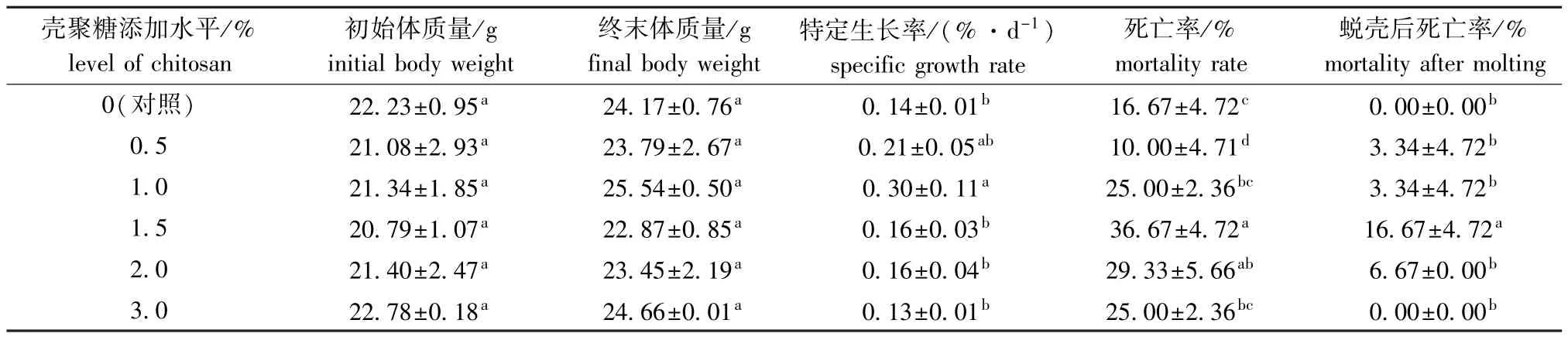
表2 壳聚糖对克氏原螯虾特定生长率和死亡率的影响Tab.2 Effects of dietary chitosan supplemention on specific grow th rate and mortality rate in red swamp crayfish Procambarus clarkii
2.2 克氏原螯虾摄食不同含量壳聚糖饲料时血清中的相关免疫因子
从表3可见:饲料中壳聚糖添加水平为1.0%和2.0%的组试验虾血清中酚氧化酶 (PO)活性均较高,显著高于对照组 (P<0.05),而添加水平为0.5%、3.0%的组PO活性显著低于对照组和其余添加组 (P<0.05);壳聚糖添加组试验虾血清中的碱性磷酸酶 (ALP)活性均显著高于对照组(P<0.05),其中添加水平为0.5%、2.0%的组ALP活性均较高;添加水平为2.0%的组血清中谷丙转氨酶 (ALT)活性最高,显著高于对照组(P<0.05),其中添加水平为1.0、1.5、3.0的组ALT活性均显著低于对照组 (P<0.05);壳聚糖添加组试验虾血清中的谷草转氨酶 (AST)活性均显著低于对照组 (P<0.05)。
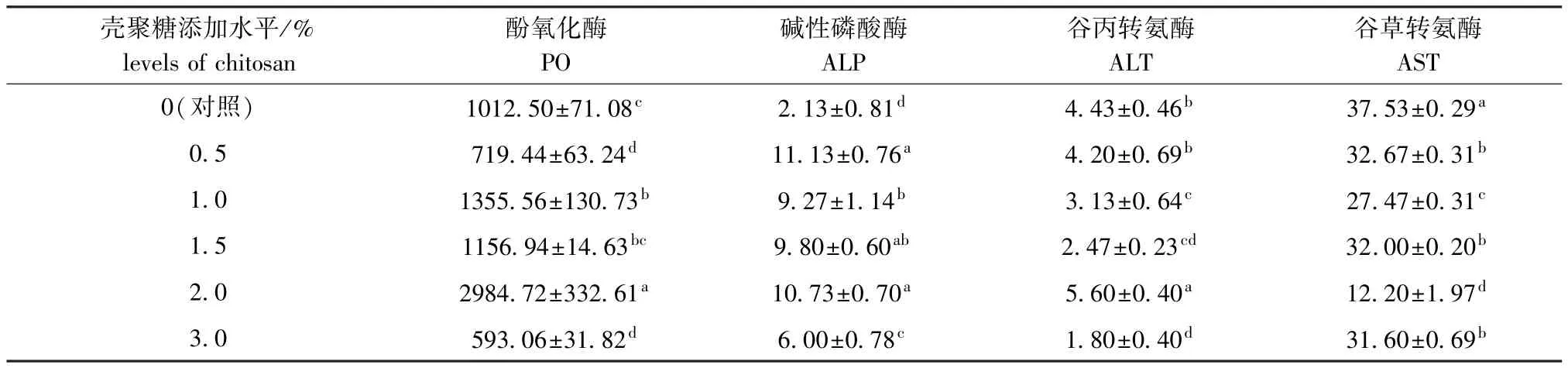
表3 壳聚糖对克氏原螯虾血清中相关非特异性免疫因子的影响Tab.3 Effects of dietary chitosan supplemention on non-specific immune factors in red swamp crayfish Procambarus clarkiiU/mL
2.3 克氏原螯虾摄食不同含量壳聚糖饲料时的肌肉营养成分
从表4可见:对照组试验虾肌肉的粗蛋白质含量最高,除与壳聚糖添加水平为2.0%的组差异不显著 (P>0.05)外,与其他添加组均有显著性差异 (P<0.05);添加水平为1.0%、1.5%和3.0%的组试验虾肌肉粗脂肪含量均较高,且显著高于对照组 (P<0.05),分别较对照组提高了7.69%、7.69%和10.26%;添加水平为1.0%的组试验虾肌肉灰分含量最低,且显著低于对照组 (P<0.05),较对照组降低了3.57%,其余添加组均与对照组无显著性差异 (P>0.05);添加水平为0.5%、2.0%的组试验虾肌肉水分含量均较高,且显著高于对照组 (P<0.05)。

表4 壳聚糖对克氏原螯虾肌肉营养成分的影响 (湿质量)Tab.4 Effects of dietary chitosan supp lem ention on muscle composition in red swam p crayfish Procambarus clarkii w/%
2.4 克氏原螯虾摄食不同含量壳聚糖饲料时肝胰腺和肠道中的消化酶活性
从表5可见:壳聚糖添加组试验虾肝胰腺中的胰蛋白酶活性均显著高于对照组 (P<0.05),其中添加水平为1.0%的组胰蛋白酶活性最高;添加水平为0.5%、1.5%和2.0%的组试验虾肠道中的胰蛋白酶活性均显著高于对照组 (P<0.05),添加水平为1.0%、3.0%的组胰蛋白酶活性均显著低于对照组 (P<0.05);添加水平为1.5%的组试验虾肝胰腺和肠道中的淀粉酶活性均最高,且显著高于对照组 (P<0.05);添加水平为1.0%的组试验虾肝胰腺和肠道中的脂肪酶活性均最高,且显著高于对照组 (P<0.05)。
3 讨论
3.1 壳聚糖对克氏原螯虾特定生长率和死亡率的影响
本试验中,克氏原螯虾的特定生长率呈先升高后降低的趋势,以1.0%壳聚糖添加组最高,其次是0.5%添加组。各组特定生长率的变化不明显,原因是所用试验虾均为成虾 (壳聚糖对克氏原螯虾的生长是否存在影响,用幼虾进行试验才能说明,另文报道)。当壳聚糖添加水平为1.5%时,死亡率显著高于其他各组 (除2.0%添加组外)。添加水平为0.5% ~2.0%时,都存在蜕壳后软壳虾的死亡现象,当添加水平为3.0%时死亡率与对照组相同,均为0。有报道表明,甲壳动物可利用饲料中的甲壳素,使其在蜕壳前期几丁质酶达到最高[10],从而促成蜕壳生长;而壳聚糖是甲壳素脱乙酰基后的多糖类产物,本试验结果表明,一定量的壳聚糖被克氏原螯虾吸收利用后可促进其几丁质酶的分泌,使其顺利蜕壳生长。饲料中壳聚糖添加水平为0.5% ~2.0%时,克氏原螯虾蜕壳后死亡率呈先升高后降低的趋势,其中添加水平为1.5%时克氏原螯虾蜕壳率最高,同时死亡率也高于其他各组,这与蜕壳后的软壳虾抵抗力弱,易受到其他虾的干扰和残食有关。而对照组和3.0%添加组的克氏原螯虾死亡率为0,这可能与对照组未添加壳聚糖,对克氏原螯虾的蜕壳促进作用小,蜕壳少,受到环境和其他虾的干扰少有关;3.0%添加组则可能是由于过量添加的壳聚糖吸附了饲料中的蛋白质,导致克氏原螯虾消化吸收能力下降[11-12],从而抑制了其蜕壳,使自残率降低。考虑到壳聚糖对几丁质酶分泌有促进作用,建议在克氏原螯虾成虾饲料配方中将壳聚糖的添加水平控制在0.5% ~1.5%。
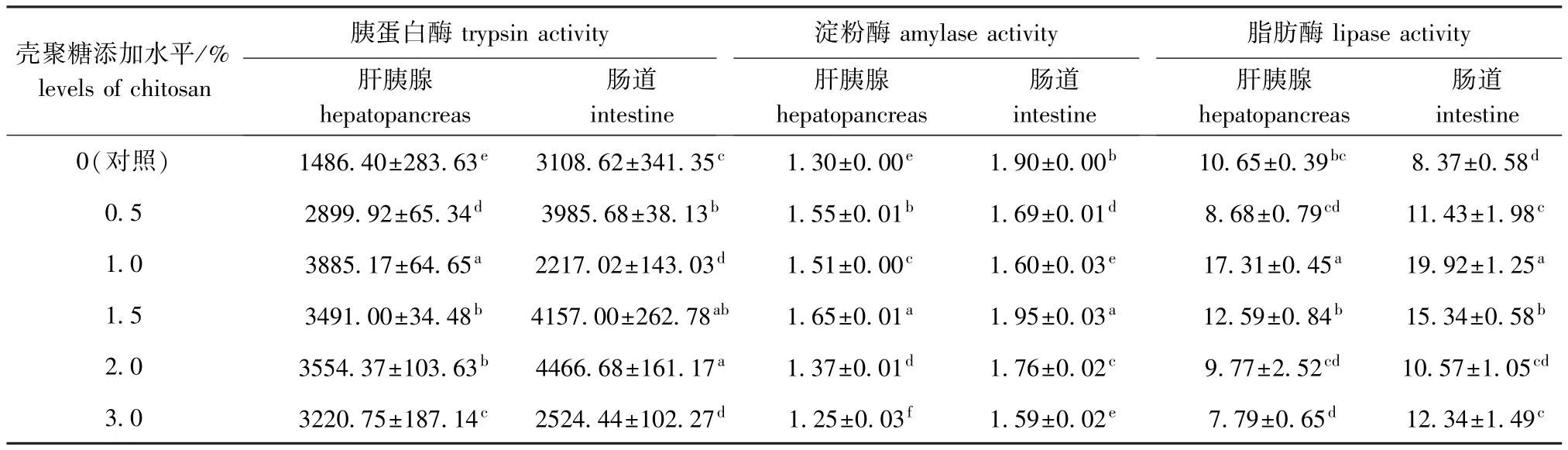
表5 壳聚糖对克氏原螯虾肝胰腺和肠道中消化酶活性的影响Tab.5 Effects of dietary chitosan supplemention on digestive enzyme activities in hepatopancreas and intestine in red swamp crayfish Procambarus clarkiiU/mg
3.2 壳聚糖对克氏原螯虾血清中相关免疫因子的影响
本研究中,1.0%~2.0%壳聚糖添加组克氏原螯虾的PO活性较对照组均有所升高,其中2.0%添加组的PO活性显著高于其他各组,说明壳聚糖可能会激活克氏原螯虾的酚氧化酶原 (proPO)系统,proPO被激活后产生一种酶[13],即酚氧化酶。已有研究表明,甲壳动物的PO参与宿主的防御反应,一些多糖类物质能激活proPO活化系统中的丝氨酸蛋白酶,从而活化PO[14-16]。ALP是甲壳动物机体防御能力的重要组成部分,也是吞噬细胞杀菌的物质基础[17-18],本试验中,壳聚糖添加组试验虾血清中的ALP活性均显著高于对照组,3.0%添加组的ALP活性显著低于其他添加组,但仍比对照组高,这与陈国福等[19]用A3α肽聚糖 (PG)拌饵投喂凡纳滨对虾60 d时,饲喂0.05%PG的对虾血清中的ALP活性最高,而0.10%PG组的ALP活性下降的结论相类似。从本试验结果看出, 1.0%~2.0%添加组的PO和ALP的活性均比较高,对克氏原螯虾的免疫增强效果较好,说明壳聚糖可能会提高克氏原螯虾抵抗外界病原菌的防御能力,降低死亡率。而1.0% ~2.0%添加组克氏原螯虾的死亡率却较对照组高,这可能与该添加量具有刺激几丁质酶的分泌,克氏原螯虾蜕壳率较高,蜕壳后软壳虾被残食有关。
本试验饲料中添加壳聚糖对克氏原螯虾血清中ALT和AST活性的影响显著,除壳聚糖添加量为2.0%的试验组ALT显著高于对照组以及0.5%添加组ALT与对照组无显著性差异外,其他添加组克氏原螯虾血清中的ALT和AST均显著低于对照组。ALT和AST是广泛存在于动物的细胞膜、细胞质和线粒体中的重要氨基酸转氨酶,常用来作为脊椎动物以及对虾肝胰腺功能的评估因子[20]。本试验结果表明,饲料中添加壳聚糖可能对克氏原螯虾的肝胰腺等组织起到了一定的保护作用,而2.0%添加组的ALT较高,可能是试验中操作误差造成的。
3.3 壳聚糖对克氏原螯虾肌肉营养成分的影响
一般来说,鱼肉水分含量高,则粗蛋白质、粗脂肪含量将会减少,鱼肉品质就差;反之,鱼肉水分含量低,则粗蛋白质、粗脂肪含量就高,鱼肉品质就好[21]。本试验结果表明,壳聚糖添加组肌肉水分和灰分含量的变化不大,但蛋白质含量略有下降,脂肪含量却相应升高,这与华雪铭等[22]在暗纹东方鲀饲料中单独添加壳聚糖、益生菌和混合物的试验组蛋白质含量普遍升高,脂肪含量普遍降低的结论不相一致。出现上述差异的原因是:壳聚糖的葡聚糖胺链中带有4价铵离子,具有较高的阴离子交换能力,从而使带正电性的壳聚糖能与带负电性的胆汁酸结合并排出体外,阻止胆汁酸循环,这样可使食物中的脂肪不被乳化,减少脂肪的消化吸收,从而减少脂肪的沉淀积累[23]。鱼类属于脊椎动物,食物中的脂肪由胆囊分泌的胆汁酸进行消化,壳聚糖与脊椎动物胆囊分泌的胆汁酸结合阻碍了脂肪的消化,进而降低了鱼体脂肪的含量。而克氏原螯虾为无脊椎动物,食物中的营养物质由肝胰腺及消化道分泌的消化酶进行消化,本试验中壳聚糖添加组克氏原螯虾肌肉中的脂肪含量升高,与添加壳聚糖后克氏原螯虾的脂肪酶升高相符合,说明壳聚糖能降低鱼类肌肉脂肪含量的结论可能不适用于无脊椎动物。
3.4 壳聚糖对克氏原螯虾肝胰腺及肠道中消化酶的影响
本试验结果表明,各壳聚糖添加组消化酶活性大体上随着壳聚糖添加量的增加呈现先升高后降低的趋势,1.0%添加组克氏原螯虾肝胰腺中的胰蛋白酶活性最高,较对照组提高了161.38%;1.5%和2.0%添加组肠道中的胰蛋白酶活性均较高,分别较对照组提高了33.72%和43.69%;1.0%组试验虾肝胰腺和肠道中的脂肪酶活性分别较对照组提高了62.54%和137.99%;1.5%添加组虾肝胰腺和肠道中的淀粉酶活性均最高,分别较对照组提高了26.92%和2.63%,说明壳聚糖提高了克氏原螯虾的消化酶活性。这与华雪铭等[22]在暗纹东方鲀幼鱼的饲料中添加0.2%的壳聚糖能显著提高肠道淀粉酶活性的结果相似,原因是壳聚糖被试验动物摄取后,可能调节了肠道微生态平衡[24],推测壳聚糖被克氏原螯虾摄入,经口腔、胃等到达肠道后,可以选择性地增殖某些有益菌,这些有益菌能促进肠道完整性,提高肠道自身分泌消化酶的功能。同时又可以在肠道内合成维生素和氨基酸,达到提高水产动物的营养,从而使壳聚糖起到间接提高消化酶活性的作用。消化酶活性的变化与PO、ALP、转氨酶的变化相符合,随着壳聚糖添加量的增加,消化酶活性有所上升,PO、ALP活性也升高,转氨酶的活性则相应降低。可以看出,消化酶活性升高,提高了克氏原螯虾对营养物质的利用率,促进了免疫因子的活化,增强了机体抵御外界不利因子的能力。
上述试验结果表明,在成虾饲料中添加0.5%~1.5%的壳聚糖,并不会影响虾肉的品质,而且对克氏原螯虾具有一定的免疫保护和增强其消化机能的作用。
[1] 郑宗林,唐俊,喻文娟.壳聚糖在水产养殖中的应用及前景展望[J].渔业现代化,2004(5):40-42.
[2] Anderson D P,Siwicki A K.Duration of protection againstAeromonas salmonicidain brook trout immunostimulated with glucan or chitosan by injection or immersion[J].Progr Fish Cult,1994,56: 258-261.
[3] Siwicki A K,Anderson D P,Rumsey G L.Dietary intake of immunostimulants by rainbow trout affects non-specific immunity and protection against furunculosis[J].Veterinary Immunology and Immunopathology,1994,41(1/2):125-139.
[4] Esteban M A,Mulero V,Cuesta A,et al.Effects of injecting chitin particles on the innate immune response of gilthead seabream (Sparus aurataL.)[J].Fish&Shellfish Immunology,2000,10 (6):543-554.
[5] Esteban M A,Cuesta A,Ortuno J,et al.Immunomodulatory effects of dietary intake of chitin on gilthead seabream(Sparus aurataL.)innate immune system[J].Fish&Shellfish Immunology, 2001,11(4):303-315.
[6] Wang SH,Chen JC.The protective effectof chitin and chitosan againstVibrio alginolyticusin white shrimpLitopenaeus vannamei[J].Fish&Shellfish Immunology,2005,19(3):191-204.
[7] 王建国,陆宏达.酚氧化酶活力测定方法中关于测定时间的研究[J].上海海洋大学学报,2009,18(6):765-770.
[8] Huang J,Yang Y,Wang A.Reconsideration of phenoloxidase activity determination in white shrimpLitopenaeus vannamei[J].Fish& Shellfish Immunology,2010,28(1):240-244.
[9] 董学兴,吕林兰,黄金田,等.Cu(Ⅱ)和Cd(Ⅱ)对克氏原螯虾代谢酶的影响[J].大连海洋大学学报,2011,26(5):467-471.
[10] Tan S H,Degnan B M,Lehnert S A.The penaeus monodon chitinase 1 gene is differentially expressed in the hepatopancreas during the molt cycle[J].Marine Biotechnology,2000,2(2): 126-135.
[11] Shiau S Y,Yu Y P.Dietary supplementation of chitin and chitosan depresses growth in tilapia,Oreochromisniloticus×O.aureus[J].Aquaculture,1999,179:439-446.
[12] Kono M,Matsui T,Shimizu C.Effect of chitin,chitosan and cellulose as diet supplementson the growth of cultured fish[J].Bull Japan Soc Scient Fish,1987,53(1):125-129.
[13] 黄辉洋,李少菁,王桂忠,等.甲壳动物酚氧化酶活力及其在养殖中的应用[J].海洋通报,2000,19(3):79-84.
[14] Aspan A,Soderhall K.Purification of prophenoloxidase from crayfish blood cells,and its activation by an ecdogenous serine proteinase[J].Insect Biochem,1991,21:363-373.
[15] Aspan A,Sturtevant J,JSmith V,etal.Purification and characterization of a prophenoxidase activating enzyme from crayfish blood cells[J].Insect Biochem,1990,20:709-718.
[16] Soderhall K,Hall L.Lipopolysaccharide-induced activation of prophenoloxidase activation system in crayfish haemocyte lysate [J].Biochim Biophys Acta,1984,79(7):99-104.
[17] 肖克宇.水产动物免疫与应用[M].北京:科学出版社,2007: 102-138.
[18] 何南海.对虾免疫功能指标的建立及其应用[J].厦门大学学报:自然科学版,2004,23(3):385-388.
[19] 陈国福,宋晓玲,黄倢.A3α肽聚糖对凡纳滨对虾生长、免疫机能和抗病毒感染的影响[J].高技术通讯,2005,15(8): 100-106.
[20] Chaplin A E,Huggins A K,Munday K A.The distribution of lα-aminotransferases inCarcinusmaenas[J].Comparative Biochemistry and Physiology,1967,20(1):195-198.
[21] 曹丹,周洪琪.壳聚糖对异育银鲫的生长、蛋白质合成及肌肉营养成分的影响[J].淡水渔业,2004,34(1):6-11.
[22] 华雪铭,周洪琪,张宇峰,等.饲料中添加壳聚糖和益生菌对暗纹东方鲀幼鱼生长及部分消化酶活性的影响[J].水生生物学报,2005,29(3):299-307.
[23] 王树芹,张成松.甲壳素、壳聚糖及其在水产中的应用[J].饲料研究,2004(5):25-28.
[24] Mitsuaki K.Properties and uses of oligosaccharides from chitin and chitosan[J].JAppl Glycoscience,1998,45(4):415-419.
Effects of dietary chitosan supplementation on growth,non-specific immune factors,muscle com positions and activities of digestive enzymes in red swamp crayfish Procambarus clarkii
REN Xiu-fang1,2,ZHOU Xin2,ZHAO Chao-yang2,SHUI Yan2,XU Zeng-hong2, SHEN Huai-shun2,ZHANG Ping1,2,BAIAi-xu1,2
(1.College of Fisheriesand Life,Shanghai Ocean University,Shanghai 201306,China;2.Freshwater Fisheries Research Center,Chinese Academy of Fishery Sciences,Wuxi214081,China)
Red swamp crayfishProcambarus clarkiiwith initial body weight of(21.55±1.62)g were fed the diets containing 0%(control group),0.5%,1.0%,1.5%,2.0%,and 3.0%chitosan atwater temperature of(22± 1)℃ for 60 days to investigate the effects of dietary chitosan supplementation on growth,non-specific immune factors,muscle compositions,and activity of digestive enzymes in the red swamp crayfish.Results showed that there was significantly higher specific growth rate in the crayfish in 1.0%chitosan group than that in the other groups (P<0.05).The mortality rate and molting mortality rate were found to be significantly higher in the crayfish in 1.5% chitosan group than those in the control one(P<0.05).The crayfish fed the diets containing 1.0%and 2.0% chitosan had significantly higher phenoloxidase activity than the crayfish in the control group did(P<0.05). There were significantly higher alkaline phosphatase(ALP)activity in the chitosan addition groups than those in the control group(P<0.05).The chitosan addition led to significantly lower glutamic-pyruvic transaminase (ALT),except in 1.0% and 2.0% chitosan groups.The significantly lower glutamic-oxalacetic transaminease (AST)activitieswere observed in chitosan addition groups(P<0.05),except 2.0% chitosan addition group. Muscle composition analysis indicated that there was lower crude protein level in the chitosan addition groups than that in the control group,while there was significantly higher crude fat level in the 1.0%,1.5%,and 3.0% groups than that in the control one(P<0.05),except in 2.0% chitosan group.The crayfish fed the diet containing 1.0% chitosan showed significantly lower ash content inmuscle than the crayfish in the control group did.Therewas significantly highermoisture in 2.0% chitosan group than that in the control group(P<0.05).The significantly higher activities of trypsase and lipase in hepatopancreas and trypsin in intestinal tractwere found in the 1.0% chitosan group(P<0.05)compared with the control group.The crayfish fed the diet1.5% chitosan had significantly higher amylase activities in hepatopancreas and intestine than the animals fed the control diet did(P<0.05).In conclusion,it is suggested that chitosan addition of 0.5%-1.5%improve the immune protection and promote digestive function in red swamp crayfish.
Procambarus clarkii;chitosan;phenoloxidase;digestive enzyme;muscle composition
S966.1
A
2095-1388(2013)05-0468-07
2013-02-05
农业部淡水渔业与种质资源利用重点实验室资助项目;公益性行业 (农业)科研专项 (201003070)
任秀芳 (1987-),女,硕士研究生。E-mail:greatrxf@163.com
周鑫 (1956-),男,研究员。E-mail:zhoux@ffrc.cn
