左旋多巴合成研究进展
2013-08-02马强强赵广荣
马强强,赵广荣
(天津大学化工学院系统生物工程教育部重点实验室,天津 300072)
左旋多巴(L-DOPA)化学名为β-3,4-二羟苯 基-α-丙氨酸(3,4-2dihydroxylphenylalanine)[图1(a)],又名3-羟基-L-酪氨酸,为白色结晶性粉,无臭无味,不溶于乙醇、氯仿和丙酮,易溶于稀酸。左旋多巴为前体药物,其作用机理为左旋多巴能通过血脑屏障,到达中枢神经系统,在脱羧酶的作用下,转变为多巴胺[图2(b)],进而发挥治疗帕金森综合症的作用[1]。左旋多巴于1970年被美国食品药品监督管理局批准为治疗帕金森综合症的药物[2],在2007年世界畅销药中排名第100名,2008年销售金额突破9000万美元。左旋多巴具有广阔的市场前景[3]。
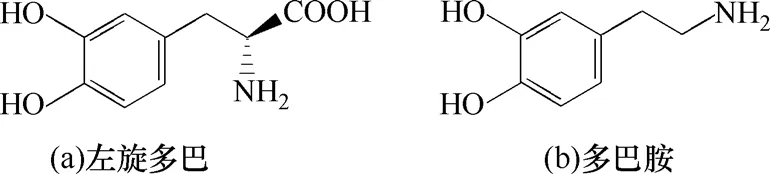
图1 左旋多巴和多巴胺分子结构
目前左旋多巴的制备方法主要有化学合成、植物提取、生物酶催化以及微生物发酵。由于化学合成和植物提取方法具有一定的局限性。20 世纪60年代末,国内外一些学者开始探索生物酶法合成左旋多巴。日本学者Yamada 等[4]通过菌种选育及发酵条件的优化合成左旋多巴,其研究成果已用于工业化生产。彭珍荣等[5]在国内开展微生物法合成左旋多巴方面的研究。左旋多巴的产量已经达到了250 t/a,微生物酶法合成左旋多巴的生产效率已达到11.1 g/(L·h)[6]。本文重点针对生物酶催化和微生物发酵生产左旋多巴的研究进行评述,并对左旋多巴合成的研究方向进行了展望。
1 化学合成左旋多巴
1911年Funk C 首次利用3,4-碳酰二氧苯甲醛为原料合成左旋多巴[7]。左旋多巴中含有一个不对称碳原子,因此在合成的过程中有必要保持其较高的旋光值。Knowles[8]发现双膦配体 DiPAMP(phospHine ligand DiPAMP)的催化氢化,可以取得较高的对映选择性,而且DiPAMP 第一次在脱氢氨基酸的不对称氢化取得了大于95%ee的高对映选择性,随后该思路应用于左旋多巴的不对称合成,并且得到了97.5%ee 的左旋多巴。王伟文等[9]成功以愈创木酚为原料,经过八步合成反应得到多巴,且具有较高的纯度与收率(图2)。
目前,工业化生产左旋多巴多以香草醛和乙内酰脲为原料,经过8 步的反应制得。尽管目前商品化左旋多巴主要通过不对称法合成,但化学合成过程中需要大量的金属催化物,并且过程繁杂,产物的转化效率和旋光活性均较低,同时具有成本高、环境污染严重等问题[10]。所以开发新的合成方法和思路是今后研究的重点和方向。
2 天然植物中提取左旋多巴
天然植物中存在左旋多巴。1913年生物化学家Guggenheim 从蚕豆中提取得到左旋多巴。之后在很多植物中均发现存在左旋多巴,如猫豆、藜豆 等[11],其中猫豆中的左旋多巴含量最高达到6%~9%,是提取左旋多巴最主要的原料。通过改良提取技术,使得猫豆中左旋多巴的提取得率,从1.5%已提高到3.4%,纯度达到99.9%[12]。虽然从植物中直接提取左旋多巴是目前的一种方法,但是由于受到原料来源的限制,并且提取步骤繁杂,产量小,远不能满足市场需求。
3 生物酶转化合成左旋多巴
生物酶转化法主要以L-酪氨酸或酚类物质为底物,通过来源于微生物的酶体外制取左旋多巴。目前已报道3 种酶可以催化多巴的生成:①酪氨酸酚解酶,该酶以邻苯二酚、氨水以及丙酮酸为底物;②酪氨酸酶,该酶以酪氨酸为底物,羟化酪氨酸生成左旋多巴;③转氨酶,该酶将来源于天冬氨酸或谷氨酸上的氨基转移至3,4-二羟基苯丙酮酸,生成左旋多巴。
3.1 酪氨酸酚解酶法合成
酪氨酸酚解酶(tyrosine phenol lyase,TPL)(EC 4.1.99.2)可催化苯酚、丙酮酸和氨水生成酪氨酸,该反应为可逆反应。若将苯酚置换成邻苯二酚,该酶即可催化生成左旋多巴(图3),催化反应过程中需要磷酸吡哆醛(胺)为辅酶、钾离子和氨离子为辅因子[13]。该酶广泛存在于多种微生物中,如假单胞菌属[14]、真菌[15]、链霉菌[16]等,其中草生欧文氏菌(Erwinia herbicola),弗氏柠檬酸菌(Citrobacter freundii)中的酪氨酸酚解酶活性较高。
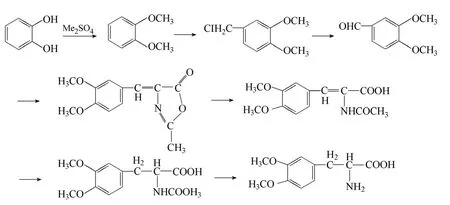
图2 以愈创木酚为原料合成多巴
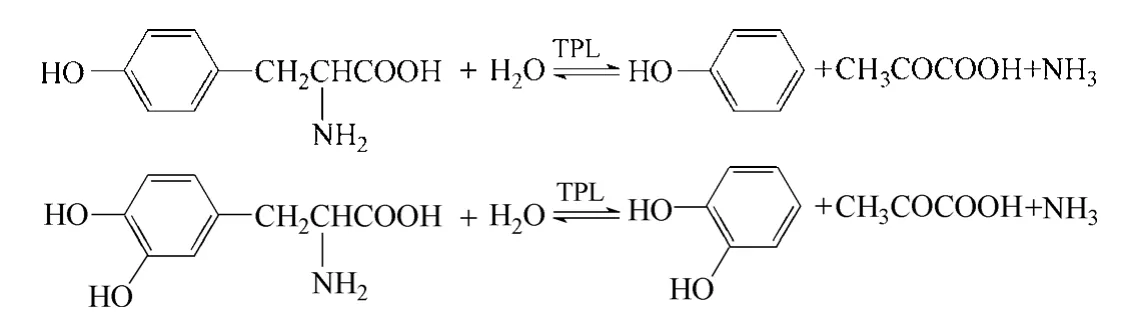
图3 酪氨酸酚解酶催化合成左旋多巴
Lee 等[17]用来源于Symbiobacterium sp. SC-1 的酪氨酸酚解酶(TPL),将邻苯二酚、丙酮酸和氨转化为左旋多巴。反应15 h 以后,左旋多巴的产量可以达到65 g/L,收率可达到92%。上述催化体系中,当邻苯二酚及丙酮酸的浓度较高时会对TPL 产生抑制作用甚至不可逆失活,在发酵体系中加入一些硼酸根离子可以减轻邻苯二酚对酶的抑制作用[18]。然而该催化体系存在一些缺点[19],反应时间长、转化效率不高、分离成本高、原料比较昂贵。
3.2 酪氨酸酶法合成
酪氨酸酶(tyrosinase)以酪氨酸直接作为底物,催化合成左旋多巴(图4)。该酶同时具有单酚氧化酶和二酚氧化酶氧化还原作用,其中单酚氧化酶催化单酚羟基化,二酚氧化酶可将二酚类化合物氧化为醌类化合物。Krishnaveni 等[20]利用真菌Acremonium rutilum 转化酪氨酸合成左旋多巴,该菌具有较高的酪氨酸酶生产能力,经过优化培养条件后,连续培养120 h,最大产量是0.89 mg/mL。Ho 等[21]将来源于蘑菇的酪氨酸酶通过固定化的方法转化合成左旋多巴。酪氨酸酶用聚苯乙烯-聚酰胺苯乙烯(PSNH)和聚甲基氯苯乙烯(PSCL)固定,催化的最适pH 值和最适温度分别为5.5 和60 ℃、3.0 和70 ℃。反应36 h 后,两种固定化方式催化生成左旋多巴的产率分别为1.44 mg/(L·h)和2.33 mg/(L·h)。这两种固定方式中,PSCL 上的酪氨酸酶稳定性明显高于PSNH。Ates 等[22]将酪氨酸酶固定 于含铜离子的海藻酸钠中,运用填充床酶法的方法生产左旋多巴,产量达1.2 mg/L。若在反应体系中引入空气,左旋多巴产量可以提高6.4 倍,左旋多巴生产效率达到110 mg/(L·h)。然而这一过程需要耗费大量还原剂,同时产物左旋多巴不容易分离。

图4 酪氨酸酶催化酪氨酸合成L-DOPA
由于酪氨酸酶具有二酚氧化还原酶的活性,会将左旋多巴继续氧化生成多巴醌,为防止左旋多巴被氧化,可以引入化学还原剂,如抗坏血酸[21,23],NADH 或者羟胺[24],向多巴醌供应电子使其重新还原为左旋多巴。Mina 等[25]对这一方法进行了改进,将酪氨酸酶包被组成酪氨酸酶-碳纳米-多吡咯电极,由电极供应还原多巴醌的电子,左旋多巴的产率提高95.9%,达到27 mg/(L·h)。
3.3 转氨酶法合成
转氨酶(transaminase)可将L-天冬氨酸或L-谷氨酸中的氨基转移到3,4-二羟基苯丙酮酸上,进而生成左旋多巴(图5)。Sandler 等[26]认为在左 旋多巴中转氨基作用是非常重要的一步。随后Nagasaki 等[27-28]研 究 了 Enterobacter cloacae NB320,Alcaligenes faecalis 转氨基作用生成左旋多巴的能力。然而由于转氨作用存在诸多问题,随后相关利用转氨酶生成左旋多巴的研究比较少见。
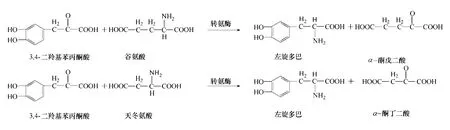
图5 转氨基作用合成多巴
4 代谢工程策略合成左旋多巴
李华钟等[29-30]将来源于Citrobacter freundii 的酪氨酸酚解酶基因导入大肠杆菌中进行异源表达,并对发酵培养基进行了优化。优化的反应体系中添加了底物丙酮酸,邻苯二酚及0.1%EDTA,0.2%亚硫酸钠。氨水调节pH=8,15 ℃反应16 h,左旋多巴的产量可达15.36 g/L。Katayama 等[4,31]对Erwinia herbicola 进行代谢工程改造,合成左旋多巴。他们发现TyrR 是酪氨酸酚解酶基因的转录激活因子,通过随机突变筛选得到TyrR 突变体TyrV67A Y72C E201G,提高酪氨酸酚解酶基因的表达量,进而提高左旋多巴的生成。发酵末期左旋多巴产率由0.357 g/(L·h)提高到了11.l g/(L·h)。Kurt 等[32]将来源于Vitreoscilla 血红素基因导入Citrobacter freundii 和Erwinia herbicola 中,左旋多巴的产量分别由未导入之前的30.4 mg/L 和33.8 mg/L 提高到112 mg/L和97 mg/L。
Munoz 等[33]改造大肠杆菌代谢通路合成左旋多巴。他们首先敲除葡萄糖磷酸转移酶基因和过表达转酮醇酶基因,增加磷酸烯醇式丙酮酸和4-磷酸赤藓糖的积累,为酪氨基酸合成提供足够前体,结果显示L-酪氨酸比生产速率提高3 倍。敲除酪氨酸合成代谢中的抑制因子基因,L-酪氨酸比生产速率提高1.9 倍。解除酪氨酸的反馈抑制,将代谢通量由磷酸烯醇式丙酮酸引向合成L-酪氨酸。进一步通过表达分支酸变位酶基因和来源于 Zymomonas mobilis 的环己二烯脱羟酶基因,增大该代谢通路的通量。在基本盐培养基中发酵,左旋多巴比生产速率达13.6 mg/(g·h),得率为51.7 mg/g,在发酵罐中发酵结果显示左旋多巴产量达1.51 g/L。
5 总结和展望
随着我国人口老龄化速度的加快,左旋多巴的需求将迅速增加。随着代谢工程、合成生物学的发展,天然产物药物的异源生物合成已经成为可能并受到越来越多的关注。由于化学合成和植物提取存在很多问题,通过生物转化法和微生物发酵法合成左旋多巴是今后研究的重要方向。
(1)开发新型高效的生物酶催化体系,为生物转化提供技术支撑。挖掘新型高效催化合成左旋多巴相关酶,对已有酶进行突变,高通量筛选高活性酶。探索高效酪氨酸酚解酶和酪氨酸酶的固定化方法,进一步提高酶的寿命和使用周期。
(2)运用代谢工程和合成生物学的思路,从细胞整体角度,从头设计左旋多巴的微生物合成途径,探明左旋多巴生物合成中的限制因素,并对其进行系统改造,构建高效生产左旋多巴的工程微生物。目前,植物来源的紫杉醇和青蒿素前体在大肠杆菌和酵母中得到高效合成,为左旋多巴工程菌创建具有示范价值。同时开发新型左旋多巴的工程菌株,如在链霉菌中发现了具有合成左旋多巴的基因,可改造使其具有较高的工业化应用潜力。
(3)开发新型左旋多巴衍生物的生物合成路线。左旋多巴的很多衍生物如甲基多巴、氧-甲基多巴、卡比多巴、左旋多巴酯、咪唑啉酮等均具有重要的生理功能和临床应用。探索这些衍生物的生物转化或者微生物合成路线也是今后研究的一个 方向。
[1] Poewe W,Antonini A,Zijlmans J,et al. Levodopa in the treatment of Parkinson’s disease:An old drug still going strong[J]. Clinical Interventions in Ageing,2010,5:229-238.
[2] Abbott A. Levodopa:The history so far[J]. Nature,2010,466:S6-S7.
[3] Huynh T. The Parkinson’s disease market[J]. Nature Reviews Drug Discovery,2011,10:571-572.
[4] Yamada H,Kumagai H. Synthesis of L-tyrosine related amino acids by β-tyrosinase[J]. Advances in Applied Microbiology,1975,19:248-288.
[5] 彭珍荣,万品珍.L-酪氨酸合成L-多巴的研究[J].氨基酸杂志,1989,4:1-2.
[6] Koyangi T,Katayama T,Suzuki H,et al. Hyperproduction of 3,4-dihydroxyphenyl-L-alanine(L-DOPA) using Erwinia herbicola cells carrying a mutant transcriptional regulator tyrR[J]. Bioscience,Biotechnology,and Biochemistry,2009,73(5):1221-1223.
[7] Hornykiewicz O. L-DOPA:From a biologically inactive amino acid to a successful therapeutic agent[J]. Amino Acids,2002,23:65-70.
[8] Knowles W S. Asymmetric hydrogenation[J]. Account of Chemical Research,1983,16:106-112.
[9] 王伟文,惠云身.左旋多巴合成工艺研究[J]. 西北药学杂志,1994,9(4):172-173.
[10] Valdes R H,Puzer L,Gomes M,et al. Production of L-DOPA under heterogeneous asymmetric catalysis[J]. Catalysis Communications,2004,5(10):631-634.
[11] Behera A,Sankar D G,Moitra S K,et al. Isolation,characterization and quantification of levodopa in seeds of Mucuna pruriens and herbal formulation by spectrophotometry[J]. Pharm Analysis and Quality Assurance,2011(2):135-146.
[12] 黄增琼,蒋伟哲,巫世红.毛豆的研究[J].进展药学专论,2008,17(24):15-16.
[13] Fitzpatrick P F. Mechanism of aromatic amino acid hydroxylation[J]. Biochemistry,2003,42(48):14083-14091.
[14] 彭珍荣.假单胞菌属细菌产酪氨酸酶的研究[J].氨基酸杂志,1990,1:7-9.
[15] Hap I,Ali S,Qadeer M A. Biosynthesis of L-DOPA by Aspergillus oryzae[J]. Bioresource Technology,2002,85(1):25-29.
[16] Neusser D,Schmidt H,Spizek J,et al. The genes lmbB1 and lmbB2 of Streptomyces lincolnensis encode enzymes involved in the conversion of L-tyrosine to propylprolane during the biosynthesis of the antibiotic lincomycin A[J]. Archieves of Microbiology,1998,164(4):322-333.
[17] Lee S G,Hong S P,Sung M H. Development of an enzymatic system for the production of dopamine[J]. Enzyme and Microbial Technology,1999,25:298-302.
[18] Kumagai H,Yamada H,Matsui H,et al. Tyrosine phenol lyase Ⅰ purification crystallization and properties[J]. The Journal of Biological Chemistry,1970,245:1767-1772.
[19] Huang S Y,Shen Y W,Chan H S. Development of a bioreactor operation strategy for L-DOPA production using Stizolobium hassjoo suspension culture[J]. Enzyme and Microbial Technology,2002,30(6):779-791.
[20] Krishnaveni R,Rathod V,Thakur M S,et al. Transformation of L-tyrosine to L-dopa by a novel fungus,Acremonium rutilum under submerged fermentation[J]. Current Microbiology,2009,58(2):122-128.
[21] Ho P Y,Chiou M S,Chao A C. Production of L-DOPA by tyrosinase immobilized on modified polystyrene[J]. Applied Biochemistry and Biotechnology,2003,111(3):139-152.
[22] Ates S,Cortenlioglu E,Bayraktar E,et al. Production of L-DOPA using Cu-alginate gel immobilized tyrosinase in a batch and packed bed reactor[J]. Enzyme and Microbial Technology,2007,40(4):683-687.
[23] Mariam I,Ali S,Rehman A,et al. L-Ascorbate,a strong inducer of L-dopa (3,4-dihydroxy-L-phenylalanine) production from pre-grown mycelia of Aspergillus oryzae NRRL-1560[J]. Biotechnology and Applied Biochemistry,2010,55(3):131-137.
[24] Seetharam G,Saville B A. L-DOPA production from tyrosinase immobilized on Zeolite[J]. Enzyme and Microbial Technology,2002,31(6):747-753.
[25] Mina K,Parkb D H,Yoo Y J. Electroenzymatic synthesis of L-DOPA[J]. Journal of Biotechnology,2010,146:40-44.
[26] Sandler M,Johnson R D,Ruthven C J,et al. Transamination is a major pathway of L-dopa metabolism following peripheral decarboxylase inhibition[J]. Nature,1974,247:364-366.
[27] Nagasaki T,Sugitia M,Fukawa H,et al. DOPA production with Enterobacter cloacae NB320 by transamination reaction[J]. Agriculture Biology and Chemistry,1975,39(2):363-369.
[28] Nagasaki T,Sugitia M,Fukawa H. Studies on DOPA transaminase of Alcaligenes faecalis[J]. Agriculture Biology and Chemistry,1973,37:1701-1706.
[29] 李华钟,孙伟,刘吉泉,等.弗氏柠檬酸细菌酪氨酸酚解酶基因在大肠杆菌中的克隆与表达[J]. 工业微生物,2001,31(3):9-12.
[30] 李华钟,孙伟,王树英,等.重组大肠杆菌合成左旋多巴条件的优化[J]. 工业微生物,2002,32(2):5-9.
[31] Katayama T,Suzuki H,Koyanagi T,et al. Cloning and random mutagenesis of the Erwinia herbicola tyrR gene for high-level expression of tyrosine phenol-lyase[J]. Applied and Environmental Microbiology,2000,66(11):4764-4771.
[32] Kurt A G,Aytan E,Ozer U,et al. Production of L-DOPA and dopamine in recombinant bacteria bearing the Vitreoscilla hemoglobin gene[J]. Biotechnology Journal,2009,4(7):1077-1088.
[33] Munoz A J,Chavez G H,Anda R,et al. Metabolic engineering of Escherichia coli for improving L-3,4-dihydroxyphenylalanine (L-DOPA) synthesis from glucose[J]. Journal of Industrial Microbiology and Biotechnology,2011,38(11):1845-1852.
