心脏发育的信号调控与先天性心脏病的关系
2013-08-02王力汤楚中朱智明
王力,汤楚中,朱智明
·综 述·
心脏发育的信号调控与先天性心脏病的关系
王力,汤楚中,朱智明
心脏发育起源于原肠胚阶段位于前侧板中胚层的生心区,生心区祖细胞在特异细胞因子、诱导信号及核心转录因子构成的调控网络作用下分化为心肌前体细胞,心脏发育过程中的基因变异或发育环境变化可影响调控网络中的多个环节,最后导致先天性心脏病的发生。因此,研究心脏发育过程中的信号调控机制对于探讨先天性心脏病的发生机制具有重要的理论及临床意义。目前研究证实Nkx2.5、GATA4、Tbx5、Isl-1等众多早期转录因子均参与了心脏发育的基因调控网络,但网络中大部分信号通路的研究尚不深入。本文就目前研究较多的心肌前体细胞、Nkx2.5、GATA4、Tbx5、Isl-1等转录因子以及Apelin/APJ信号通路的近期研究进展作一简要综述。
心脏;胚胎发育;先天性心脏病;信号转导;转录因子
心脏发育是特定细胞外微环境下生心区祖细胞与其他内胚层以及中胚层细胞间相互作用的结果。心脏发育过程受复杂的信号调控网络控制,其中包括内胚层来源的诱导信号,多个核心转录因子、细胞因子以及信号通路等。在生物体胚胎发育早期,心脏是较早形成并发育的器官之一,如果内在基因水平变异或外界发育环境变异影响了调控网络中的任何环节,都可能造成先天性心脏发育不良。在我国,围产期先天性心脏病(congenital heart disease,CHD)占所有出生缺陷病例的26.7%[1],且发生率近年来呈上升趋势[2]。研究表明,心脏发育过程中特定信号通路的异常改变可造成不可逆的心脏缺陷,不同的信号通路异常会引起不同类型的CHD[3]。本文就与CHD相关的心脏发育信号调控机制研究进展作一简要综述。
1 生心区祖细胞的起源与特化
心脏发育起源于早期胚胎发育中的原肠胚阶段,前侧板中胚层(anterior lateral plate mesoderm,ALPM)中与内胚层相邻的脏壁中胚层(visceral mesoderm)中一部分细胞在内胚层分泌的信号分子作用下特化成生心区祖细胞,形成生心区(cardiac crescent)[4]。通过染料示踪技术以及Cre-lox技术,研究人员将生心区又进一步分为第一生心区(first heart field,FHF)和第二生心区(secondary heart field,SHF)[5]。生心区细胞在形成过程中受特异的细胞因子调控,包括邻近胚层表达的骨形态发生蛋白(bone morphogenetic protein,BMP)、成纤维细胞生长因子(fibroblast growth factor,FGF)、Wnt蛋白以及Notch蛋白等[4,6-7]。
Uosaki等[8]将小鼠及人胚胎干细胞(embryonic stem cell,ESC)与内胚层来源的细胞株End2共培养后经流式细胞仪检测发现,胚胎干细胞中血管内皮生长因子受体Flk1(+)及血小板源性生长因子受体α多肽(+)的心肌前体细胞(cardiac progenitor cells,CPCs)呈剂量依赖性增加,说明CPCs分化的刺激信号可能来源于内胚层细胞,且该作用可能通过直接接触来实现。
2 心肌细胞分化过程中的基因表达及转录调控机制
2.1 CPCs的分化潜能 在心脏发育的基础研究中,众多学者发现CPCs有分化为心脏各个部位细胞类型的潜能[9-11]。研究人员利用鸡、非洲蟾蜍、斑马鱼及小鼠等模型动物研究CPCs时发现部分表面标记表达稳定,利用这一特点可以将CPCs提取富集用于进一步实验。Moretti等[11]将FHF标记物Isl-1作为主标记,从小鼠胚胎细胞中提取Isl-1(+)/ Flk1(+)/Nkx2.5(+)细胞,该细胞群可进一步分化为心肌细胞、心内膜细胞以及平滑肌细胞。Kattman等[9]利用Flk1作为示踪标记从中胚层[Brachyury(+)]中提取具有CPCs特征的细胞,早期高表达Flk1的细胞株有分化为血管前体和内皮细胞的倾向,Flk1稍晚表达并逐渐增高的细胞株则可进一步分化为心肌细胞、平滑肌细胞及心内膜细胞。图1列举了近期关于CPCs向心肌样细胞分化的调控机制研究[7]。
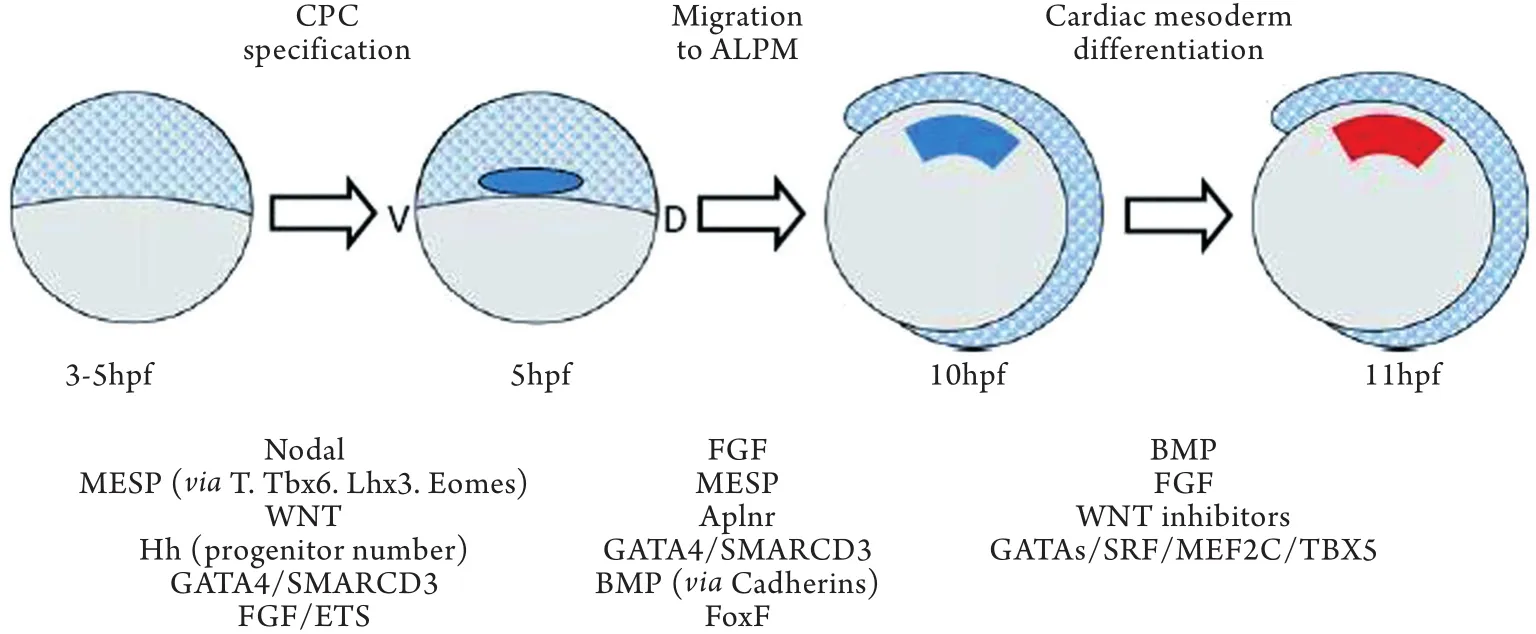
图1 心肌前体细胞(CPCs)向心肌样细胞分化的过程模式图(以斑马鱼胚胎作为模型)Fig.1 Procedural ideograph of differentiation of cardiac progenitor cells (CPCs) to cardiomyocytes (the zebrafish embryo was used as model)
2.2 参与心肌分化的核心转录因子及其调控机制
对早期胚胎细胞分化潜能的研究发现,胚胎细胞的基因处于“静默”状态,大量早期基因低水平表达[12],在进一步的心脏分化发育过程中,前侧板中胚层区域同源框(homeobox gene)基因转录因子受诱导信号激活并表达,多个核心转录因子调控CPCs按时空顺序逐步分化为心脏各个部位及组织,其中重要的核心转录因子包括同源域蛋白Nkx2.5,GATA家族锌指蛋白GATA4、GATA5、GATA6,T-box家族蛋白Tbx1、Tbx2、Tbx3、Tbx5、Tbx18、Tbx20,Smads家族蛋白,LIM同源域蛋白Isl-1,肌细胞增强因子MEF2等[13-14]。图2总结了前期实验研究中涉及的心脏特异性转录因子、细胞因子及其信号通路等构成的心脏发育调控网络,其中的核心转录因子之间相互作用,协同调控心内膜、心肌组织、传导系统、血管系统以及瓣膜的发生与发育[4,6-7,9,11,13-23]。虽然许多参与心脏发育的基因调控机制已被证实,但网络中大部分信号通路的研究尚不深入。目前,关于Nkx2.5、GATA4、Tbx5、Isl-1在CHD发生机制中的作用研究较多。另外,Apelin/ APJ信号通路作为新近发现的与心血管分化相关的基因调控系统,得到了研究者的广泛关注。
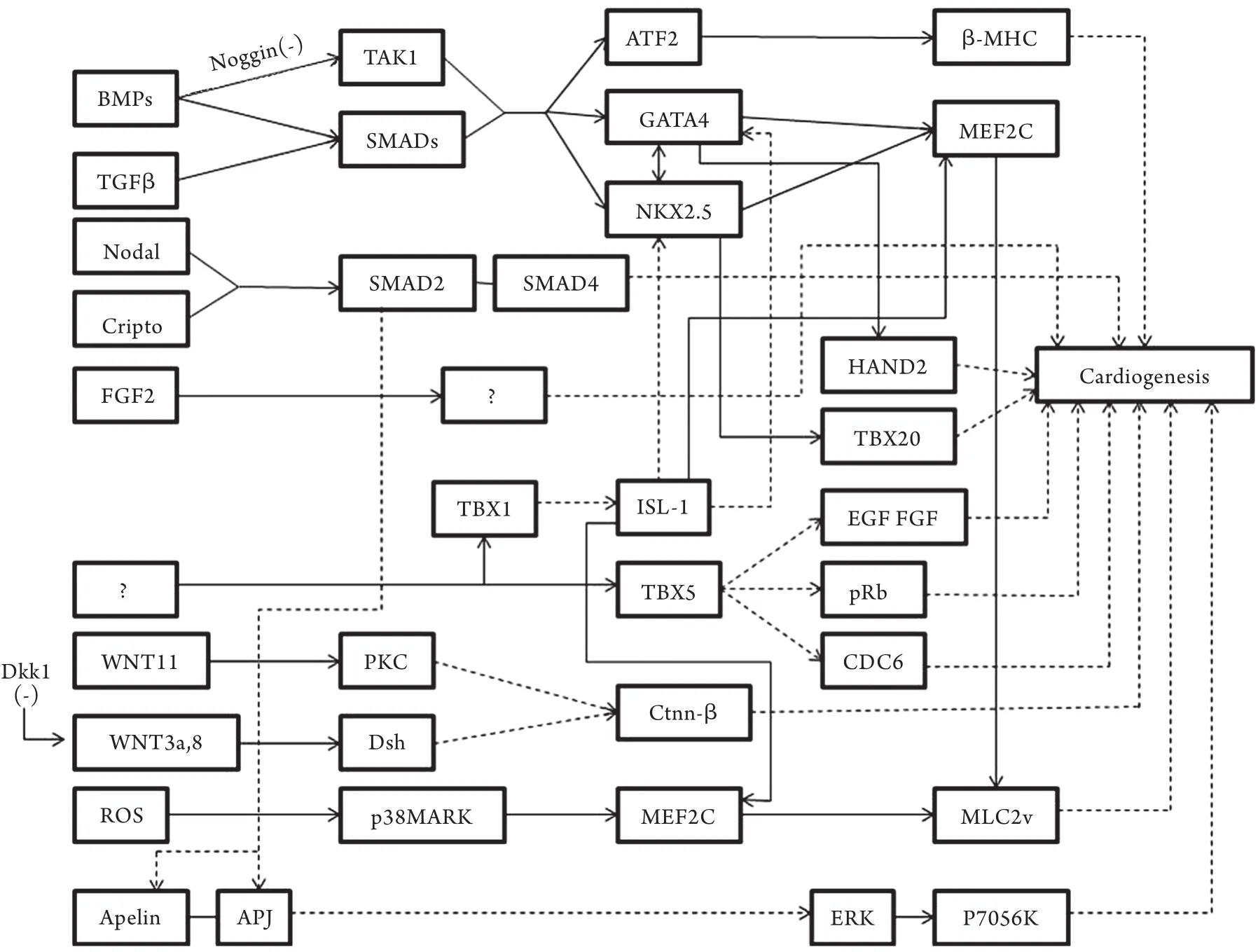
图2 心脏发育过程中的基因调控网络Fig.2 Gene regulatory networks during cardiogenesis Solid line is direct regulation, dotted line is indirect regulation
2.2.1 Nkx2.5 Nkx2.5表达最早见于脊椎动物心脏头褶期心肌源性前体细胞并持续表达于心肌细胞分化的各个阶段,在胚胎、胎儿和成体心肌细胞中均保持一定的表达水平。它参与心脏前体细胞的分化、心脏环化、房室分隔、房室流出道和传导系统的形成及成体心脏正常功能的维持[24]。Nkx2.5处于转录因子调控网络的起始端,它的表达受GATA蛋白、SMAD蛋白以及自身反馈性调节,其中在SHF中的表达依赖于Isl-1。Nkx2.5、BMP2以及SMAD1的相互作用可控制CPCs的分化与增殖[15]。另外,Nkx2.5还通过调节转录因子Jarid2的表达在流出道的发育中发挥重要作用[25]。
在人类CHD患者基因型的研究中发现,Nkx2.5基因变异可造成房室间隔缺陷、心肌纤维排列异常、传导系发育异常等,同时心律失常的发生率较正常人偏高[16]。进一步研究发现,Nkx2.5基因杂合子小鼠可出现进展性的房室传导阻滞,其基因表型与Nkx2.5基因变异的心律失常患者表型一致[16]。
2.2.2 GATA基因家族 GATA是一种组织特异性表达的转录因子家族。脊椎动物有6个GATA转录因子,其中GATA-4、5、6在心脏特异性表达。GATA-4在心肌发育的最早期表达,首先在心前期中胚层表达,随后在心内膜与心肌中表达,几种心脏基因的控制区均存在GATA4结合位点[26]。在心脏发育过程中,GATA-4通过其锌指结构与其他心脏特异性转录因子,如同源盒基因Nkx2.5、Tbx5、螺旋-环-螺旋转录因子dHAND和肌细胞增强因子MEF2等相互作用形成复合物后调控多个下游靶基因的表达,影响心脏各时期及各部位结构的分化与成熟[27]。
研究表明,GATA-4单个或多个基因位点突变及异常表达均可能导致心脏畸形的发生,如房间隔缺损、室间隔缺损、法洛四联征等,GATA-4基因的缺失可能导致人类心脏流出道发育异常、右位心、肺动脉狭窄等[17]。GATA-4基因突变大多是外显子的无义突变、错义突变、RNA剪接信号突变、寡核苷酸序列插入或缺失导致内含子剪接异常以及阅读框架异位引起的蛋白质截断等。最近的研究表明,GATA-4与BMP信号通路的受体SMAD4在心内膜的发育过程中相互作用,GATA-4基因变异可引起两者作用中断,从而引起人类的房间隔发育缺陷[18]。
2.2.3 T-box基因家族 T盒基因家族在胚胎发育和器官形成的多个方面起着重要调节作用,其基因编码的蛋白均含有非常保守的DNA结合域,通过与DNA上保守的T盒序列结合,在器官形成过程中起激活或抑制作用。目前发现的17种T-box基因中,Tbx1、Tbx18、Tbx5、Tbx20、Tbx2和Tbx3均参与哺乳动物的心脏发育调控[19]。小鼠遗传谱系分析显示,Tbx1(+)细胞分布于胚胎咽弓部位的中胚层以及内胚层,进一步参与形成SHF流出道的心肌层、心内膜以及间叶细胞,其诱导信号通路为SHH(sonic hedgehog)。Tbx1基因变异小鼠可出现永存动脉干、室间隔缺损以及冠状动脉异常发育,并可引起Fgf8、Fgf10表达下降,另外,Tbx1基因可通过调控Pitx2基因水平参与胚胎心脏的不对称发育。人类Tbx1基因缺失可出现DiGeorge综合征(22q11染色体缺失综合征)[19]。Tbx18基因表达于心脏原始横隔的PE(proepicardium)细胞、心外膜细胞、间叶前体细胞以及静脉窦前体细胞等,参与形成静脉窦以及窦房结细胞[28]。Tbx5基因最早表达于生心区前体细胞的两侧,之后在心内膜、左室流入道、左房、左室以及房室交界区心肌细胞中表达,主要参与FHF的发育。Tbx5基因缺陷可造成早期心管发育障碍、左室扩张、房室间隔缺如等畸形[20]。另外,Xie等[21]发现Tbx5可通过调节Cdk6、Gas1、Osr1等基因来控制SHF房间隔前体细胞的细胞周期,而在Tbx5基因变异的小鼠胚胎中,SHH信号通路作用于Tbx5基因下游可避免房间隔缺损的发生。
2.2.4 Isl-1 Isl-1是转录因子LIM家族Islet亚家族中的一员,它对神经系统、胰腺以及心脏的发育有重要的调控作用。众多动物模型研究证实Isl-1在FHF和SHF中均有表达,提示Isl-1(+)祖细胞可能是两类生心区的共同祖细胞,一旦祖细胞发生分化,Isl-1表达就会下降[22]。Isl-1缺失会导致心脏诸多缺陷,这些缺陷大多是由SHF发育而来,而对FHF的发育来说,Isl-1的表达并不是必需的[29]。研究证实Isl-1位于控制SHF形成的保守的转录网络的上游,它与GATA家族和Foxh1转录因子等相互作用,级联反应于下游转录因子Mef2c、Nkx2.5、Hand2、Fgh10等,最终影响SHF的发育[22,29]。另外,Witzel等[30]发现视黄酸(retinoic acid,RA)信号通路参与调控Isl-1(+)祖细胞在SHF中的发育,而另一种LIM同源域蛋白Ajuba则可能参与该调控,Ajuba缺乏的斑马鱼胚胎中Isl-1(+)祖细胞数量显著增加,同时RA信号通路调控的Isl-1表达出现异常。
2.3 Apelin/APJ信号通路 APJ受体基因在1993年由O'Dowd等[31]首次发现,在整个序列中有115个氨基酸残基(30%)、在跨膜区有88个氨基酸残基(54%)与血管紧张素Ⅱ 1型受体相同,因此被称为血管紧张素受体AT1相关受体蛋白或血管紧张素Ⅱ受体样-1(Agtrl1)。1998年,Tatemoto等[32]从牛胃的分泌物中提取并纯化出APJ受体的天然配体apelin,它是一类由77个氨基酸构成,原前体肽被血管紧张素转换酶2降解后产生的具有生物活性的多肽。对小鼠、非洲蟾蜍、斑马鱼等胚胎发育模式动物的研究表明,apelin/APJ信号通路在时空分布上的变化与心肌分化有密切联系,它参与引导CPCs迁移以及向心肌分化的过程[23,33]。动物体外实验研究发现,给予外源性apelin后,可动员小鼠心肌梗死模型体内具有向心肌血管内皮方向分化潜能的CD133+/ C-kit+/Sca-1+和C-kit+/Flk-1+干细胞群,梗死区面积缩小,毛细血管密度增加,心功能得到改善[34-35]。Gao等[36]研究发现骨髓间充质干细胞(BMSCs)在体内外向心肌细胞分化的过程中均有APJ及其配体apelin表达,且在BMSCs向心肌细胞分化过程中APJ和apelin mRNA呈动态高表达。apelin/APJ信号通路是Cripto-Nodal-GDF1-3/ALK-4/Smad2通路的下游效应因子,通过激活细胞外调控激酶(ERK)/P70S6激酶调控胚胎干细胞向心肌细胞的特异性分化。上述研究结果说明apelin/APJ信号通路在动物胚胎心脏发育过程中发挥了重要作用,但其在心脏发育调控网络中所扮演的角色及其与人类CHD之间的关系尚不明确。
3 研究展望
目前,关于心脏发育与遗传的研究层出不穷,模型动物、细胞、分子乃至基因水平的研究均有新发现,但对于心脏发育理论与临床应用方面的许多问题尚不明确,例如:①何种机制决定生心区CPCs的迁移与分化命运;②CPCs与成体心脏中存在的少量心肌干细胞是何种关系;③如何人工诱导CPCs和成体心肌干细胞向心肌细胞分化;④如何在基因与分子水平人工干预异常的诱导信号和变异的心肌转录因子;⑤如何将CPCs和成体心肌干细胞用于心脏细胞移植。这些问题仍有待于研究者们进一步探索。如果上述问题能够得到解决,将大大推动心脏发育学以及心脏再生医学的发展,尽早实现终末期心脏疾病的细胞治疗。同时,人们可通过基因芯片技术将心肌早期发育过程中的特异基因标记探针分子固定在固体支持物上,与标记的样品分子进行杂交后通过检测每个探针分子的杂交信号强度而获取样品分子的数量和序列信息,从而实现儿童甚至是胎儿的CHD早期筛查、早期发现与早期治疗。
[1] Ministry of Health, the People's Republic of China. The prevention report of birth defect in China[R]. Beijing: Ministry of Health, the People's Republic of China, 2012. 2-3. [中华人民共和国卫生部. 中国出生缺陷防治报告[R]. 北京:中华人民共和国卫生部, 2012.2-3.]
[2] Gao W. How to select the timing and therapeutic approach forcongenital heart disease[J]. Chin J Pract Inter Med, 2013, 33(4): 263-267. [高伟. 先天性心脏病临床处理时机及方式选择[J].中国实用内科杂志, 2013, 33(4): 263-267.]
[3] Srivastava D. Heart disease: An ongoing genetic battle[J]? Nature, 2004, 429(6994): 819-822.
[4] Scott IC. Life before Nkx2.5: Cardiovascular progenitor cells: embryonic origins and development[J]. Curr Top Dev Biol, 2012, 100: 1-31.
[5] Buckingham M, Meilhac S, Zaffran S. Building the mammalian heart from two sources of myocardial cells[J]. Nat Rev Genet, 2005, 6(11): 826-835.
[6] Camp E, Dietrich S, Münsterberg A. Fate mapping identifies the origin of SHF/AHF progenitors in the chick primitive streak[J]. PLoS One, 2012, 7(12): e51948.
[7] López-Sánchez C, García-Martínez V. Molecular determinants of cardiac specification[J]. Cardiovasc Res, 2011, 91(2): 185-195.
[8] Uosaki H, Andersen P, Shenje LT, et al. Direct contact with endoderm-like cells efficiently induces cardiac progenitors from mouse and human pluripotent stem cells[J]. PLoS One, 2012, 7(10): e46413.
[9] Kattman SJ, Huber TL, Keller GM. Multipotent flk-l+cardiovascular progenitor cells give rise to the cardiomyocyte, endothelial, and vascular smooth muscle lineages[J]. Dev Cell, 2006, 11(5): 723-732.
[10] Wu SM, Fujiwara Y, Cibulsky SM, et al. Developmental origin of a bipotential myocardial and smooth muscle cell precursor in the mammalian heart[J]. Cell, 2006, 127(6): 1137-1150.
[11] Moretti A, Caron L, Nakano A, et al. Multipotent embryonic isl-1(+) progenitor cells lead to cardiac, smooth muscle, and endothelial cell diversification[J]. Cell, 2006, 127(6): 1151-1165.
[12] Rada-Iglesias A, Bajpai R, Swigut T, et al. A unique chromatin signature uncovers early developmental enhancers in humans[J]. Nature, 2011, 470(7333): 279-283.
[13] Greulich F, Rudat C, Kispert A. Mechanisms of T-box gene function in the developing heart[J]. Cardiovasc Res, 2011, 91(2): 212-222.
[14] He A, Kong SW, Ma Q, et al. Co-occupancy by multiple cardiac transcription factors identifies transcriptional enhancers active in heart[J]. Proc Natl Acad Sci USA, 2011, 108(14): 5632-5637.
[15] McCulley DJ, Black BL. Transcription factor pathways and congenital heart disease[J]. Curr Top Dev Biol, 2012, 100: 253-277.
[16] Reamon-Buettner SM, Borlak J. NKX2-5: an update on this hypermutable homeodomain protein and its role in human congenital heart disease (CHD)[J]. Hum Mutat, 2010, 31(11): 1185-1194.
[17] Hirayama-Yamada K, Kamisago M, Akimoto K, et al. Phenotypes with GATA4 or NKX2.5 mutations in familial atrial septal defect[J]. Am J Med Genet A, 2005, 135(1): 47-52.
[18] Moskowitz IP, Wang J, Peterson MA, et al. Transcription factor genes Smad4 and Gata4 cooperatively regulate cardiac valve development[J]. Proc Natl Acad Sci USA, 2011, 108(10): 4006-4011.
[19] Greulich F, Rudat C, Kispert A. Mechanisms of T-box gene function in the developing heart[J]. Cardiovasc Res, 2011, 91(2): 212-222.
[20] Takeuchi JK, Ohgi M, Koshiba-Takeuchi K, et al. Tbx5 specifies the left/right ventricles and ventricular septum position during cardiogenesis[J]. Development, 2003, 130(24): 5953-5964.
[21] Xie L, Hoffmann AD, Burnicka-Turek O, et al. Tbx5-hedgehog molecular networks are essential in the second heart field for atrial septation[J]. Dev Cell, 2012, 23(2): 280-291.
[22] Laugwitz KL, Moretti A, Caron L, et al. Islet-l cardiovascular progenitors: a single source for heart lineages[J]? Development, 2008, 135(2): 193-205.
[23] Zeng XX, Wilm TP, Sepich DS, et al. Apelin and its receptor control heart field formation during zebrafish gastrulation[J]. Dev Cell, 2007, 12(3): 391-402.
[24] Wojakowski W, Kucia M, Zuba-Surma E, et al. Very small embryonic-like stem cells in cardiovascular repair[J]. Pharmacol Ther, 2011, 129(1): 21-28.
[25] Barth JL, Clark CD, Fresco VM, et al. Jarid2 is among a set of genes differentially regulated by Nkx2.5 during outflow tract morphogenesis[J]. Dev Dyn, 2010, 239(7): 2024-2033.
[26] Barallobre-Barreiro J, de Ilárduya OM, Moscoso I, et al. Comparison of gene expression profiles in a porcine infarct model after intracoronary, transthoracic, or transendocardiac injection of heterologous bone marrow mesenchymal cells[J]. Transplant Proc, 2009, 41(6): 2279-2281.
[27] Zeisberg EM, Ma Q, Juraszek AL, et al. Morphogenesis of the right ventricle requires myocardical expression of GATA-4[J]. J Clin Invest, 2005, 115(6): 1522-1531.
[28] Mommersteeg MT, Dominguez JN, Wiese C, et al. The sinus venosus progenitors separate and diversify from the first and second heart fields early in development[J]. Cardiovasc Res, 2010, 87(1): 92-101.
[29] Xavier-Neto J, Trueba SS, Stolfi A, et al. An unauthorized biography of the second heart field and a pioneer/scaffold model for cardiac development[J]. Curr Top Dev Biol, 2012, 100: 67-105.
[30] Witzel HR, Jungblut B, Choe CP, et al. The LIM protein Ajuba restricts the second heart field progenitor pool by regulating Isl1 activity[J]. Dev Cell, 2012, 23(1): 58-70.
[31] O'Dowd BF, Heiber M, Chan A, et al. A human gene that shows identity with the gene encodingthe angiotensin receptor is located on chromosome 11[J]. Gene, 1993, 136(1/2): 355-360.
[32] Tatemoto K, Hosoya M, Habata Y, et al. Isolation and characterization of a novel endogenous peptide ligand for the human APJ receptor[J]. Biochem Biophys Res Commun, 1998, 251(2): 471-476.
[33] Ashley EA, Powers J, Chen M, et al. The endogenous peptide apelin potently improves cardiac contractility and reduces cardiac loading in vivo[J]. Cardiovasc Res, 2005, 65(1): 73-82.
[34] Zheng N, Zhang NK, Gao LR. Research progress of adult cardiac stem cells[J]. Med J China PLA, 2013, 38(4): 334-337. [郑楠,张宁坤, 高连如. 成体心肌干细胞的研究进展[J]. 解放军医学杂志, 2013, 38(4): 334-337.]
[35] Cao Y, Chen Y, Zhang NK, et al. Plasma apelin level and its clinical significance following autologous bone marrow mononuclear cell transplantation in patients with severe ischemic heart failure[J]. Med J Chin PLA, 2011, 36(7): 757-760. [曹毅, 陈宇, 张宁坤, 等. 自体骨髓单个核细胞移植治疗后重度缺血性心力衰竭患者血浆Apelin水平变化及其临床意义[J]. 解放军医学杂志, 2011, 36(7): 757-760.]
[36] Gao LR, Zhang NK, Bai J, et al. The apelin-APJ pathway exists in cardiomyogenic cells derived from mesenchymal stem cells in vitro and in vivo[J]. Cell Transplant, 2010, 19(8): 949-958.
Relationship between regulation of signaling pathways in heart development and congenital heart diseases
WANG Li1, TANG Chu-zhong2, ZHU Zhi-ming2*
1Clinical College of Navy Medicine, Second Military Medical University, Beijing 100048, China
2Department of Cardiology, Navy General Hospital, Beijing 100048, China
*
, E-mail: zhuzhiming6542@sina.com.cn
This work was supported by the National Natural Science Foundation of China (81170094)
The cardiac lineage arises from the cardiogenic area located in anterior lateral plate mesoderm during gastrula stage. Differentiation of cells in cardiac mesoderm into cardiac progenitor cells was regulated by complex signaling networks involving specific cytokines, inducing signal proteins and the core cardiac transcription factors. Any link of signaling networks influenced by mutation in genetics and changes in environment would lead to a series of congenital heart defects. Therefore, studies of signal transduction mechanism in heart development will give rise to a series of significant theoretical and clinical contributions to the mechanism of development of congenital heart diseases. Recently, it has been proved that a group of early transcription factors, including Nkx2.5, GATA4, Tbx5 and Isl-1, were involved in the complicated signaling networks during heart development. However, the mechanism of most signaling pathways in the networks remains unclear. In the present paper, the recent progresses concerning cardiac progenitor cells, a group of transcription factors, including Nkx2.5, GATA4, Tbx5, Isl-1 and Apelin/APJ pathways, were discussed.
heart; embryogenesis; congenital heart disease; signal transduction; transcription factors
R346
A
0577-7402(2013)11-0952-05
10.11855/j.issn.0577-7402.2013.11.019
2013-05-08;
2013-08-29)
(责任编辑:张小利)
国家自然科学基金(81170094)
王力,硕士研究生。主要从事心脏疾病干细胞治疗方面的研究
100048 北京 第二军医大学海军临床医学院(王力);100048 北京 海军总医院心脏中心(汤楚中、朱智明)
朱智明,E-mail:zhuzhiming6542@sina.com.cn
