头孢克洛胶囊人体药代动力学与相对生物利用度研究
2013-07-31丁青山陈铁锋周志凌麦丽萍陈秀云杨敏余细勇
丁青山,陈铁锋,周志凌,麦丽萍,陈秀云,杨敏,余细勇
(广东省医学科学院广东省人民医院科教处,广东广州510080)
头孢克洛胶囊人体药代动力学与相对生物利用度研究
丁青山,陈铁锋,周志凌,麦丽萍,陈秀云,杨敏,余细勇
(广东省医学科学院广东省人民医院科教处,广东广州510080)
目的研究头孢克洛胶囊的相对生物利用度,评价该试验制剂的生物等效性。方法对20名男性健康受试者采用随机交叉双周期给药方式,分别口服单剂量参比制剂和头孢克洛试验制剂500 mg,通过反相高效液相色谱法测定血药浓度,计算两者的相对生物利用度和药代动力学参数,评价该制剂的生物等效性。结果按lnAUC0-t计算,与参比制剂相比,单剂量口服受试药的相对生物利用度为(97.5±10.0)%。试验制剂头孢克洛胶囊和参比制剂头孢克洛胶囊之间lnAUC0-T、lnAUC0-∞经双向单侧t检验,AUC0-T、AUC0-∞的[1-2α]置信区间在参比制剂相应参数的80%~125%范围内,表明两种制剂在吸收程度具有生物等效性;lnCmax经方差分析和双向单侧t检验,Cmax的[1-2α]置信区间在参比制剂相应参数的75%~133%范围内,表明两种制剂在吸收的峰值浓度上具有生物等效性;Tmax经非参检验,两制剂间差异无统计学意义,表明两制剂在达峰时间上具有生物等效性。结论头孢克洛的两种胶囊制剂具有相似的人体药代动力学特点,生物利用度也相同。
头孢克洛;生物利用度;高效液相色谱法
头孢克洛(Cefaclor)是第二代头孢菌素类抗生素,其作用机制是通过抑制细菌细胞壁的合成来发挥作用。体外试验证实,头孢菌素类的杀菌作用是使转肽酶失活,干扰细菌细胞壁最终阶段的合成,阻止黏肽原的交联。头孢克洛在临床上广泛用于与肺炎双球菌或链球菌有关的上呼吸道感染和对细菌性急性支气管炎、急性皮肤感染症、急性单纯性膀胱炎等的治疗。头孢克洛胶囊是头孢克洛的常用制剂,在《药品注册管理办法》中的注册分类为化学药品第6类,为了研究头孢克洛胶囊的药动学特征和相对生物利用度,笔者建立了一个灵敏、快速、可靠的高效液相色谱法(HPLC)来测定血浆中头孢克洛浓度,并以市售头孢克洛胶囊作对照,比较不同制剂中的药动学特性,对两制剂进行生物等效性评价。
1 材料与方法
1.1 仪器与试剂实验主要使用仪器:HP-Chemstation数据处理工作站;HP-1050液相色谱仪;ZT-Ⅰ微型台式真空泵(由绍兴卫星医疗设备制造有限公司制造生产)。实验主要试剂:(1)头孢克洛对照品:中国药品生物制品检定所,批号:30481-200904,纯度为94.1%;(2)N-乙酰普鲁卡因胺对照品(内标):SIGMA,批号:A-5513,纯度为99%;(3)水为重蒸去离子水;(4)乙酸钠、冰醋酸为分析级,由广州化学试剂厂提供;(5)甲醇和乙腈,均为默克公司生产之色谱纯。受试制剂为广东华南药业集团有限公司研制的头孢克洛胶囊(规格:0.25 g;批号:091101;有效期至2011年11月13日);参比制剂为礼来苏州制药有限公司生产的头孢克洛胶囊(规格:0.25 g,批号:L01634;有效期至2012年7月31日)。
1.2 色谱条件色谱柱为Sino Chrom ODS-BPC 18(4.6 mm×150 mm,5µm);流动相为乙腈:10 mmol/L;醋酸钠缓冲液(冰醋酸调pH值为3.6)=9:91,流速为1 ml/min;柱温为40℃;紫外检测波长:264 nm。
1.3 样品处理方法取含药血浆0.25 ml至1.5 ml的EP离心管中,依次加入内标工作液20µl、10%的三氯醋酸溶液100µl,快速旋涡振荡3 min,离心5 min,吸取上清液20µl进样分析。
1.4 方法学确证[1]
1.4.1 特异性同时对6个不同个体的空白血浆、空白血浆加标准品以及用药后的血浆样品色谱图进行考察。
1.4.2 标准曲线和定量下限分别配制浓度为30 mg/L、20 mg/L、10 mg/L、2 mg/L、0.5 mg/L、0.25 mg/L、0.1 mg/L的带药血浆样品,按前项样品处理方法进行处理。以血浆头孢克洛浓度(C)作为横坐标,以测得的头孢克洛峰面积与内标峰面积之比(Y)作纵坐标绘制标准曲线。血浆样品头孢克洛定量下限浓度为0.1 mg/L(S/N>5),平行对5个浓度为0.1 mg/L的含药血浆样品处理后进行色谱分析,并计算其准确性和相对标准偏差(RSD)。
1.4.3 精密度与准确度分别配制高(20 mg/L)、中(2 mg/L)、低(0.25 mg/L)三种浓度质控样品,各浓度制备5份样品,分别在采用1 d内重复3次和分散于2周内重复3次的方式测定其浓度,计算日间、日内误差。
1.4.4 稳定性观察高、中、低三个不同浓度的质控样品分别在室温(24 h)、-20℃(4周)条件下的稳定性,每个浓度制备样品5份,结果用偏差(RE)表示。稳定性=(测定值/加入值)×100%。
1.4.5 提取回收率同时考察高、中、低三种不同浓度质控样品的提取回收率,每种浓度制备样品5份。
1.4.6 样品测定质控每种分析批生物样品测定时均应建立新标准曲线,并随行测定高、中、低三种不同浓度的质控样品。各浓度至少双样本。
1.5 生物利用度试验[1]
1.5.1 受试者基本情况2010年8月入选的20名受试者在被告知所有与药物有关的可能的不良反应后,自愿签署知情同意书。体重:55~79 kg,平均(64.33±5.78)kg;年龄:21~30岁,平均(25.50±2.28)岁;身高:164~184 cm,平均(171.75±4.71)cm;BMI:19.61~23.88,平均(21.77±1.21)。受试者均无药物过敏史,无肝、肾疾病史,精神状态良好,全面体格检查均正常或异常但无临床意义。受试者在受试前两周内未服过任何药物,从开始试验直至试验结束期间,不吸烟、不喝酒,不饮用其他任何饮料。
1.5.2 试验方法采用随机、双周期两制剂自身交叉对照的单次给药试验设计方法。符合入选标准的健康成年受试者20例于试验前1 d晚上18:00入住Ⅰ期病房,禁食过夜(10 h以上),于次日早晨空腹站立位服用受试制剂或参比制剂2粒(500 mg),用250 ml温开水送服。受试者于服药前(0 h)和服药后5 min、10 min、20 min、30 min、45 min、1.0 h、1.5 h、2.0 h、2.5 h、3.0 h、4.0 h、6.0 h、8.0 h、10.0 h共15个时间点抽取静脉血,每次取血4 ml,置于肝素化的试管中,离心10 min后分离血浆置-20℃储藏,用于血药浓度检测。
1.6 统计学方法所有数据均用均数±标准差(x-±s)表示。采用DAS3.1软件包对Cmax、Tmax和AUC0-T和AUC0-∞进行生物等效性分析,Cmax采用对数值,等效标准范围为75%~133%;Tmax采用实测值进行非参检验;AUC0-T、AUC0-∞均采用对数值,等效标准范围80%~125%。相对生物利用度(F)采用下列公式进行计算:
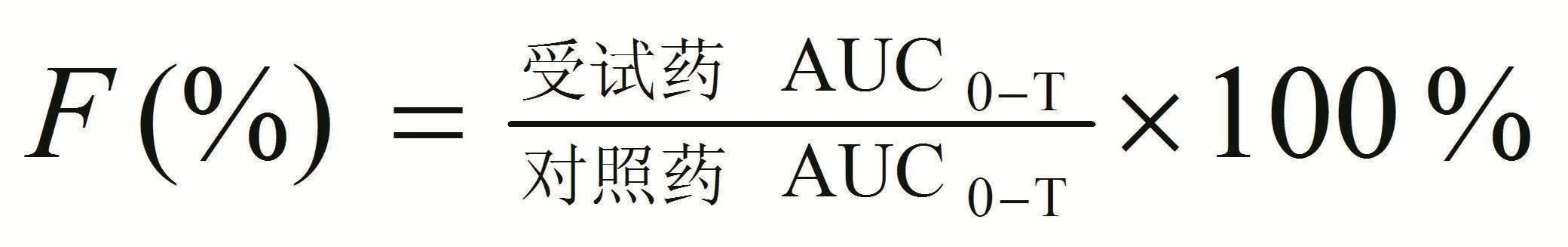
2 结果
2.1 方法学我们所建立的血浆头孢克洛的测定方法快速、特异性强、准确可靠,完全符合生物等效性研究和药代动力学研究的要求。头孢克洛和内标不受代谢物和血浆内源性物质干扰。定量下限(LLOQ)为0.1 mg/L。代表性标准曲线回归方程为:y=-0.003+0.158x(r=0.998,权重系数为1/x2)。该研究所建立的方法具有较高的精密度和准确度,日间或日内差均小于5.5%。稳定性试验结果亦表明样品在室温放置24 h或-20℃保存4周条件下有良好的稳定性,准确性在90.7%~105%。在酸性条件下蛋白沉淀提取回收率在71.4%~84.5%区间之内。
2.2 头孢克洛药代动力学与相对生物利用度所有的受试者在实验期间未发现有其他不良反应,实验结束后进行肝肾功能复查均表现正常。单剂量口服头孢克洛胶囊试验制剂或参比制剂血药浓度-时间曲线见图1。单剂量头孢克洛给药后,受试药与参比药的药动学参数如表1所示。按lnAUC0-T计算,与参比制剂相比,单剂量口服受试药的相对生物利用度为(97.5±10.0)%。
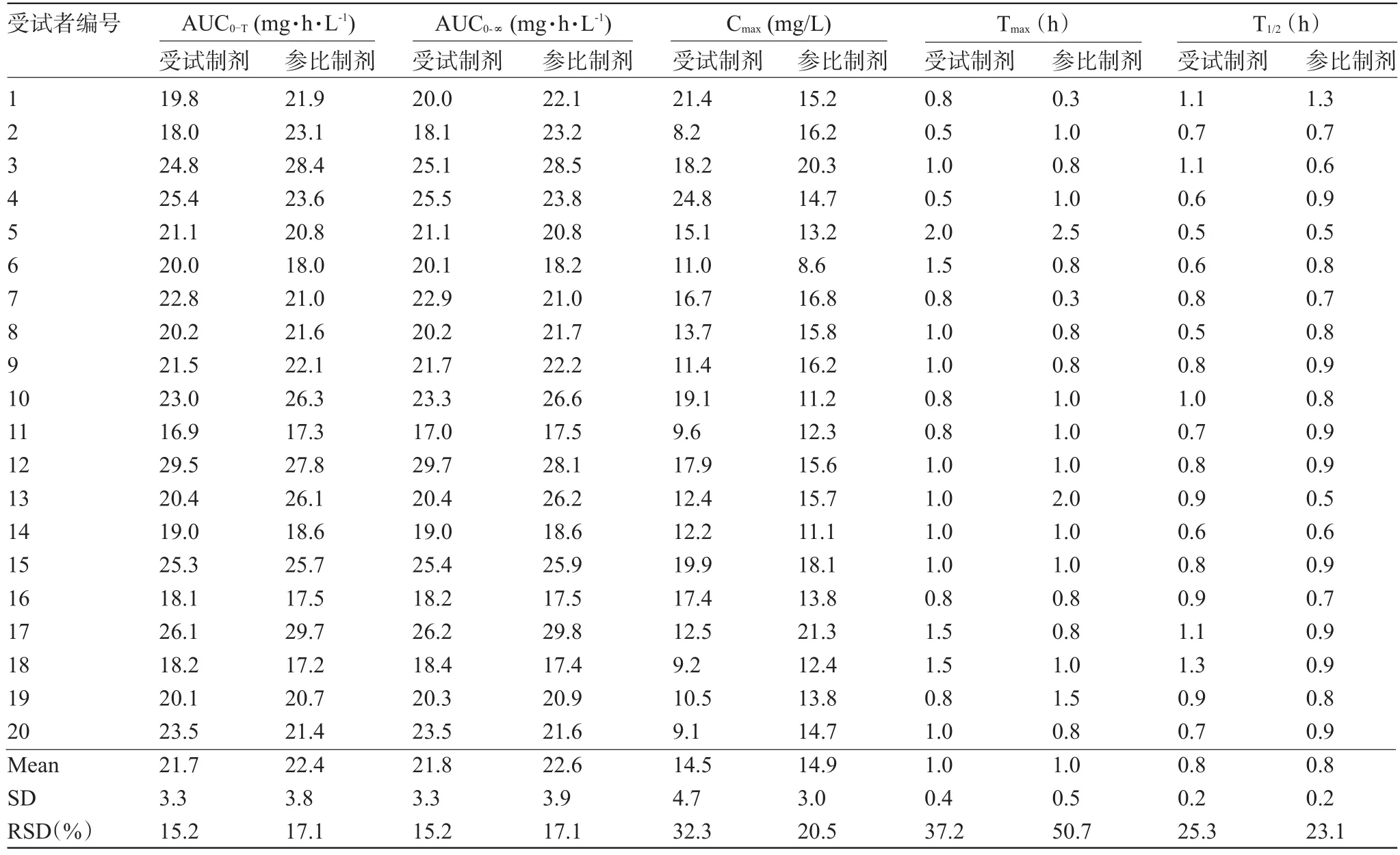
表1 参比制剂和受试制剂的药代动力学参数(n=20)

图1 头孢克洛血药浓度-时间曲线(n=20,R为参比药,A为受试药)
3 讨论
研究结果显示,头孢克洛胶囊试验制剂与参比制剂在人体的吸收速度和吸收程度差异无统计学意义,两药具有生物等效性。除达峰时间(Tmax)外,本研究中得出的头孢克洛药代动力学参数与文献比较[2-5]并无太大的差异。造成达峰时间差异的原因可能与药物本身有关,不同剂型(胶囊或分散片)、不同批次的药物崩解吸收速度可能有差异,间而影响到吸收速度,产生达峰时间差异;另外采血时间点的设置也会造成这种差异,头孢克洛口服吸收快,如果在吸收相采血时间点宽,会影响达峰时间的精确计算;还有不同试验群体个体吸收差异也会造成达峰时间峰的差别。
单剂量给药后,受试药与对照药的AUC0-T、AUC0-∞和Cmax三个药动学参数进行方差分析,其结果显示:AUC0-T、AUC0-∞和Cmax三个药动学参数制剂间差异无统计学意义(P>0.05),服药周期对三个参数亦无明显影响(P>0.05),AUC0-T、AUC0-∞和Cmax三个药动学参数均存在明显的个体间差异(P<0.05)。将AUC和Cmax两个药动学参数对数转换后,进行双向单侧t检验,AUC0-T和AUC0-∞等效判断标准为(0.8,1.25),Cmax等效判断标准为(0.75,1.33)。统计结果显示,AUC0-T的置信区间为93.0%~101.1%,AUC0-∞的置信区间为93.0%~101.0%,Cmax的置信区间为82.8%~108.7%,均符合等效标准;Cmax、AUC0-T和AUC0-∞三个参数的双向单侧t检验结果同样符合等效标准;Tmax经非参检验结果合格。因此,受试药与参比药比较具有生物等效性。
[1]国家药典委员会.药物制剂人体生物利用度和生物等效性试验指导原则(中华人民共和国药典二部2010年版)[M].中国医药科技出版社,2010,附录:195-199.
[2]刘亚妮,吕永宁,舒舟,等.头孢克洛分散片健康人体药动学与生物等效性评价[J].医药导报,2010,29(5):597-600.
[3]周燕文,刘倩,兰聪贤.头孢克洛胶囊健康人体药动学及生物等效性研究[J].广西医科大学学报,2006,23(2):272-274.
[4]魏振满,丁晋彪,刘峰群,等.头孢克洛胶囊及分散片在健康人体内的生物等效性研究[J].中国药业,2008,17(15):11-12.
[5]石焱,罗佳波,隋淼,等.头孢克洛片在健康受试者体内的药代动力学和生物等效性[J].解放军药学学报,2008,24(3):207-209.
Relative bioavailability and bioequivalence study of cefaclor capsule in Chinese healthy volunteers
DING
Qing-shan,CHEN Tie-feng,ZHOU Zhi-ling,MAI Li-ping,CHEN Xiu-yun,YANG Min,YU Xi-yong.Education Department,Guangdong General Hospital,Guangdong Academy of Medical Sciences,Guangzhou 510080,Guangdong, CHINA
ObjectiveTo study the relative bioavailability of cefaclor capsule in Chinese healthy volunteers and evaluate the bioequivalence.MethodsA single oral dose 500 mg of test and reference formulations was given to 20 healthy volunteers in a randomized cross-over study.The concentrations of cefaclor in plasma were determined by HPLC.ResultsThe relative bioavailability of lnAUC0~Twas(97.5±10.0)%.Two formulations were bioequivalent.The 90%confidence interval of AUC0~Tand AUC0-∞were in the range of 80~125%;Cmaxwas in the range of 75~133%,so the two tablets were bioequivalent.ConclusionThere were similar human pharmacokinetic characteristics and same bioavailability in human subjects between two capsules of cefaclor.
Cefaclor;Bioequivalence;HPLC
R978.1
A
1003—6350(2013)05—0633—03
10.3969/j.issn.1003-6350.2013.05.0273
2012-09-19)
余细勇。E-mail:gamsmail@163.com
