在体组织微循环的无标记光学微血管造影
2013-07-31王瑞康
王瑞康
华盛顿大学 生物工程系,华盛顿 西雅图 98195
在体组织微循环的无标记光学微血管造影
王瑞康
华盛顿大学 生物工程系,华盛顿 西雅图 98195

栏目主编:王瑞康
王瑞康,美国华盛顿大学 (西雅图 )生物工程系和眼科学系终身教授,博士导师。出生于江苏省溧阳市,攻读于天津大学精密仪器工程系,获工学学士和硕士学位。1995 年在英国格拉斯哥大学(University of Glasgow)取得博士学位并进行两年博士后研究,随后先后担任基尔大学医学院(Keele Medical School)生物成像科学讲师和高级讲师。2002 年,作为英国克兰菲尔德大学(Cranfield University)生物医学光学首席教授 (是年 36 岁 ),创立了生物光子成像实验室。2005 年被聘为美国俄勒冈健康与科学大学(Oregon Health and Science University)医学工程和麻醉学系终身教授并在该大学指导运作生物光子成像实验室。2010 年他将实验室搬迁到美国生命科学研究活跃地区——西雅图市并担任华盛顿大学(University of Washington)生物工程系和眼科学系教授。作为全球生物光子成像和光学相干成像技术的领衔人物,他相继在权威性刊物发表论文 200 多篇,编写了光学医学成像和光学信息处理专题著作 2篇,并撰写系列书籍 12 章节。现为美国光学学会 (OSA)资深会员 (Fellow)、国际光子光学学会 (SPIE)资深会员 (Fellow)和美国国立卫生研究院 (NIH)生物医学成像技术特许评审员 (chartered member)。现任 Journal of Biomedical Optics及Biomedical Optics Express 等知名权威期刊的副编辑。主要研究方向包括生物光子成像、光学相干成像、微血管成像、光声成像,以及成像技术在神经学、眼科学、皮肤学和癌症中的应用。
很多生物组织的病理及血管形态与组织微循环的改变密切相关。光学相干断层成像(OCT)是一种能以微米分辨率无创获取生物结构三维图像的成像技术。光学微血管造影(OMAG)则是对OCT数据进行处理,从而实现对生物组织血管形态的三维可视化方法。OMAG具有很高的空间分辨率,能观察到单根毛细血管,并且不需要使用造影剂,其图像衬比度是基于血管内运动的血细胞后向散射产生的内源光信号。本文简要回顾了OMAG技术的理论,并介绍了该技术以毛细血管分辨率在活体组织如脑、皮肤、和视网膜内的动态血流灌注成像中的应用。
傅立叶域光学相干断层成像; 光学微血管造影;光学成像技术;活体组织成像;生物医学仪器
0 前言
在不使用造影剂的情况下,能够对功能性血管(包括毛细血管)进行无损成像,并对其血流进行量化分析,对于生物医学研究、临床诊断以及与血管相关的疾病治疗具有重要价值。当前的成像方法存在一些局限性,包括有创(如放射线测量方法)、无法提供三维(3D)信息(如激光散斑衬比度成像)、空间和时间分辨率低(如核磁共振成像)或成像深度有限(如多光子显微镜,其成像深度 <300 μm)。因此,研发出一种具有较高分辨率(<10 μm),能够无创获取在体组织三维血流灌注的无标记成像方法具有重大的科研和临床意义。
光 学 相 干 断 层 成 像(Optical Coherence Tomography,OCT)[1-2]是 一 种 能 以 微 米 分 辨 率 实 现 对三维生物组织结构可视化的成像方法,其成像深度高达 1~3 mm。经过研究人员的不懈努力,OCT技术已能从组织的微结构中分离出血管,如相位分辨光学多普勒断层扫描(Phase Resolved Optical Doppler Tomography,PRODT)[3],该方法主要基于比较OCT信号一个B-扫描内的相邻A-扫描之间的相位差,该相位差与血流速度有直接关系。虽然目前 PRODT 已被广泛使用,但由于其对血流的灵敏度较低,很难清楚地观察到流速为 0.1~0.9 mm/s[4]或者流速更低的疾病状态下的毛细血管。为了提高其灵敏度,研究人员已提出了一些改进方法,例如利用前向和后向 B- 扫描[5],及利用相邻的 B- 扫描之间的相位方差[6]。由于相邻的 B- 扫描之间的时间间隔相对较长(ms量级),使得该方法能够对拥有缓慢血流的毛细血管进行成像。但是,该方法需要较长的采集时间(25 min),并且对物体运动伪影非常敏感。研究人员还提出了一些其他方法,如谐振多普勒血流成像[7]、时频域联合成像[8]、散班方差成像[9]、相位方差衬比成像[10]、以及单次通过血流成像[11]。
光学微血管造影(Optical Microangiography,OMAG)[12-16]是一种能够在体对微循环床内的毛细血管成像的方法。通过对组织内静态散射信号和动态散射信号的有效分离,可获取毛细血管动态血液灌注的三维分布。OMAG 技术最初曾尝试利用全场复傅立叶域 OCT 的方法[17-18],但后来,研究人员提出了多种方法从强散射背景中有效地提取血流信号,提高了系统对血流的灵敏度。其成像衬比度源于内源性运动粒子(如流动的血细胞)的后向散射光,因而无需使用外源的造影剂。到目前为止,OMAG 已被用于分析两个相邻的 A-扫描和两个相邻的 B-扫描之间的相位差。在本文中,我们主要介绍了 OMAG 的系统构成,并介绍了OMAG在在体生物组织研究中的一些应用。
1 OMAG理论概述
OMAG 是 傅 立 叶 域 OCT(Fourier Domain Optical Coherence Tomography,FDOCT) 的 一 种 扩 展 形 式, 能 够同时获得被扫描的组织样本的三维微结构和微血管图像。OMAG 采用的光谱域 OCT 系统(FDOCT 的一种形式)的示意图如图 1(A)所示。该系统的详细介绍参见文献 [17]。简要地讲,该系统采用超发光二极管或超连续光作为光源。样品光被耦合到光纤探头,该探头由X-Y扫描振镜和光学系统组成,光学系统用来探测待观察样品的往返光。系统的横向分辨率由物镜确定,而轴向分辨率则由光源的中心波长决定,并与其带宽成反比。系统的分辨率通常为~ 10 μm。从参考臂和样品臂返回的光信号重新聚到一起并传送到由计算机控制的光谱仪,然后通过计算机进行数据存储和处理。
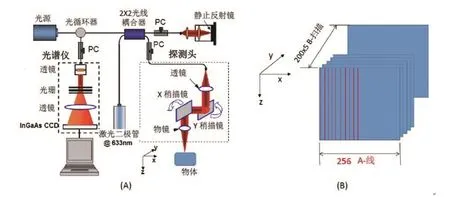
图1 (A)有光纤来实现的OMAG/OCT系统示意图。(B)扫描成像示意图。
对每个位置采集一条A线(深度方向)。不同横向位置的几条A线组合起来称为一帧B-扫描,而不同位置的几帧 B- 扫 描则形成 C- 扫 描 或 三 维数据集, 如 图 1(B)所示。
OMAG 的工作原理是基于对光谱仪采集到的光谱干涉信号的分析,如公式 (1)所示 :

其中,k是波数,t是采集一条 A 线的时间,ER 是从参考镜反射回来的光强,S(k)是所用光源的频谱密度,n是组织的折射率,z是深度坐标,a(z,t)是后向散射光的幅度,v为位于深度z1处的血管内血细胞的运动速度。考虑到来自于样品的后向散射光相对于来自于参考镜反射的光要微弱得多,我们可以忽略样品内从不同位置散射的光信号之间的自相关、互相关。同时,直流信号对OMAG信号没有贡献,因此,也不予考虑。接着,应用一个基于差分运算的高通滤波器,其运算公式如公式 (2):
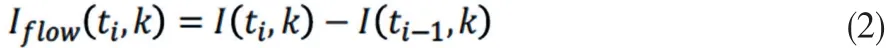
其中,i表示A 线或B-扫描的索引。该滤波器能针对较快流速或较慢流速,分别用于B-扫描或C-扫描方向。同样,公式 (2)也适用于时域信号(例如 OCT 信号)。已有研究表明,多普勒 OMAG也可对微循环组织床的功能性血管的血液流速进行在体定量分析。该方法同时利用了OMAG和相位分辨方法的优点,并引入了通过数字重建实现 对 组 织 背 景 光 学 性 质 均 匀 化 的 方 法[19]。 血 液 流 速 取 决于两条 A 线之间的时间间隔 (Δtb),可通过公式 (3)计算 :

其中,λ是光波长,Δφ是两条A线之间的相位差,n是样品的折射率。实验表明,OMAG在快速扫描(B-扫描)方向对流速的灵敏度可达 160 μm/s[19],慢速扫描(C- 扫描)或 M- 模式扫描(重复扫描)方向的灵敏度为 4μm/s[20]。
2 OMAG的应用
OMAG 能够在体实现对人体及动物组织中单根毛细管三维血管形态的定量分析,对于我们了解一些疾病的机理是非常有价值的。在过去的研究中,OMAG 已被用于在体监测生物组织的微血管造影,包括小鼠耳朵[21]、人眼视网膜[22]、大鼠视网膜[23]、人体角膜 - 巩膜边缘[24]、小鼠颅内脑血管灌注[25]、沙鼠耳蜗[26]、小鼠耳蜗[27]、小鼠肾脏内微循环[28]、正常人体皮肤和银屑病的皮肤内血管[29]、小鼠腓肠肌[30]等。同时,也有研究考察了 OMAG 技术的重复性,并提出了根据血管长度分布、血管区域密度和分形维数对图像进行量化的方法[31]。

图2 无需造影剂的OMAG/OCT对人的眼底血流分布进行无损成像。(A)OCT生成的眼底图,尺寸=10 mm×10 mm;(B)OMAG生成的眼底血流分布图,尺寸=8 mm×9 mm。图(B)相对应于图(A)中的方框位置。
OCT/OMAG 最大的优点是可以在无需使用外源造影剂的情况下对组织的血流分布进行无损成像。因为 OCT/ OMAG 是一种基于光学成像的技术,所以它最适用于对人眼进行成像。当今 OCT/OMAG 的成像速度已能达到每秒得到 500,000 条 A- 线。这种速度可以实现对人体眼底进行三维成像,并且能减少由于眼睛运动产生的伪影。图 2(A)是用每秒500,000条A- 线的系统扫描成的OCT 人眼眼底图。经过对 3-DOCT 数据的 OMAG 处理,就可得到眼底的血流分布图,图 2(B)给出了 OMAG 血流分布图。不需要用造影剂,OMAG 就能无损地呈现出人体眼底详细的血流分布情况,这对提高眼科相关疾病的诊断和治疗具有重大的医学意义。这些疾病涵盖了由糖尿病引起的眼睛病变、青光眼以及老年视力减缓症等。
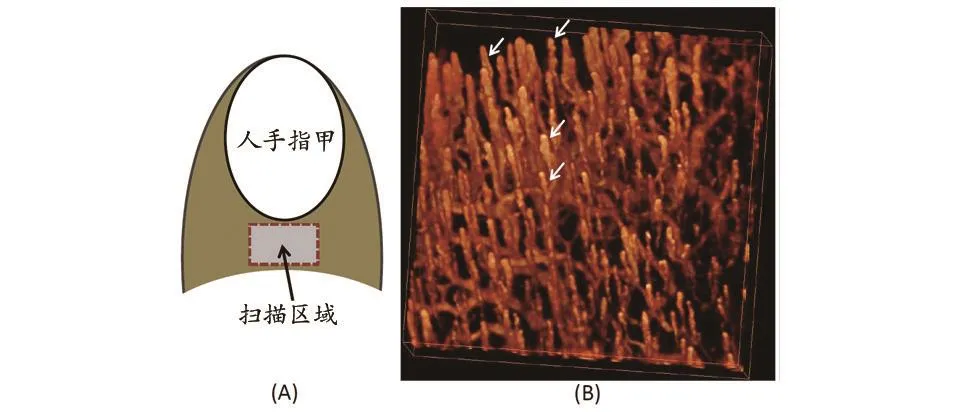
图3 OMAG对人手指表层毛细管血流分布进行成像。(A)手指成像示意图;(B)相应位置的毛细管血流分布图,尺寸=2 mm×2 mm。
图 3给出了人手指背面血管的 3D 投影视图。从图中,我们可以观察到手指的血管结构(例如长度、直径、密度和曲率)与人眼视网膜血管有着显著的区别。血管的前端呈现出正常皮肤的典型循环结构(如图 3 中箭头所示)[32]。这些关于指端微血管的结构及血流情况的研究,可以辅助医生对结缔组织疾病、雷诺氏病以及糖尿病等疾病做出更加准确的诊断。
图 4给出了使用 OMAG 技术获得的小鼠耳部血管的投影 视 图。小鼠耳 朵 是 研 究 烧伤[21]及 肿 瘤[33]引 起 的 血 流变化的重要模型。如图中所示,OMAG可以清晰地显示出小鼠耳部的各级血管包括毛细血管网的形态结构。通过后期的图像处理及分析,我们还可以提取出血管直径、血管密度、血流方向及血流速度等重要信息。这对研究伤口愈合、血管生成等生理过程具有重要意义。
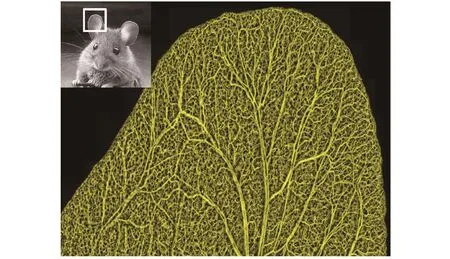
图4 OMAG对皮肤表层毛细管血流分布进行成像。图示为小鼠耳部的详细血流分布图。尺寸= 10 mm×9 mm。
图5 给出了小鼠大脑在完整头骨下的血管投影视图。小鼠大脑是一个很好的模型,可用于研究中脑动脉堵塞和脑外伤导致的脑中风以及药物对脑血流的影响。
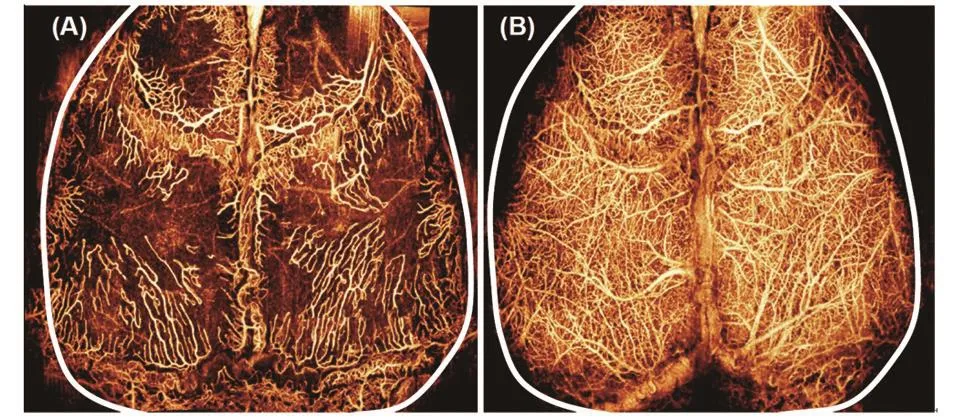
图5 OMAG对活体小鼠大脑血流分布进行成像,并且成像不需要对脑骨进行处理。只要一次3D扫描,OMAG就可同时给出小鼠(A)脑骨中和(B)大脑皮层的详细血流分布图。尺寸=10 mm×10 mm。
3 结论
OMAG 是一种无创、无标记的成像方法,可以获得组织血管的三维血管造影,并能分辨到毛细血管层。该技术利用了傅立叶域 OCT干涉信号中的散射光信号特性,来分离血流灌注血管。虽然本文突出了该方法无需使用标记物,但使用造影剂(如纳米颗粒和微泡)很可能会增强运动元素的后向散射光信号,从而进一步提高 OMAG 的成像质量。OMAG 能够获得深度为几毫米的图像,具有较高的空间和时间分辨率。到目前为止,该成像技术已在在体生物组织,如脑、耳、视网膜、耳蜗及皮肤等方面得到了广泛的应用。对组织血管造影的研究将极大的帮助人们加深对一些疾病病理学(如血管生成、与年龄有关的黄斑变性)的理解,以及对新药物的开发和研制(如,促进伤口愈合的药物)等。
[1] Fercher AF,Drexler W,Hitzenberger CK,et al.Optical coherence tomography-principles and applications[J].Reports on Progress in Physics,2003,66(2):239-303.
[2] Tomlins PH,Wang RK.Theory,developments and applications of optical coherence tomography[J].J Phys D:Appl Phys,2005,38(15):2519-35.
[3] Zhao Y,Chen Z,Ding Z,et al.Real-time phase-resolved functional optical coherence tomography by use of optical Hilbert transformation[J].Opt Lett,2002,27(2):98-100.
[4] Stücker M,Baier V,Reuther T,et al.Capillary blood cell velocity in human skin capillaries located perpendicularly to the skin surface:measured by a new laser Doppler anemometer[J].Microvasc Res,1996,52:188-192.
[5] Wang RK,Ma Z.Real time flow imaging by removing texture pattern artefacts in ultrafast spectral domain optical Doppler tomography[J].Optics Letters,2006,31(20):3001-3003.
[6] Vakoc BJ,Lanning RM,Tyrrell JA,et al.Three-dimensional microscopy of the tumor microenvironment in vivo using optical frequency domain imaging[J].Nat Med,2009,(15):1219-1223.
[7] Bachmann AH,Villiger ML,Blatter C,et al.Resonant Doppler flow imaging and optical vivisection of retinal blood vessels[J].Opt Express,2007,15(2):408-422.
[8] Szkulmowski M,Szkulmowska A,Bajraszewski T,et al.Flow velocity estimation using joint spectral and timedomain optical coherence tomography[J].Opt Express,2008,16(9):6008-6025.
[9] Mariampillai A,Standish BA,Moriyama EH,et al.Speckle variance detection of microvasculature using swept-source optical coherence tomography[J].Opt Lett,2008,33(13):1530-1532.
[10] Fingler J,Schwartz D,Yang C,et al.Mobility and transverse flow visualization using phase variance contrast with spectral domain optical coherence tomography[J].Opt Expre ss,2007,15(20):12636-12653.
[11] Tao YK,Davis AM,Izatt JA.Single-pass volumetric bidirectional blood flow imaging spectral domain optical coherence tomography using a modified Hilbert transform[J].Opt Express 2008,16(16):12350-12361.
[12] Wang RK,Jacques SL,Ma Z,et al.Three dimensional optical angiography[J].Opt Express,2007,15(7):4083-4097.
[13] Wang RK,Hurst S.Mapping of cerebrovascular blood perfusion in mice with skin and cranium intact by optical micro-angiography at 1300nm wavelength[J].Optics Expre ss,2007,15(18):11402-11412.
[14] Wang RK.Directional blood flow imaging in volumetric optical micro-angiography achieved by digital frequency modulation[J].Optics Letters,2008,33(16):1878-1880.
[15] An L,Wang RK.In vivo volumetric imaging of vascular perfusion within human retina and choroids with optical microangiography[J].Optics Express,2008,16(15):11438-11452.
[16] Wang RK.Optical microangiography:a label free 3D imaging technology to visualize and quantify blood circulations within tissue beds in vivo[J].IEEE Journal of Selected Topics in Quantum Electronics,2010,16(3):545-554.
[17] Wang RK.In vivo full range complex Fourier domain optical coherence tomography[J].Appl Phys Lett,2007,90(5):54-103.
[18] Wang RK.Fourier domain optical coherence tomography achieves full range complex imaging in vivo byintroducing a carrier frequency during scanning[J].Phys Med Biol,2007,52(19):5897-5907.
[19] Wang RK,An L.Doppler optical micro-angiography for volumetric imaging of vascular perfusion in vivo[J].Opt Express, 2009,17(11):8926-8940.
[20] An L,Qin J,Wang RK.Ultrahigh sensitive optical microangiography for in vivo imaging of microcirculations within human skin tissue beds[J].Opt Express,2010,18(8):8220-8228.
[21] Qin J,Reif R,Zhi Z,et al.Hemodynamic and morphological vasculature response to a burn monitored using a combined dual-wavelength laser speckle and optical microangiography imaging system[J].Biomed Opt Express,2012,3(3):455-466.
[22] Wang RK,An L,Francis P,et al.Depth-resolved imaging of capillary networks in retina and choroid using ultrahigh sensitive optical microangiography[J].Opt Lett,2010,35(9):1467-1469.
[23] Zhi Z,Cepurna W,Johnson E,et al.Volumetric and quantitative imaging of retinal blood flow in rats with optical microangiography[J].Biomed Opt Express,2011,2(3):579-591.
[24] Li P,An L,Reif R,et al.In vivo microstructural and microvascular imaging of the human corneo-scleral limbus using optical coherencetomography[J].Biomed Opt Express,2011,2(11):3109-3118.
[25] Wang RK,Hurst S.Mapping of cerebro-vascular blood perfusion in mice with skin and skull intact by Optical Micro-AngioGraphy at 1.3 mum wavelength[J].Opt Express,2007, 15(18):11402-11412.
[26] Choudhury N,Chen F,Shi X,et al.Volumetric imaging of blood flow within cochlea in gerbil in vivo[J].IEEE J Sel Top Quantum Electron,2009,20(99):1-6.
[27] Subhash HM,Davila V,Sun H,et al.Volumetric in vivo imaging of microvascular perfusion within the intact cochlea in mice using ultra-high sensitive optical microangiography[].IEEE Trans Med Imaging,2011,30(2):224-230.
[28] Zhi Z,Jung Y,Jia Y,et al.Highly sensitive imaging of renal microcirculation in vivo using ultrahigh sensitiveoptical microangiography[J].Biomed Opt Express,2011,2(5):1059-1068.
[29] Qin J,Jiang J,An L,et al.In vivo volumetric imaging of microcirculation within human skin under psoriatic conditions using optical microangiography[J].Lasers Surg Med,2011,43(2):122-129.
[30] Jia Y,Li P,Dziennis S,et al.Responses of peripheral blood flow to acute hypoxia and hyperoxia as measured by optical microangiography[J].PLoS One,2011,6:e26802.
[31] Reif R,Qin J,An L,et al.Quantifying optical microangiography images obtained from a spectral domain optical coherence tomography system[J].Int J Biomed Imaging,2012,2012(9):509783.
[32] Nagy Z,Czirják L.Nailfold digital capillaroscopy in 447 patients with connective tissue disease and Raynaud’s disease[J].J Eur Acad Dermatol Venereol,2004,18(1):62-68.
[33] Fukumura D,Jain RK.Imaging angiogenesis and the microenvironment[J].APMIS,2008,116(7-8):695-715.
Label Free Optical Microangiography of Tissue Microcirculations in Vivo
Ruikang K Wang
Department of Bioengineering, University of Washington, Seattle, Washington 98195, USA.
Pathologies and vascular forms of most biological tissues are closely associated with the changes of tissue microcirculations. Optical coherence tomography (OCT) is an imaging technique capable of providing non-invasive three-dimensional (3D) images of tissue microstructure with cellular level resolution. As a recent technological extension to OCT, optical microangiography (OMAG) is a volumetric imaging technique that is capable of producing 3D images of dynamic blood perfusion within microcirculatory tissue beds in vivo. OMAG is of high spatial resolution that is sufficient to delineate single capillary vessels, and does not require the use of contrast agents. The OMAG imaging contrast is based on the intrinsic optical scattering signals backscattered by moving blood cells in patent blood vessels. In this paper, I will first provide a brief review of the OMAG theory, and then present some examples of using OMAG to delineate the dynamic blood perfusion, down to capillary level resolution, within living tissues, including brain, skin, and retina.
Fourier domain optical coherence tomography; optical microangiography; optical imaging; in vivo imaging; bioinstrumentation
TH773;R197.39
A
10.3969/j.issn.1674-1633.2013.11.001
1674-1633(2013)11-0001-04
2013-10-10
2013-10-29
作者邮箱:wangrk@uw.edu
