IL-23/IL-17炎症轴在实验性自身免疫性肝炎中的作用
2013-07-25李晓妮邓志华
李晓妮 邓志华* 贺 静 王 琪
(山西医科大学第二医院消化内科,山西 太原 030001)
IL-23/IL-17炎症轴在实验性自身免疫性肝炎中的作用
李晓妮 邓志华* 贺 静 王 琪
(山西医科大学第二医院消化内科,山西 太原 030001)
目的 通过建立实验性自身免疫性肝炎小鼠模型,观察外源性IL-23对实验性自身免疫性肝炎模型小鼠中IL-17的影响,探讨其可能的作用机制。方法 以肝抗原S-100免疫C57BL/6小鼠制作自身免疫性肝炎动物模型,提取出脾淋巴细胞,将IL-23加入到抗CD3抗体活化后的脾淋巴细胞中进行培养,免疫组化观察IL-17在肝细胞中的分布及表达水平,RT-PCR和ELISA检测IL-17在脾淋巴细胞中的表达。结果 与对照组相比,模型组肝细胞中IL-17表达升高;IL-23作用于模型组活化的脾淋巴细胞后IL-17的表达水平明显高于对照组。结论IL-23/IL-17炎症轴在EAH的病理机制中发挥着重要的作用,IL-23可能通过上调IL-17的表达使AIH模型小鼠症状加重,并为AIH的治疗提供了新的靶点。
实验性自身免疫性肝炎;白细胞介素17;白细胞介素23
自身免疫性肝炎(AIH)是一种慢性进行性肝脏炎症性疾病,以汇管区淋巴细胞、浆细胞浸润,并侵入肝脏实质,形成界面下肝炎的肝脏特异性组织学改变、高免疫球蛋白、循环自身抗体及对免疫抑制剂治疗有所反应为其主要特征[1,2],主要累及中老年妇女。近年来,国内外对AIH的研究十分活跃,其发病机制还尚未完全阐明。
Th17细胞为近年来新发现的CD4+T细胞亚型,它通过分泌IL-17A(即IL-17)、IL-17F和TNF-α等因子而在自身免疫性疾病中发挥重要的作用[3]。IL-17A作为IL-17家族的代表性因子,已经发现在多种自身免疫性疾病中均有不同程度的升高。有学者在研究原发性胆汁性肝硬化(PBC)发病过程中胆管的固有免疫作用时发现,Th17细胞相关的主要细胞因子IL-17在PBC患者胆管的慢性炎症中发挥重要作用[4]。同时,也有研究发现PBC患者肝脏汇管区IL-17表达明显增多[5]。国外报道体外诱导Th17细胞分化产生IL-17与多种细胞因子密切相关,其中IL-23在诱导其分化过程中起到十分关键的作用[6]。IL-23作为IL-12家族的新成员,在一些炎症性自身免疫性疾病模型的形成和发展中起着十分重要的作用,如炎症性肠病(IBD)、自身免疫性脑脊髓膜炎(EAE)、胶原诱导的关节炎(CIA)、实验性自身免疫性葡萄膜炎(EAU)[7-11]。同时,也有实验证明在这些疾病模型中IL-23可促进Th17细胞的分化、增殖,进一步促进IL-17的分泌[12],这些结果说明了IL-23/IL-17通路在一些自身免疫性疾病的发病机制中起着一定的作用,但IL-23/IL-17在AIH疾病的发生、发展过程中的作用机制仍不清楚。为此,本研究建立EAH模型,旨在通过观察IL-23对自身免疫性肝炎小鼠模型IL-17水平的影响,为揭示IL-17/IL-23炎症轴在EAH发病机制中所起的作用提供一定的理论和实验依据。
1 材料与方法
1.1 材料
1640培养基(美国HyClone公司),兔抗小鼠IL-17A、羊抗兔IgG(武汉博士德生物工程有限公司),小鼠脏器组织淋巴细胞分离液(天津灏洋生物制品科技有限责任公司),小鼠白细胞介素-17ELISA试剂盒(武汉博士得生物工程有限公司),IL-23 小鼠CD3单抗(美国eBiosicience公司),FITC-标记羊抗小鼠IgG(H+L)(美国Earthax公司),佛氏完全佐剂(美国sigma公司),FastStart Universal SYRB Green Master(ROX)(TAKARA),IL-17A引物:上游:5’-CTGAT CAGGACGCGCAAAC-3’;下游:5’-TCGCTGCTGCCTTCACTGTA -3’,β-actin引物:上游:5’-AAGTGTGACGTTGACATCCG-3’;下游:5’-TCTGCATCCTGTCAGCAATG-3’ (TAKARA)。
1.2 建立动物模型
1.2.1 四周龄雄性清洁级C57BL/6小鼠50只购自北京军事医学科学院实验动物中心,体质量(20±2)g。购回后饲养于山西医科大学动物实验中心,恒温、恒湿条件下自由摄取食物和水,饲养1周左右后开始试验。
1.2.2 抗原的准备
将10只雄性C57BL/6小鼠的肝脏取出,置冰上剪碎,生理盐水反复冲洗除去血液,与等量的生理盐水进行匀浆,匀浆后行超声粉碎,使肝细胞内蛋白质充分释出。将匀浆液以2000r/min离心10min以去除细胞核部分,收集上清液后超速离心机以241000r/min的速度离心1h。该上清液即含肝抗原,即S-100抗原。此抗原需在用前新鲜制备效果较好。
1.2.3 模型构建
将实验动物按照数字分组法随机分为2组,每组20只。第1组(对照组),第1天和第7d以0.5mL的生理盐水与等体积的佛氏完全佐剂(CFA)充分乳化后予小鼠腹腔注射;第2组(模型组),第1天和第7天以新鲜制备的0.5~2.0g/L的S-100 0.5mL与等体积的CFA充分乳化后予小鼠腹腔注射。各组小鼠于第28天后处死。水合氯醛麻醉后摘取眼球采集外周血,以2000r/min离心10min后分离血清于-20℃短期保存待测,后脱颈处死小鼠,取出肝脏和脾脏组织,肝脏组织经10%的福尔马林固定,石蜡包埋,切片待行肝脏组织HE染色,光镜观察。脾脏组织立即提取淋巴细胞。
1.2.4 C57BL/6小鼠自身免疫性肝炎造模成功的确定
处死小鼠后检测模型组和正常对照组血清中的白蛋白、球蛋白、AIT、AST、TBIL、抗平滑肌抗体(SMA)和抗核抗体(ANA)的水平,肝脏组织的HE染色观察炎症程度。所有的这些结果可用来估计自身免疫性肝炎C57BL/6小鼠模型构建是否成功。
1.3 实验方法
1.3.1 免疫组化
取小鼠肝脏组织标本经10%的中性甲醛固定后石蜡包埋切片,约4μm厚度,经梯度酒精固定、二甲苯脱蜡后,用3%的双氧水阻断内源性过氧化物酶,蒸馏水冲洗PBS浸泡后,枸橼酸盐缓冲液高温修复,滴加山羊血清进行封闭,甩去血清后加兔抗小鼠(1∶200)后置于湿盒中4℃过夜孵育,PBS冲洗后滴加羊抗兔抗体,室温孵育30min,PBS冲洗后加DAB显色剂显色,梯度酒精脱水、二甲苯透明后用中性树胶封片。借助图像分析系统对组织切片中的阳性细胞进行图像分析。
1.3.2 脾脏淋巴细胞的提取和培养:
从小鼠体内取出脾脏,用PBS冲洗后,置于200M的尼龙网上研磨,研磨出的细胞过滤到盛有3mL的1640细胞培养基中,将含研磨后细胞的1640细胞培养基沿管壁缓慢加入到已盛有6mL淋巴细胞分离液的离心管中,2000r/min离心15min,收集淋巴细胞到另一离心管中,加入3mL的1640细胞培养基,再次离心,1500r/min离心15min后,弃掉上清液,加入含10%胎牛血清、100U/mL青霉素、100μg/mL链霉素的1640细胞培养基,使细胞悬浮,计数后,将悬浮细胞接种至24孔细胞培养板中,每孔细胞数约(0.5~0.8)×106/mL。从一只小鼠提取出的脾淋巴细胞分三组:第一组空白组,细胞不予任何处理;第二组IL-23组,在0、24h、48h时加入20ng/mL的IL-23;第三组IL-23+抗CD3单抗组,加入2μg/mL的抗CD3抗体,并在0、24h、48h时加入20ng/mL的IL-23。将24孔板放于37℃、5%CO2培养箱中。
1.3.3 IL-17在细胞上清液中的表达水平
淋巴细胞在培养72h后,收集细胞上清液,-80℃冻存,检测时取出,在室温下放置20min以平衡室温,用采用双抗体夹心法ELISA试剂盒,严格按照操作说明的方法,检测IL-17A在细胞上清液的水平,每个样本设3个复孔。
1.3.4 荧光定量PCR
收集培养72h后的淋巴细胞,严格按照操作步骤进行操作:①总RNA的提取:弃去上清,按细胞1×107/mL加入1mL的RNAiso试剂提取总RNA;②将RNA反转录为cDNA;③在ABI Prism7300荧光定量PCR仪上两步法进行扩增,扩增完成后设定基线值和阈值,读取阈循环(Ct)值。采用2-△△Ct方法计算相对定量结果。PCR反应条件:95℃变性30s,95℃5s,60℃31s,共40个循环。每个样本设3个复孔。
1.4 统计学分析
计量资料以均数±标准差表示,采用单因素方差分析进行多组均数间的比较,两两比较采用LSD检验。以P<0.05表示差异具有统计学意义,采用SPSS17.0软件进行统计学处理。
2 结 果
2.1 小鼠血清中ALT、AST、TBIL、A、G的含量变化以及抗核抗体的检查,小鼠血清中ALT、AST、A、G含量比较,模型组与对照组相比,差异均有统计学意义(P<0.05),虽然模型组血清中TBIL的含量较对照组的高,但两者差异并无统计学意义(P>0.05)(表1)。同时,在荧光显微镜下我们并未见到SMA特异性线性荧光,但可见到较为明显的ANA特异性荧光。
表1 小鼠血清生化指标的检测结果
2.2 小鼠肝脏组织病理变化
对照组小鼠肝细胞形态正常,以中央静脉为中心向四周呈放射状排列,肝小叶结构清晰,无炎性细胞浸润。模型组小鼠均观察到肝脏的不同病变,在肝小叶和汇管区可见到淋巴细胞和浆细胞浸润为主的炎性反应,中间夹杂少量的中性粒细胞。部分细胞严重浸润破坏了肝小叶的正常结构,可出现点状坏死、片状坏死(图1)。
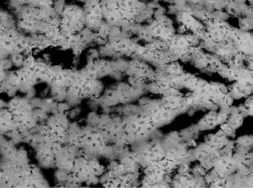
图1-1 正常对照组小鼠血清中抗核抗体的表达(免疫荧光×200倍)

图1-2 模型组小鼠血清中抗核抗体的表达(免疫荧光×400倍)
2.3 IL-17在自身免疫性肝炎小鼠肝细胞的表达
为研究IL-17在自身免疫性肝炎病理机制中的重要作用,我们通过免疫组化的方法分析IL-17A在肝细胞中的分布及表达水平。结果如图2所示:正常对照组小鼠的肝细胞中几乎没有IL-17A的表达,而模型组小鼠的肝细胞中有明显的IL-17A+细胞浸润,并且IL-17A+细胞主要分布于汇管区和肝小叶区,并有大量的淋巴细胞浸润。同时结果发现IL-17A+细胞的频数与肝脏的炎性程度成正相关(r=0.70,P<0.01)。
2.4 IL-17A在淋巴细胞上清液中的表达
模型组和对照组的淋巴细胞在相同条件下分组进行培养后,收集细胞上清液后经ELISA检测发现:空白组中,模型组培养的淋巴细胞上清液中IL-17A的含量较对照组中的高,两者有统计学差异(P<0.01);在IL-23组和IL-23+抗CD3单抗组中,与对照组相比较,模型组细胞上清液中IL-17A的含量显著升高(P<0.05);而且,在模型组中,经IL-23刺激活化后淋巴细胞的上清液中IL-17A的含量明显升高,差异有统计学意义(P<0.01)(图2,表2)。
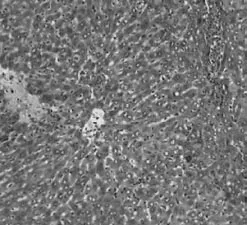
图2-1 正常对照组小鼠肝组织(HE×100倍)
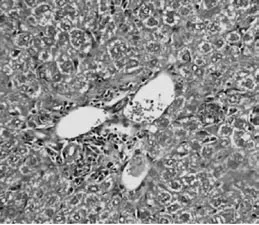
图2-2 模型组小鼠肝组织(HE× 400倍)
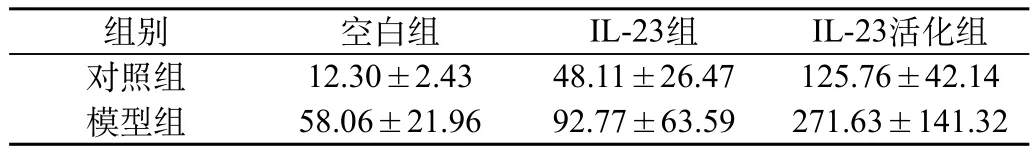
表2 上清液中IL-23对IL-17A表达的影响(浓度pg/mL)(n=18)
2.5 IL-17A mRNA在淋巴细胞中的表达水平
荧光定量PCR检测结果:空白组中,模型组培养的淋巴细胞中IL-17A mRNA水平比对照组的高,两者差异有统计学意义(P<0.01);在IL-23组和IL-23+抗CD3单抗组中,与对照组相比较,模型组淋巴细胞中IL-17A mRNA的表达水平升高(P<0.01);且在模型组中,IL-23刺激活化后比刺激未活化更高,二者差异有统计学意义(P<0.01)(表3)。
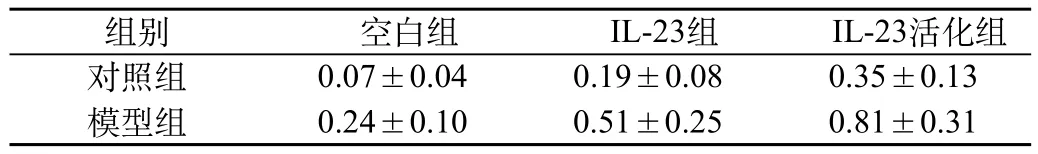
表3 淋巴细胞中IL-23对IL-17A mRNA表达的影响(Ct)(n=17)
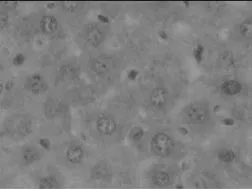
图3-1 正常对照组小鼠肝组织(免疫组化×400倍)
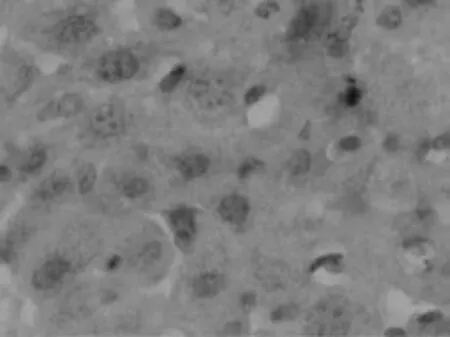
图3-2 模型组小鼠肝组织(免疫组化×400倍)
3 讨 论
近年来,AIH的发生率逐渐上升,引起人们的广泛关注,但其病因及发病机制仍不清楚,而缺乏典型的AIH动物模型可能是其主要原因之一。AIH动物模型的构建方法有多种,目前比较经典的主要有以下四种:肝抗原、刀豆蛋白A(ConA)、α-半乳糖基神经酰胺(α-GalCer)诱导的肝炎动物模型和转基因小鼠模型。其中,ConA和α-GalCer更倾向于诱导肝脏的急性炎性反应,且所产生的炎性细胞因子维持时间较短,与人AIH的特点不相符合,而转基因小鼠虽然是近年来的研究热点,但是由于肝脏作为AIH的靶器官,存在强大的免疫耐受,难以建立成功的AIH模型,且造模的方法比较复杂,所以,基于以上原因,我们采用易感动物C57BL/6小鼠,以S-100肝抗原与佛氏完全佐剂充分乳化后,2次腹腔注射即诱导出实验性自身免疫性肝炎。操作方法简单,且免疫持续时间较久,肝脏组织学改变与人自身免疫性肝炎的组织学特征相似,均有大量炎性细胞浸润,以淋巴细胞为主,伴肝细胞点状、片状坏死,同时模型组小鼠血清中A/G比值倒置、转氨酶升高、血清中抗核抗体(ANA)阳性均符合临床病例特点。综合上述证明该模型是成功的实验性自身免疫性肝炎小鼠模型。
Th17细胞是新近发现的一种区别于Th1和Th2的辅助性T细胞,其在表现、功能和形成途径都与其他两种不同[13]。而IL-17作为Th17细胞分泌的关键性促炎因子,通过诱导纤维母细胞、内皮细胞、巨噬细胞和上皮细胞分泌多种炎症介质和趋化因子,募集中性粒细胞诱导炎症发生,引起组织损害[14]。近来,越来越多的实验发现IL-17在肝脏的炎症作用中发挥一定的重要性。原发性胆汁性肝硬化(PBC)病人外周血中IL-17和肝脏中IL-17+细胞都明显增多[15]。国外已有研究报道IL-17在一些自身免疫性疾病的发病机制中起着十分重要的作用,如类风湿关节炎(RA)[16]、EAE[17]、IBD[18]、系统性红斑狼疮(SLE)[19]。事实上,已有研究发现IL-17在一些肝脏疾病的病理机制中发挥一定的作用[20],但它在AIH中的作用仍不清楚。在本实验中,我们发现与对照组相比,在EAH小鼠中IL-17A的蛋白和分子水平明显升高。而且,在EAH小鼠的肝脏中存在明显的IL-17A+细胞浸润,IL-17A+细胞的表达与炎症程度成正相关。我们的实验说明IL-17A可能与EAH的发病机制相关。
IL-23是新近发现的细胞因子,与IL-12共同分享IL-12p40和IL-12Rβ1亚单位[21],但其功能和作用与IL-12不同。研究发现IL-23受体只在活化的辅助T细胞和记忆T细胞中表达,对于Th17细胞的存活、增殖以及IL-17的分泌至关重要。近年来,越来越多的实验证实IL-23参与的Th17细胞引起的炎性反应即IL-23/IL-17炎症轴被认为在自身免疫性疾病的发生、发展中起着至关重要的作用[22],但IL-23与IL-17在AIH疾病中的相互关系仍不清楚。本实验中,与对照组相比,模型组中IL-23可促进活化的淋巴细胞分泌IL-17A,使其表达量明显升高。而对未活化的淋巴细胞中IL-17的作用则不十分明显。这些结果说明了IL-23可能通过上调活化的淋巴细胞中IL-17A的表达而在EAH疾病的发病机制中发挥独特的作用。研究发现在IBD、多发性硬化和自身免疫性葡萄膜炎各自的临床表现、病理特征以及自身抗体都不相同,但有研究指出在这些自身免疫性疾病中IL-23和IL-17的表达都上调[23,24],可以说IL-23/IL-17可能是这些自身免疫性疾病的一个独特的炎症通路,而这个炎症通路可能为这些自身免疫性疾病提供新的治疗策略。本实验仅说明IL-17在EAH小鼠中的表达升高,IL-23可能通过上调活化的淋巴细胞中IL-17A而发挥作用,但并未对IL-23在EAH中的表达以及IL-23和IL-17之间的相关性进行分析,同时对于研究IL-23可诱导Th17细胞分泌IL-17炎性因子的转录机制也很关键,这些都有待于进一步研究。
总之,IL-23/IL-17炎症通路在EAH小鼠的发病机制中有着十分重要的作用,更深层次的理解IL-23/IL-17炎症通路可能对于AIH疾病的治疗和预防提供新的靶点。
[1] Krawitt EL.Autoimmune Hepatitis[J].N Engl J Med,2006,354(1): 54-66.
[2] Manns MP,Vogel A.Autoimmune hepatitis,from mechanisms to therapy[J].Hepatology,2006,43(S1):S132-S144.
[3] Harrington LE,Hatton PR.Interleukin 17-producing CD4+effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages[J].Nat Immunol,2005,6(11):1123-1132.
[4] Harada K,Shimoda S,Sato Y,et al.Periductal interleukin-l7 production in association with biliary innate immunity contributes to the pathogenesis of cholangiopathy in primary biliary cirrhosis[J].Clin Exp Immunol,2009,157(2):26l-270.
[5] Lan RY,Salunga TL,Tsuneyama K,et al.Hepatic lL-17 responses in human and murine primary biliary cirrhosis[J].Autoimmun, 2009,32(1):43-5l.
[6] Volpe E,Servant N,Zollinger R,et al.A critical function for transforming growth factor-β,interleukin 23 and proinflammatory cytokines in Driving and modulating human TH-17 responses[J]. Nat Immunol,2008,9(6):650-657.
[7] Langrish CL,Chen Y,Blumenschein WM,et al.IL-23 drives a pathogenic T cell population that induces autoimmune inflammation [J].Exp Med,2005,201(2):233-240.
[8] Yen D,Cheung J,Scheerens H,et al.IL-23 is essential for T cellmediated colitis and promotes inflammation via IL-17 and IL-6[J]. Clin Invest,2006,116(5):1310-1316.
[9] Cua DJ,Sherlock J,Chen Y,et al.Interleukin-23 rather than interleukin-12 is the critical cytokine for autoimmune inflammation of the brain[J].Nature,2003,421(6924):744-748.
[10] Murphy CA,Langrish CL,Chen Y,et al.Divergent pro- and antiinflammatory roles for IL-23 and IL-12 in joint autoimmune inflammation[J].Exp Med,2003,198(12):1951-1957.
[11] Caspi R,Silver P,Cua D,et al.IL-23 and IL-17 in pathogenesis of experimental ocular autoimmunity: requirement for IL-23 may extend beyond its role in sustaining the IL-17 effector response[J]. Immunol,2007,178(4):129.
[12] Wilson NJ,Boniface K,Chan JR,et al.Development,cytokine profile and function of human interleukin 17-producing helper T cells[J]. Nat Immunol,2007,8(9):950-957.
[13] Korn T,Bettelli E,Oukka M,et al.IL-17 and Th17 Cells[J].Annu Rev Immunol,2009,27:485-517.
[14] Stockinger B,Veldhoen M.Differentiation and function 0f Th17 T cell[J].Curr Opin Immunol,2007,19(3):281-286.
[15] Lan RY,Salunga TL,Tsuneyama K,et al.Hepatic IL-17 responses in human and murine primary biliary cirrhosis[J].J Autoimmun, 2009,32(1):43-51.
[16] Colin EM,Asmawidjaja PS,Van Hamburg JP,et al.1,25-Dihydmxyvitamin D3modulates Thl7 polarization and interleukin-22 expression by memory T cells from patients with early theumatoid arthritis[J].Arthritis Rheum,2010,62(1):132-142.
[17] Komiyama Y,Nakae S,Matsuki T,et al.IL-17 plays an important role in the development of experimental autoimmune encephalomyelitis[J].J Immunol,2006,177(1):566-573.
[18] Niess JH,Leithanser F,Adler G,et al.Commensal gut flora drives the expansion of proinflammatory CD4+T cells in the colonic lamina propria under normal and inflammatory conditions[J].J Immunol,2008,180(1):559-568.
[19] Wong CK,Lit LC,Tam LS,et al.Hyperproduction of IL-23 and IL-17 in patients with systemic lupus erythematosus:implications for Th17-mediated inflammation in auto-immunity[J].Clin Immunol,2008,127(3):385-393.
[20] Bertolino P.Interleukin-22,interleukin-17,and other cytokines:a wall is coming down[J].Hepatology,2008,47(1):345-348.
[21] Oppmann B,Lesley R,Blom B,et al.Novel p19 protein engages IL-12p40 to form a cytokine,IL-23,with biological activities similar as well as distinct from IL-12[J].Immunity,2000,13(5):715-725.
[22] Kikly K,Liu I,Na S.The IL-23/Th(17)axis:therapeutic targets for autoimmune inflammation[J].Curr Opin Immunol,2006,18(6):670-675.
[23] Amadi-Obil A,Yu C,Liu X,et al.TH17 cells contribute to uveitis and scleritis and are expanded by IL-2 and inhibited by IL-27/ STAT1[J].Nat Med,2007,13(6):711-718.
[24] Schmidt C,Giese T,Ludwig B,et al.Expression of interleukin-12 related cytokine transcripts in inflammatory bowel disease: elevated interleukin-23p19 and interleukin-27p28 in Crohn’s disease but not in ulcerative colitis[J].Inflamm Bowel Dis,2005,11(1):16.
The Role of IL-23/IL-17 in Experimental Autoimmune Hepatitis
LI Xiao-ni, DENG Zhi-hua*, HE Jing, WANG Qi
(Department of Gastroenterology, The Second Hospital of Shanxi Medical University, Taiyuan 030001,China)
Objective To investigate the variation of IL-17 in the model mice of experimental autoimmune hepatitis with exogenous IL-23 for its possible pathogenesis. Methods The C57BL/6 mice were immunized with S-100 to establish the model of experimental autoimmune hepatitis (EAH), the distribution and the expression levels of cytokines (IL)-17 in the murine liver using immunohistochemical method and lymphocyte from murine spleen were activated with anti-CD3antibody and treated with IL-23 in vitro, the cytokines, IL-17 were detected using reverse transcription-polymerase chain reaction (RT-PCR) and ELISA. Result The results were compared with those of normal controls, the expression of IL-17 were increased;We demonstrated that there were significantly increased IL-17A+ cells in livers of AIH mice, compared to normal mice using immunohistochemical method, and the expression of IL-17A was significant increase after treatment with IL-23 vs the non-IL-23-treatment control group and the cultured cells both were activated with anti-CD3antibody in AIH mice. Conclusion Our findings indicate that the IL-23/IL-17 inflammation axis play an important role in the pathogenesis of AIH, IL-23 on EAH may up-regulate the expression of IL-17 to accelerate the progress EAH, and which might be a target for treatment.
Experimental autoimmune hepatitis; IL-17; IL-23
R512.6
B
1671-8194(2013)24-0012-04
*通讯作者:E-mail:ykdzh@yahoo.com.cn
