WST-8比色法检测梨形四膜虫细胞活性
2013-07-24邹晓燕张洪武
邹晓燕 张洪武
(1.中国科学院城市环境研究所, 厦门 361021; 2.中国科学院大学, 北京 100049)
微生物易于实验控制, 已逐渐成为评价化学物质对水生态系统刺激效应的模式生物[1]。四膜虫(Tetrahymena pyriformis)是一种单细胞真核生物, 广泛存在于自然环境中, 是水生态健康的重要评价指标之一[2,3]。由于四膜虫繁殖迅速, 在最适条件下大约每 2.5—3h可以分裂一次;只需进行无菌培养, 就能得到数量较多的实验材料, 被广泛应用于细胞生物学、遗传学、生物化学及分子生物学[4—6], 在基础研究中一直处于前沿地位[7]。目前在毒性测试过程中,常用于评价四膜虫毒性效应的方法有血小板计数法[8]、自动细胞计数仪法[9]、比浊法[9]、干重法、生物荧光法等。血小板计数法过程繁琐、耗时长、重复性差, 不能及时反应四膜虫的生物情况, 不适合检测大批量样品; 而其他方法不能区分细胞的死活。可溶性噻唑蓝(WST-8)是一种类似于四甲基噻唑蓝(MTT)的化合物, 在电子耦合试剂存在的情况下, 可以被线粒体内的一些脱氢酶还原生成橙黄色的甲瓒[10]。与传统MTT比色法相比, 不必洗涤细胞和收集细胞, 也不必采用额外的步骤去溶解甲瓒, 适合大批量样品的检测。此外, WST-8法目前多用于免疫细胞的检测[11,12], 很少用于检测微生物的细胞活性。本研究用WST-8比色法检测梨形四膜虫的细胞活性, 并将结果与常规计数法进行比较。
1 材料与方法
1.1 菌株和培养基
GL-C梨形四膜虫(T.pyriformis)由中国科学院城市环境研究所杨军课题组提供。在 30℃恒温培养箱中培养24—30h。
PPYS培养基: 0.5%葡萄糖, 0.25%酵母浸粉, 0.25%胰蛋白胨, 25 mL分装于 100 mL三角瓶中, 120℃灭菌30min, 冷却备用。葡萄糖购置汕头市达濠精细化学品公司, 酵母浸粉和胰蛋白胨购置北京索莱宝科技有限公司(Beijing solarbio science & Technology Co., Ltd.), 上述试剂均为AR纯, 整个实验过程均使用超纯水配制。
1.2 试剂
CCK-8(Cell Counting Kit-8)试剂盒(含 WST-8试剂)购置碧云天生物技术研究所; 固定液: 用pH 7.2 PBS缓冲液将 25%戊二醛稀释至 3.0%; 玻璃仪器在使用前均用10%硝酸浸泡48h, 并用超纯水冲洗干净。
1.3 WST-8比色法测定
将不同浓度梯度的四膜虫培养液加入96孔板, 每孔100 μL, 各做三个平行, 然后每孔加入10 μL WST-8试剂,30℃恒温培养箱中培养, 0.5、1、2、3、4、5和 6h后取出, 用酶标仪测定450 nm下的吸光值(A450)。
1.4 常规计数法测定
取不同浓度梯度的四膜虫培养液300 μL, 加入25 μL 3.0%固定液, 混匀。然后用血球计数板计数, 每个样品镜检3次。
1.5 数据分析
所有实验结果重复三次, 结果用(均值±标准偏差)表示, 利用Origin8.0对其进行线性回归相关性分析。
2 结果
2.1 WST-8添加量对空白值的影响
从图 1中可以看出, 随着 WST-8加入量的增加, 背景空白越高, 当WST-8加入量达到20 μL时, 培养基空白达到 0.201±0.003, 该值远超样品的检测结果; 当 WST-8加入量为 5 μL时, 虽然空白值较低, 但其相对标准偏差RSD较大(RSD5μL=15.2%,RSD10μL=3.5%,RSD20μL=1.9%。从空白值考虑, 该检测方法WST-8最适加入量为10 μL。
2.2 WST-8的培养时间
图2结果显示样品吸光度A450随培养时间的延长逐渐增加。样品加入WST-8培养4h后其A450基本保持不变,变化率小于5.0%/h。
2.3 不同浓度对WST-8法检测结果的影响

图1 不同剂量WST-8对空白值的影响Fig.1 The effect of different dosage WST-8 on blank values
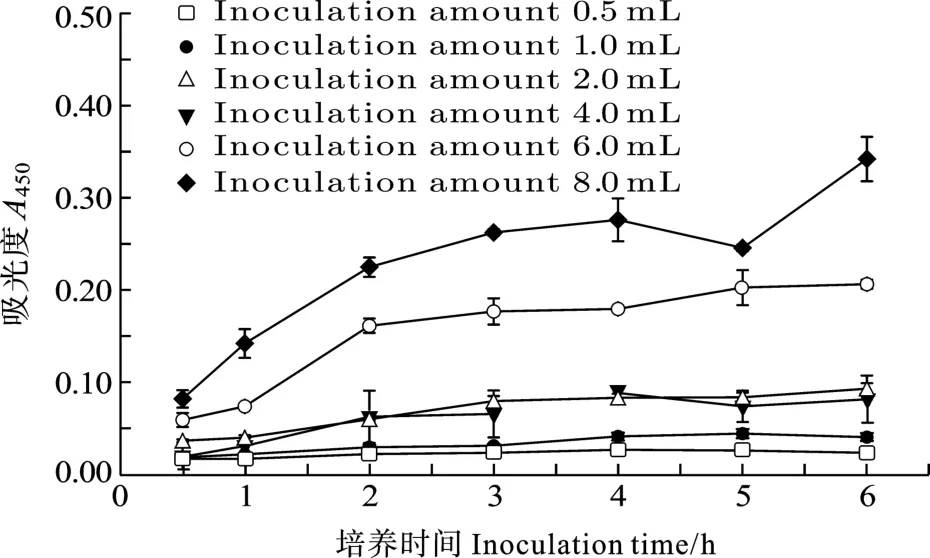
图2 不同培养时间对吸光度A450值的影响Fig.2 Effect of different inoculation time on A450
图3表示不同浓度对检测结果的影响。接种量在2%—32%范围内时,A450随接种量增加而增大。接种量越大,加入WST-8后培养时间对检测结果影响越明显。接种量越大, 四膜虫培养时间越长, 即四膜虫细胞密度越大, 检测结果的误差越大。四膜虫接种量为32%和40%, 四膜虫培养27h后 WST-8法检测结果的相对标准偏差RSD达到25.8%和41.2%。
2.4 WST-8法与常规计数法检测结果比较
图5结果显示, 四膜虫接种量在 2%—24%范围内,WST-8与计数法的检测结果均随四膜虫接种量的增加而逐渐加大,A450与四膜虫细胞数之间的相关系数R=0.879,经SPSS统计分析P<0.01, 说明两种检测方法结果呈极显著正相关。接种量越大, WST-8与计数法的检测结果相关性越弱。这是因为 WST-8法检测的是活细胞的数目, 接种量越大, 相同时间内死亡的四膜虫数量也越多,A450越小, 但四膜虫绝对细胞数却是增加的。从图5a可以看出,接种量达到40%时,A450值明显低于接种量为32%的样品;图5b接种量达到40%时,A450值与接种量为32%的样品相当, 这是因为在营养物质充足的情况下, 接种量大的四膜虫样品进入了新的生长周期, 细胞增殖, 活细胞数目增加,A450值增大。
2.5 用 WST-8方法检测五价砷(As(Ⅴ))对梨形四膜虫的毒性效应

图3 接种量对A450值的影响(A.四膜虫培养24h; B.四膜虫培养27h)Fig.3 Effect of different inoculation amount on A450 (A.24h after incubation; B.27h after incubation)

图4 不同接种量对相对标准偏差RSD的影响(加入WST-8后培养时间为4h)Fig.4 Effect of different inoculation amount on relative standard deviation (4h after adding WST-8)
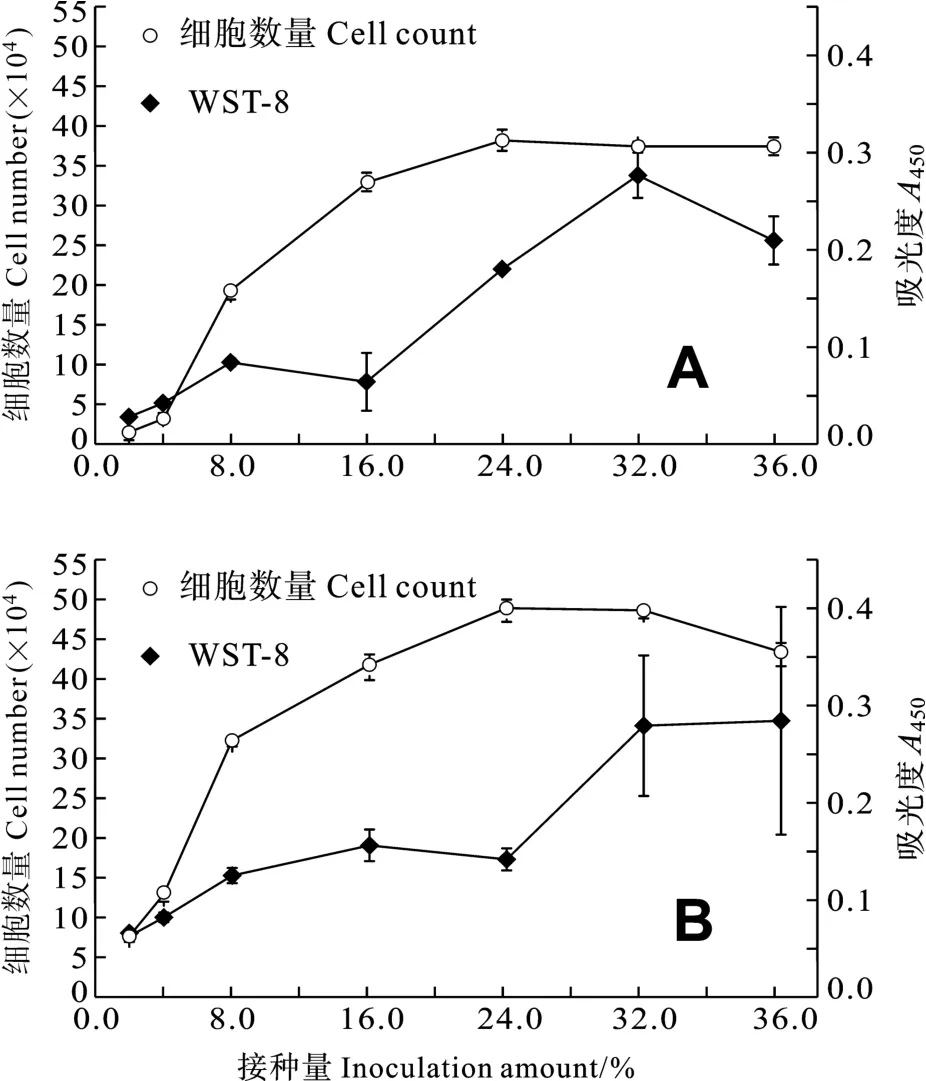
图5 常规计数法与WST-8法结果比较(A.四膜虫培养24h;B.四膜虫培养27h)Fig.5 Results comparison using conventional counting method and WST-8 colorimetric method(A.24h after incubation; B.27h after incubation)
图6分别用计数法和WST-8法检测As(Ⅴ)对四膜虫的毒性效应。计数法和WST-8法检测结果具有相同的变化趋势, 即低浓度As(Ⅴ)能够促进四膜虫的生长, 高浓度As(Ⅴ)抑制四膜虫生长。原因可能是低浓度外源物质可引起生物体应急反应, 但浓度过高则产生毒性, 抑制生物体生长发育和细胞活性[6]。两种检测方法对应的半效应浓度EC50分别为1.21 mg/L和0.88 mg/L。
3 讨论
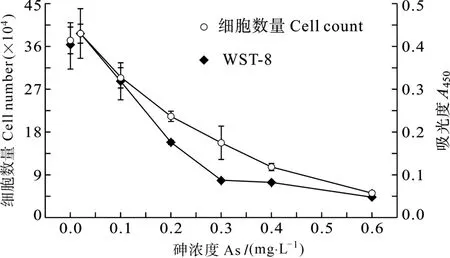
图6 As(Ⅴ)对四膜虫的毒性效应Fig.6 Toxic effect of As(Ⅴ) on T.pyriformis
众所周知, WST-8是一种类似于MTT的显色剂, 可以检测细胞存活和生长[9], 活细胞内的脱氢酶能还原WST-8形成橙黄色晶体, 细胞增殖越多越快, 则颜色越深; 细胞毒性越大, 则颜色越浅, 采用酶标仪在 450 nm处测其吸光度可间接反应活细胞的数量。但是当体系中存在影响细胞生长的因素时, 常会影响实验结果造成实验数据误差。本实验通过空白背景值的比较, 确定 WST-8最适加入量为10 μL, 对加入 WST-8后的培养时间比较,确定最佳培养时间为4h。接种量在2%—24%范围内, 计数法与 WST-8法检测结果呈极显著正相关(R=0.879,P<0.01), WST-8法在此范围内检测结果的相对标准偏差约为10%, 具有较好的重现性。用计数法和 WST-8法检测As(Ⅴ)对四膜虫的毒性, 结果具有相同的变化趋势, 半效应浓度分别为1.21和0.88 mg/L, 这说明计数法的统计结果包括已死亡的四膜虫, 故使其获得的半效应浓度值高于WST-8法。WST-8法能够更准确地反应出As(Ⅴ)对四膜虫的毒性效应。
在有关微生物的工作中对其生长及活性的评价是非常重要的。用常规计数法统计毒物对四膜虫的毒性时, 死亡细胞和存活细胞常常难以区分, 一般是通过检测人员的经验进行主观判断, 涂板过程工作量大。采用 WST-8法只需将 WST-8试剂按一定比例加入到细胞培养板中,经过一定时间培养, 活细胞即可将 WST-8代谢为黄色的水溶性甲瓒染料, 直接在450 nm波长处测定。与常规计数法相比, WST-8法减少计数过程人为的主观误差, 大大减轻了工作量, 结果显示为活细胞的数量或微生物细胞的活性, 具有传统计数法所无法比拟的优点。WST-8法可以快速、简便地分析四膜虫的细胞活性。
致谢:
四膜虫的培养得到了中国科学院城市环境所杨军研究员以及张永雨副研究员的指导和帮助。
[1] Gilron G, Gransden S G, Lynn D H,et al.A behavioral toxicity test using the ciliated protozoanTetrahymena thermophila.I.Method description [J].Environmental Toxicology and Chemistry, 1999, 18(8): 1813—1816
[2] Larsen J, Schultz T W, Rasmussen L,et al.Progress in an ecotoxicological standard protocol with protozoa: Results from a pilot ringtest withTetrahymena pyriformis[J].Chemosphere, 1997, 35(5): 1023—1041
[3] Gerhardt A, Ud-Daula A, Schramm K W.Tetrahymenaspp.(Protista, Ciliophora) as test species in rapid multi-level ecotoxicity tests [J].Acta Protozoologica, 2010, 49(4): 271—280
[4] Li S Q, Pang Y B.Studies on cortical cytoskeletal proteins at the late stage of the conjugation ofTetrahymena thermophila[J].Acta Hydrobiologica Sinica, 2003, 27(2): 176—178 [李书强, 庞延斌.嗜热四膜虫接合生殖后期皮层细胞骨架蛋白的研究.水生生物学报, 2003, 27(2): 176—178]
[5] Sun W H, Pang Y B.Studies on cortical cytoskeletal proteins in important phases during conjugation ofTetrahymena thermophila[J].Acta Hydrobiologica Sinica, 2001, 25(4):381—385 [孙卫华, 庞延斌.嗜热四膜虫接合生殖周期皮层骨架蛋白组分的比较.水生生物学报, 2001, 25(4): 381—385]
[6] Pang Y B, Sun W H, Li S Q.Studies on cortical cytoskeletal proteins of different species ofTetrahymena[J].Acta Hydrobiologica Sinica, 2001, 25(3): 241—244 [庞延斌, 孙卫华,李书强.四膜虫种间骨架蛋白组分的比较研究.水生生物学报, 2001, 25(3): 241—244]
[7] Fu C J, Yu T, Miao W,et al.Tetrahymena: a good model organism for toxicology and ecotoxicology [J].Chinese Journal of Zoology, 2005, 40(1): 108—113
[8] Yao Y, Yang L Y, Chen J,et al.Ecological Toxicity of Nano-ZnO on Tetrahymena thermophila [J].Research of Environmental Sciences, 2009, 22(7): 833—837 [姚莹,杨柳燕,陈军, 等.纳米 ZnO对嗜热四膜虫的生态毒性研究.环境科学研究,2009, 22(7): 833—837]
[9] Pauli W, Berger S, Jaskulka L,et al.A case for the inclusion of a protozoan test in aquatic toxicity assessment usingTetrahymena[J].Science of the Total Environment, 1993,(Suppl): 779—786
[10] Tominaga H, Ishiyama M, Ohseto F,et al.A water-soluble tetrazolium salt useful for colorimetric cell viability assay [J].Analytical Communications, 1999, 36(2): 47—50
[11] Liao K H, Lin Y S, Macosko C W,et al.Cytotoxicity of Graphene oxide and graphene in human erythrocytes and skin fibroblasts [J].Acs Applied Materials & Interfaces, 2011,3(7): 2607—2615
[12] Baek M O, Kim S H, So J W,et al.Cytotoxicity measurements of tissue engineered scaffold [J].Tissue Engineering and Regenerative Medicine, 2007, 4(4): 571—576
