水淹胁迫对4种园林绿化树种幼苗气体交换参数的影响
2013-07-12郭淑红杨振意
郭淑红,薛 立,杨振意,张 柔
(1 广州普邦园林股份有限公司,广东 广州510600;2 华南农业大学 林学院,广东 广州510642)
水淹胁迫使土壤长时间处于水分饱和状态,导致土壤中氧气和光照不足[1],影响植物的形态特性[2-3]和生理代谢[4],甚至引起死亡,因而成为植物主要的非生物胁迫之一[5].光合作用是植物最基本的生命活动,也是碳循环及生态水文循环的关键环节[6].水淹胁迫降低植物的净光合速率、气孔导度和蒸腾速率[7],还会引起叶绿素含量和光合作用相关功能酶活性下降,PSⅡ光化学效率降低等[8].目前,已有许多学者对水淹胁迫下植物的生理特性进行了研究[7,9-10].乐昌含笑Michelia chapensis 、红荷Schima wallichii、红苞木Rhodoleia championii 和樟树Cinnamomum camphora 均是华南地区常用园林绿化树种.目前,已有关于乐昌含笑的光合特征和叶绿素荧光特性的研究以及樟树幼苗机械损伤叶片对叶绿素荧光影响的研究[11-12],也有4 种供试幼苗在水淹胁迫下的叶绿素、可溶性糖和蛋白质等生理指标的研究[13-14],但鲜见水淹胁迫对这4 种幼苗叶片气体交换参数影响的报道.本研究以乐昌含笑、红荷、红苞木和樟树为材料,对比分析其叶片气体交换参数对水淹胁迫的响应,以期从光合生理角度了解这4 种树种的耐水淹生理机制,为华南地区筛选耐水淹树种提供参考.
1 材料与方法
1.1 试验材料
试验幼苗为乐昌含笑、红荷、红苞木和樟树的实生容器苗(购于广东省龙眼洞林场林木种苗示范基地),营养袋规格12 cm×10 cm,袋内基质为林下表土与黄心土混合而成.幼苗的基本情况见表1.水淹胁迫在华南农业大学林学院6 楼的温室进行.采用长60 cm,宽37 cm,深17 cm 的塑料盆,将营养袋培育的实生苗置于盆内,然后进行水淹处理.

表1 4 种幼苗生长基本情况Tab.1 General characteristics of four seedlings cm
1.2 试验方法
2009年10月23日开始,每个树种选取生长良好和形态长势基本一致的24 株幼苗放入水盆中进行水淹处理,设置水位在土壤表面,同时,将正常栽培管理的幼苗作对照.水淹处理每天都补换水1 次,对照每天定时定量浇水1 次,保持对照的毛管持水量为33.76%,田间持水量为25.48%.处理在室温下进行,室内温度28 ℃左右,相对湿度75%~85%.在7、14、21、28、35 d 5 个水淹时间和停止水淹7 d 时(即试验42 d)测定幼苗的生理指标.
选取生长状况一致的5 株幼苗,从每株幼苗顶部开始的第3~8 位功能叶间选取6 枚叶片挂牌标记,于早晨9:00—11:00 用Li-6400 便携式光合系统分析仪(美国LI-COR 公司)测定幼苗叶片的净光合速率(Pn)、气孔导度(Gs)、细胞间隙CO2摩尔分数(xCO2)、蒸腾速率(Tr),每枚叶片测定6 次.测定条件:叶室温度控制在20~25 ℃,采用红蓝光源,光强为1 000 μmol·m-2·s-1,CO2的摩尔分数为400 μmol·mol-1,流速为500 μmol·s-1.
数据处理和作图由Microsoft excel 完成,Duncan’s 多重比较和各项指标测定结果的主成分分析均由SAS 9.0 软件系统完成.
2 结果与分析
2.1 水淹胁迫对净光合速率(Pn)的影响
随着胁迫时间的增加,4 种幼苗的Pn 均呈下降趋势,且都显著低于对照(P<0.05)(图1).正常生长环境下(0 d)乐昌含笑、红荷、红苞木和樟树的Pn分别为5.16、7.37、4.31 和4.38 μmol·m-2·s-1,红荷的Pn 最大,红苞木的最小.35 d 时4 种幼苗的Pn 均达到最小值,分别为1.87、0.43、-0.26和0.62 μmol·m-2·s-1,比对照下降了63.76%、94.10%、106.04%和85.77%.其中,乐昌含笑降幅最低,较耐水淹,而红苞木的Pn 为负值,表明此时其幼苗的呼吸速率大于光合速率,抗涝性较差.恢复7 d 后乐昌含笑、红荷、红苞木和樟树幼苗的Pn 较35 d 时显著上升(P<0.05),却仍显著低于对照(P<0.05),分别为对照的70.09%、32.12%、23.97%和56.72%.

图1 水淹胁迫下净光合速率的变化Fig.1 Changes of net photosynthetic rate under waterlogging stress
2.2 水淹胁迫对叶片气孔导度(Gs)的影响
随着胁迫时间的增加,4 种幼苗的叶片Gs均呈下降趋势,各水淹胁迫阶段Gs都显著低于对照(P<0.05)(图2).0 d 时乐昌含笑、红荷、红苞木和樟树的 Gs分别为 0.096、0.158、0.089 和0.040 mol·m-2·s-1,红荷最大,樟树最小.35 d 时4 种幼苗的Gs均达到最小值,分别为0.032、0.005、0.008和0.006 mol·m-2·s-1,比对照下降66.52%、96.76%、91.47%和84.61%.其中,乐昌含笑的Gs降幅最小,樟树次之,红荷和红苞木降幅较大.恢复7 d 后,除乐昌含笑外,其他3 种幼苗的Gs较35 d 时显著上升(P<0.05),但均显著低于对照(P<0.05),乐昌含笑、红荷、红苞木和樟树幼苗的Gs分别为对照的36.73%、13.19%、12.87%和65.27%.

图2 水淹胁迫下气孔导度的变化Fig.2 Changes of stomatal conductance under waterlogging stress
2.3 水淹胁迫对细胞间隙CO2 摩尔分数(xCO2)的影响
0 d 时乐昌含笑、红荷、红苞木和樟树的xCO2分别为285、296、224 和221 μmol·mol-1(图3).随着胁迫时间的增加,乐昌含笑的xCO2先降后升,各胁迫阶段的xCO2均显著低于对照(P<0.05),14 d 时达到最小值218 μmol·mol-1,比对照下降23.49%,35 d 时为247 μmol·mol-1,比对照下降13.26%;红荷xCO2先降后升,14、21、28 d 时显著低于对照(P<0.05),14 d时达到最小值243 μmol·mol-1,比对照下降17.90%,35 d时上升至与对照相同水平,为294 μmol·mol-1;红苞木的xCO2持续上升,各胁迫阶段均显著高于对照(P<0.05),35 d 时达到574 μmol·mol-1的最大值,比对照上升了60.96%;樟树的xCO2先降后升,14 d 时达到最小值,为190 μmol·mol-1,比对照下降14.25%.35 d 时达最大值,比对照显著提高39.39%,其他处理也显著高于对照(P<0.05).由数据结果分析可知,红荷和乐昌含笑的xCO2变幅较小,樟树次之,红苞木最大.恢复7 d 后,乐昌含笑的xCO2显著上升,而其他幼苗显著下降,乐昌含笑、红荷、红苞木和樟树的xCO2分别为对照的90.97%、86.78%、104.70%和124.64%.

图3 水淹胁迫下细胞间隙CO2 摩尔分数的变化Fig.3 Changes of intercellular mole fraction of CO2(xCO2)under waterlogging stress
2.4 水淹胁迫对叶片蒸腾速率(Tr)的影响
随着胁迫时间的增加,4 种幼苗的叶片Tr 均呈下降趋势,且都显著低于对照(P<0.05)(图4).0 d时乐昌含笑、红荷、红苞木和樟树的Tr 分别为3.04、2.67、2.77 和0.83 mmol·m-2·s-1.在35 d 时Tr均达到最低值,分别为0.04、0.13、0.02 和0.10 mmol·m-2·s-1,比对照下降98.71%、95.02%、99.29%和87.71%.恢复7 d 后,除红苞木与35 d 时为同一水平外,其他3 种幼苗的Tr 均显著上升(P<0.05),此时乐昌含笑、红荷、红苞木和樟树幼苗的Tr分别为对照的16.57%、10.95%、5.15%和45.44%,均显著低于对照(P<0.05).

图4 水淹胁迫下蒸腾速率的变化Fig.4 Changes of transpiration rate under waterlogging stress
2.5 对4 种幼苗耐水淹能力的主成分分析
为了研究影响4 种幼苗耐水淹能力的主导因素,采用多元统计分析中的主成分分析法进行了综合评价[15],结果见表2.由表2 可以看出,4 项叶片气体交换参数指标中前2 个主成分因子的累计贡献率为95.53%,表明前2 个主成分已经把供试幼苗在水分胁迫下生长适应性的95.53%的信息反映出来,因此选取前两个主成分作为植物耐水淹能力评价的综合指标.第1 主成分贡献率较大(74.55%),其对应较大特征向量的评价指标为净光合速率和气孔导度,第2 主成分对应最大特征向量的评价指标为细胞间隙CO2摩尔分数,说明本研究中净光合速率和气孔导度是反映水淹胁迫的最重要的指标,其次为细胞间隙CO2摩尔分数.
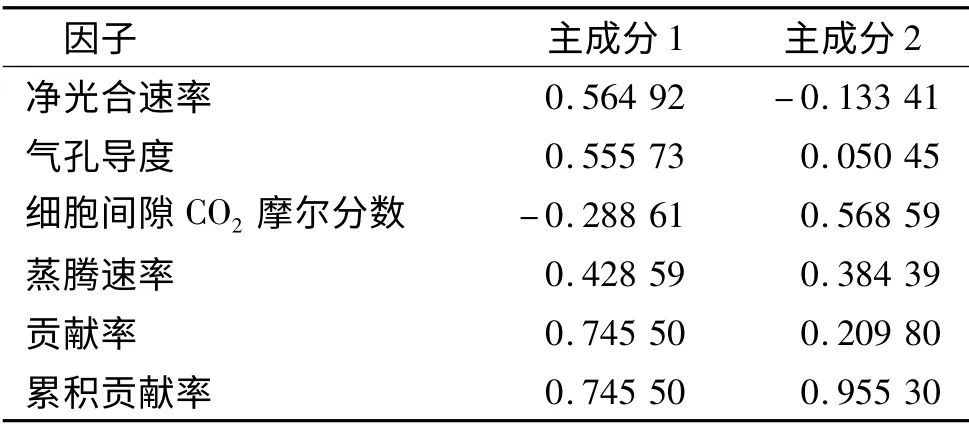
表2 水淹胁迫下幼苗气体交换参数的主成分分析Tab.2 Principal components under waterlogging stress on leaf gas exchange parameters of seedlings
根据叶片气体交换参数指标与幼苗耐水淹能力的联系,由主成分的特征向量可计算出每个树种的主成分得分,本研究选取了2 个主成分,由于主成分之间相互独立且有着不同的贡献率,因此,每个主成分得分就是其加权值,其中权重就是主成分对应的贡献率.每个树种的叶片气体交换参数指标值分别和各主成分中的叶片气体交换参数指标的特征值相乘后,按树种累加各叶片气体交换参数指标得分,再分别与各主成分的权重相乘,求和计算出主成分的综合得分,得分高的树种其耐水淹能力强.
经计算,乐昌含笑、红荷、红苞木和樟树幼苗的耐水淹能力综合得分分别为1.94、0.71、0.62 和0.68,可见这4 种幼苗的耐水淹能力由高到低依次为乐昌含笑、红荷、樟树、红苞木.
3 讨论
水淹改变植株生长的土壤水分条件,从而影响其光合生理生态特性[16].净光合速率是衡量植物对逆境条件光合生理响应能力的重要参数[17],水淹条件下植物保持较高的净光合速率和正常的光合特性是植物能耐受水淹的重要原因之一[16].已有研究表明,水淹会导致不耐淹植物的光合能力显著下降[18],而对于耐淹植物的根部发生水淹时,对其光合能力的影响较小[16].本研究的水淹胁迫过程中,4 种幼苗的净光合速率均持续下降.水淹35 d 时,红苞木的净光合速率为负值,而其他树种为正值,其中乐昌含笑的净光合速率降幅最小.由此可以认为,4 种幼苗中,乐昌含笑为耐淹树种,红苞木为不耐淹树种,樟树和红荷介于二者之间.
通常认为引起光合速率下降的因素包括气孔限制因素和非气孔限制因素[19].气孔是光合作用时吸收空气中CO2和蒸腾过程中水蒸气从体内排到体外的主要通道,淹水植物早期光合速率的下降与气孔的关闭有关,植物对土壤淹水缺氧最敏感的响应就是气孔关闭,气孔导度下降,从而导致叶片吸收CO2的能力降低[20].当胞间CO2摩尔分数降低和气孔限制值增大时,光合速率的下降主要由气孔导度的下降所引起[19].非气孔限制是因为叶肉细胞光合能力下降,导致叶肉细胞利用CO2的能力降低,进而使胞间CO2摩尔分数升高[21].影响幼苗净光合速率下降的主要原因由气孔限制转变为非气孔因素限制,此时幼苗的光合作用主要受1,5-二磷酸核酮糖(RuBP)再生的影响,如光合作用关键酶Rubisco 羧化活性下降[22],同时光合电子的传递,如Cytb6f 和质醌等光合电子传递链组分的减少[23],烟酰胺腺嘌呤二核苷酸磷酸(NADPH)和三磷酸腺苷(ATP)的合成,磷酸戊糖循环的还原过程也会影响植株的光合作用[24],阻碍叶肉细胞对CO2的利用,从而导致胞间CO2的积累.本研究中,乐昌含笑、红荷和樟树的胞间CO2摩尔分数在水淹期的前14 d 随着气孔导度的下降而下降,而14 d 后其胞间CO2摩尔分数并不随着气孔导度降低而下降,反而有所升高,推测这3 种幼苗在水淹14 d 前光合速率的下降主要是由气孔限制所致,14 d 后主要是由非气孔限制所致;红苞木的胞间CO2摩尔分数随着气孔导度的下降持续上升,推测引起红苞木净光合速率降低的主要因素一直为非气孔限制,表明乐昌含笑、红荷和樟树的耐水淹能力较红苞木强.
水淹结束后,植株的恢复生长能力越强,对植物耐受水淹越有利,而水淹后植株的光合生产对恢复生长是有利的.本试验中,水淹恢复7 d 的净光合速率测定结果表明,乐昌含笑恢复到对照的70.09%,红苞木仅为23.97%,樟树和红荷居二者之间,说明乐昌含笑抗水淹能力最强,而红苞木最弱.
对树木耐水淹性的评价,当涉及到多种树木、多个指标的情况时,因各指标所表达的树木耐水淹性顺序往往不一致,利用一般的简单方法很难得出确切结果.采用综合指标法可使单个指标对评定耐水淹性的局限性得到其他指标的弥补和缓解,从而使评定的结果与实际较为接近,在植物生理研究中被广泛使用[25-27].本研究运用主成分分析法对4 个树种的4 项生理指标进行了综合评定,水淹处理的4个树种的耐水淹能力由大到小的顺序为乐昌含笑、红荷、樟树、红苞木,这与其光合生理指标的变化相吻合.
[1]JACKSON M B,ARMSTRONG W.Formation of aerenchyma and the processes of plant ventilation in relation to soil flooding and submergence[J].Plant Biol,1999,1(3):274-287.
[2]CHEN Luzhen,WANG Wenqing,LIN Peng.Photosynthetic and physiological responses on Kandelia candel L.Druce seedlings to duration of tidal immersion in artificial seawater[J].Environ Exp Bot,2005,54(3):256-266.
[3]THOMAS A L,GUERREIRO S M C,SODEK L.Aerenchyma formation and recovery from hypoxia of the flooded root system of nodulated soybean[J].Ann bot-London,2005,96(7):1191-1198.
[4]PAROLIN P.Morphological and physiological adjustments to waterlogging and drought in seedlings of Amazonian floodplain trees[J].Oecologia,2001,128(3):326-335.
[5]VAN BODEGOM P M,SORRELL B K,OOSTHOEK A,et al.Separating the effects of partial submergence and soil oxygen demand on plant physiology[J].Ecology,2008,89(1):193-204.
[6]TUITTILA E S,VASANDER H,LAINE J.Sensitivity of C sequestration in reintroduced Sphagnum to water-level variation in a cutaway peatland[J].Restor Ecol,2004,12(4):483-493.
[7]潘澜,薛立.植物淹水胁迫的生理学机制研究进展[J].生态学杂志,2012,31(10):2662-2672.
[8]ASHRAF M,ARFAN M.Gas exchange characteristics and water relations in two cultivars of Hibiscuse sculentus under waterlogging[J].Biol Plantarum,2005,49(3):459-462.
[9]曹福亮,蔡金峰,汪贵斌,等.淹水胁迫对乌桕生长及光合作用的影响[J].林业科学,2010,46(10):57-61.
[10]罗芳丽,曾波,陈婷,等.三峡库区岸生植物秋华柳对水淹的光合和生长响应[J].植物生态学报,2007,31(5):910-918.
[11]周帅,林富平,王玉魁,等.樟树幼苗机械损伤叶片对挥发性有机化合物及叶绿素荧光参数的影响[J].植物生态学报,2012,36(7):671-680.
[12]官莉莉,邓绍龙,杨振意,等.五种观花树种光合与叶绿素荧光特征研究[J].广东林业科技,2012,28(4):1-4.
[13]叶龙华,杨振意,薛立,等.3 种幼苗对水淹胁迫的生理响应[J].华南农业大学学报,2012,3(3):368-372.
[14]黄香兰,郭淑红,薛立,等.水淹胁迫对华南地区3 种园林树种生理特征的影响[J].中国农学通报,2012,28(13):24-31.
[15]区靖祥,邱健德.多元数据的统计分析方法[M].北京:中国农业科学技术出版社,2002:63-80.
[16]CHEN Hongjun,QUALLS R G,BLANK R R.Effect of soil flooding on photosynthesis,carbohydrate partitioning and nutrient uptake in the invasive exotic Lepidium latifolium[J].Aquat Bot,2005,82(4):250-268.
[17]刘亚丽,王庆成,杨远彪,等.水分胁迫对脂松幼苗生长和光合特性的影响[J].东北林业大学学报,2011,39(4):33-36.
[18]GRAVATT D A,KIRBY C J.Patterns of photosynthesis and starch allocation in seedlings of four bottomland hardwood tree species subjected to flooding[J].Tree Physiol,1998,18(6):411-417.
[19]FARQUHAR G D,SHARKEY T D.Stomatal conductance and photosynthesis[J].Ann Rev Plant Physiol,1982,33(1):317-345.
[20]MALIK A I,COLMER T D,LAMBERS H,et al.Changes in physiological and morphological traits of roots and shoots of wheat in response to different depths of waterlogging[J].Aust J Plant Physiol,2001,28(11):1121-1131.
[21]张晔,李昌晓.水淹与干旱交替胁迫对湿地松幼苗光合与生长的影响[J].林业科学,2011,47(12):158-164.
[22]周艳虹,黄黎锋,喻景权.持续低温弱光对黄瓜叶片气体交换、叶绿素荧光猝灭和吸收能量分配的影响[J].植物生理与分子生物学学报,2004,30(2):153-160.
[23]崔继林.光合作用与生产力[M].南京:江苏科学技术出版社,2000.
[24]YORDANOVA R Y,ALEXIEVA V S,POPOVA L P.Influence of root oxygen deficiency on photosynthesis and antioxidant status in barley plants[J].Russian J Plant Physiol,2003,50(2):163-167.
[25]冯慧芳,薛立,任向荣,等.4 种阔叶苗木对PEG 模拟干旱的生理响应[J].生态学报,2011,31(2):371-382.
[26]谭雪红,高艳鹏,郭小平,等.五种高速公路边坡绿化植物的生理特性及抗旱性综合评价[J].生态学报,2012,32(16):5076-5086.
[27]史小玲,薛立,任向荣,等.华南地区4 种阔叶苗木水分胁迫条件下的抗旱性初探[J].林业科学研究,2011,24(6):760-767.
