胃癌患者外周血与胃癌组织中ERCC1基因甲基化的关系及其意义
2013-06-09王红兵陈卫昌
王红兵陈卫昌
1.苏州大学附属第一医院消化内科,江苏 苏州, 215006;
2.徐州医学院附属医院肿瘤内科,江苏 徐州, 221009
胃癌患者外周血与胃癌组织中ERCC1基因甲基化的关系及其意义
王红兵1,2陈卫昌1
1.苏州大学附属第一医院消化内科,江苏 苏州, 215006;
2.徐州医学院附属医院肿瘤内科,江苏 徐州, 221009
背景与目的:胃癌的发生基于基因和表观遗传学机制,表观遗传学的改变在胃癌的发展中起到重要作用。DNA甲基化是目前研究最多、最为深入的一种表观遗传学表达机制。DNA甲基化是一个可逆性过程。核苷酸切除修复交叉互补基因1(excision repair cross-complementing gene 1,ERCC1)是一种DNA损伤修复基因。本研究检测胃癌患者外周血与胃癌组织中ERCC1基因启动子CpG岛甲基化状态,探讨两者的关系及其意义。方法:采用甲基化特异性PCR技术,检测30例胃癌患者外周血、胃癌组织中ERCC1基因启动子CpG岛甲基化状态。结果:胃癌组织中ERCC1基因启动子CpG岛甲基化率为76.7%(23/30),外周血中ERCC1基因启动子CpG岛甲基化率为63.3%(19/30),差异无统计学意义。结论:胃癌患者外周血中的ERCC1基因启动子CpG岛甲基化率与胃癌组织中相似,检测胃癌患者外周血中的ERCC1基因启动子CpG岛甲基化状态为治疗胃癌提供一个简便、快捷、可靠的途径,同时也为以ERCC1基因启动子CpG岛甲基化作为靶点治疗胃癌提供了可靠的理论依据。
胃癌;核苷酸切除修复交叉互补基因1;CpG岛;甲基化;甲基化特异性PCR
现代肿瘤学认为肿瘤的发生是多基因遗传和表遗传相互作用、共同参与的结果,肿瘤相关基因的表观遗传学改变与肿瘤发生发展的关系正成为肿瘤学、分子生物学等学科研究的热点。表遗传学研究在DNA序列不发生改变的情况下,所发生的可遗传性基因表达的改变,包括DNA甲基化、组蛋白修饰、基因组印记、隔离蛋白以及非编码RNA调控等[1]。DNA甲基化是目前研究最多、最为深入的表观遗传学表达机制。近年研究表明基因启动子区域CpG岛的甲基化是导致基因转录失活的重要途径[2]。如果发生在DNA修复基因,则会使其基因表达下调或不表达[3]。因此,对一些肿瘤相关基因甲基化状态进行检测可间接得知该基因表达水平。目前,国内检测基因启动子区域CpG位点甲基化大多使用甲基化特异性PCR (methylation-specific PCR,MSP)技术。MSP是Herman等[4]使用重亚硫酸盐处理的基础上新建的一种方法,具有灵敏性、特异性高、操作简便、价格较低等优点。DNA甲基化是一种重要的表观遗传学形式,DNA甲基化是一个可逆性过程,DNA甲基化的可逆性为临床上通过去甲基化药物进行抗肿瘤治疗提供了可能[5]。核苷酸切除修复交叉互补基因1(excision repair cross-complementing gene 1,ERCC1)是一种DNA损伤修复基因,主要参与DNA损伤的识别与修复[6]。本研究采用MSP方法,检测30例胃癌患者外周血、胃癌组织中ERCC1基因启动子CpG岛甲基化状态,探讨两者的关系及其意义。
1 材料和方法
1.1 研究对象
收集2012年5月—8月徐州医学院附属医院普外科手术切除新鲜胃癌组织共30例。30例患者中男性18例,女性12例,年龄37~77岁,中位年龄53岁。患者术前均未接受过放化疗,每例均有详细的临床资料和手术记录。术后病理检查确诊。同时收集10例胃良性病变旁正常胃组织作为对照。标本均于术后0.5 h内获得,液氮速冻后-80 ℃冰箱保存。所有患者均于术前抽取外周血,分离血清,-80 ℃冻存。正常对照血清来源于徐州医学院附属医院体检中心的20名健康志愿者。
1.2 方法
ERCC1基因启动子CpG岛甲基化检测:每个样本取30 mg的组织块进行匀浆处理,参照北京天根生化科技有限公司组织基因组DNA提取试剂盒说明书提取基因组DNA;取200 μL血清,参照北京天根生化科技有限公司微量样品基因组DNA提取试剂盒说明书提取基因组DNA,在UV 3000紫外分光光度仪上测定吸光度(A)值鉴定DNA纯度,A260/A280比值均在1.8~2.0之间。甲基化特异性PCR(MSP):取800 ng基因组DNA,参照美国Zymo Research公司EZ DNA甲基化试剂盒说明书进行甲基化修饰。取修饰好的DNA 2 µL进行MSP反应。ERCC1基因甲基化引物(M)顺义链(F):5’- TTTAGGAT TATAGAGAGTAGCGCGA-3’反义链(R):5’-CAAAAAAAATAAAAACGATACAACG-3’。非甲基化引物(U)顺义链(F):5’- TTTAGGATT ATAGAGAGTAGTGTGA-3’反义链(R):5’-AAAAAAATAAAAACAATACAACACC-3’。反应体系按照PCR试剂盒推荐量25 μL体系进行:PCR混合液12.5 μL,上下游引物各0.5 μL,模板2 μL,无核酶水9.5 μL。MSP循环条件:97 ℃预变性5 min,然后进行40个循环扩增:95 ℃变性40 s,甲基化引物及非甲基化引物分别在57 ℃、55 ℃退火60 s,72 ℃延伸60 s;最后于72 ℃延伸10 min,4 ℃保存。甲基化特异性引物(M)扩增的目的片段为166 bp,非甲基化特异性引物(U)扩增的目的片段为164 bp。取10 μL PCR产物在2.5%琼脂糖凝胶上电泳,以TIANGEN 100 bp DNA Ladder (MD101-01)为标准DNA Marker同步电泳,溴化乙啶染色后凝胶成像系统观察结果并记录。判断标准:M阳性、U阴性为完全甲基化;M阳性、U阳性为部分甲基化;M阴性、U阳性为非甲基化。
1.3 统计学处理
数据采用SPSS 16.0统计软件处理,甲基化结果比较采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 胃癌组织ERCC1基因CpG岛甲基化状态
30例患者的胃癌组织中ERCC1基因发生完全甲基化14例,发生部分甲基化9例,甲基化阳性率为76.7%(23/30,图1)。10例正常胃组织中均未出现甲基化条带。

图 1 胃癌组织ERCC1基因启动子CpG岛甲基化检测(MSP)Fig. 1 CpG island methylation of ERCC1 gene promoter in gastric cancer tissue detected by methylation specific polymerase chain reaction (MSP)
2.2 外周血ERCC1基因CpG岛甲基化状态
30例胃癌患者血清中ERCC1基因发生完全甲基化11例,发生部分甲基化8例,甲基化阳性率为63.3%(19/30,图2)。20名健康志愿者血清中均未出现甲基化条带。
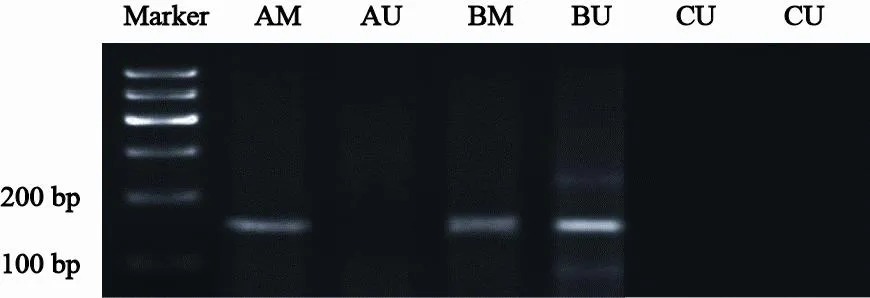
图 2 外周血ERCC1基因启动子CpG岛甲基化检测(MSP)Fig. 2 CpG island methylation of ERCC1 gene promoter in peripheral blood detected by methylation specific polymerase chain reaction (MSP)
2.3 胃癌组织与外周血中ERCC1基因启动子CpG岛甲基化的关系
30例患者胃癌组织与对应者外周血中ERCC1基因启动子CpG岛甲基化阳性率的差异无统计学意义(表1)。

表 1 胃癌组织及对应外周血中ERCC1基因甲基化状态Tab. 1 ERCC1 methylation in gastric cancer tissues and corresponding peripheral blood
3 讨 论
ERCC1基因定位于人染色体l9q13.2,全长15 kb,含l0个外显子,编码由297个氨基酸组成的蛋白质,其相对分子质量为32.5×103。
肿瘤患者外周血中有游离DNA的存在,且其含量明显高于健康人[7]。研究表明,血清游离DNA与原发肿瘤基因组DNA具有相同的遗传变异[8],其变异特征及表达量均与相应肿瘤组织呈正相关,提示血循环中的游离DNA主要来源于原发肿瘤[9],检测肿瘤患者外周血中的游离DNA可发现肿瘤相关基因的变异,并能反映肿瘤组织存在的特征性改变[10]。因此,作为一种微创检查手段,检测外周血中DNA肿瘤相关基因的变异可能具有重要意义。
DNA甲基化是一个可逆性过程,DNA甲基化的可逆性为临床上通过去甲基化药物进行抗肿瘤治疗提供了可能性。基因甲基化抑制剂5-氮-2’-脱氧胞苷(5-aza-2’-deoxycytidine,5-azadC)和5-氮胞苷(5-azacytidine,5-aza),通过共价键与甲基化酶结合来降低其生物学活性[11],临床上已用于恶性血液病的治疗,并取得了一定的临床疗效。利用已知的或新研发的去甲基化药物解除甲基化对肿瘤相关基因的抑制作用,从而提高肿瘤的治疗疗效,已成为近年研究的热点[5]。
本研究采用MSP技术检测30例胃癌组织中ERCC1基因启动子CpG岛甲基化状况,结果显示胃癌组织的甲基化率为76.7%(23/30),提示ERCC1基因启动子CpG岛甲基化是胃癌发生发展过程中的常见分子事件,ERCC1基因启动子CpG岛甲基化可能是一个很好的治疗胃癌的新靶点。
而胃癌患者外周血中ERCC1基因启动子CpG岛甲基化率为63.3%(19/30),且与胃癌组织相比,外周血取材更简便、快捷。
综上所述,胃癌患者外周血及胃癌组织中的ERCC1基因启动子CpG岛甲基化,阳性率差异无统计学意义(P>0.05)。检测外周血中ERCC1基因启动子CpG岛甲基化状态,不仅为胃癌的内科治疗提供了更方便可靠的途径,同时也为以ERCC1基因启动子CpG岛甲基化为靶点治疗胃癌提供了可靠的理论依据。
[1] JONES P A, BAYLIN S B. The epigenomics of cancer[J]. Cell, 2007, 128(4): 683-692.
[2] DEATON A M, BIRD A. CpG islands and the regulation of transcription[J]. Genes Dev, 2011, 25(10): 1010-1022.
[3] USHIJIMA T, OKOCHI-TAKADA E. Aberrant methylations in cancer cells: where do they come from? [J]. Cancer Sci, 2005, 96(4): 206-211.
[4] HERMAN J G, GRAFF J R, MYÖHÄNEN S, et al. Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands[J]. Proc Natl Acad Sci U S A, 1996, 93(18): 9821-9826.
[5] CAI F F, KOHLER C, ZHANG B, et al. Epigenetic therapy for breast cancer[J]. Int J Mol Sci, 2011, 12(7): 4465-4487.
[6] STARESINCIC L, FAGBEMI A F, ENZLIN J H, et al. Coordination of dual incision and repair synthesis in human nucleotide excision repair[J]. EMBO J, 2009, 28(8): 1111-1120.
[7] HASHAD D, SOROUR A, GHAZAL A, et al. Free circulating tumor DNA as a diagnostic marker for breast cancer[J]. J Clin Lab Anal, 2012, 26(6): 467-472.
[8] MORGAN S R, WHITELEY J, DONALD E, et al. Comparison of KRAS mutation assessment in tumor DNA and circulating free DNA in plasma and serum samples[J]. Clin Med Insights Pathol, 2012, 5: 15-22.
[9] WANG Y C, YU Z H, LIU C, et al. Detection of RASSF1A promoter hypermethylation in serum from gastric and colorectal adenocarcinoma patients[J]. World J Gastroenterol, 2008, 14(19): 3074-3080.
[10] ZANETTI-DÄLLENBACH R, WIGHT E, FAN A X, et al. Positive correlation of cell-free DNA in plasma/serum in patients with malignant and benign breast disease[J]. Anticancer Res, 2008, 28(2A): 921-925.
[11] WIJERMANS P, LUBBERT M, VERHOEF G, et al. Lowdose 5-aza-2’-deoxycytidine, a DNA hypomethylating agent, for the treatment of high-risk myelodysplastic syndrome: a multicenter phase II study in elderly patients[J]. J Clin Oncol, 2000, 18(5): 956-962.
The relationship between methylation of ERCC1 gene in peripheral blood and in gastric cancer tissues
WANG Hong-bing1,2, CHEN Wei-chang1(1.Department of Digestive Disease, The First Affiliated Hospital of Soochow University, Suzhou Jiangsu 215006, China; 2.Department of Oncology, Affiliated Hospital of Xuzhou Medical College, Xuzhou Jiangsu 221009, China)
CHEN Wei-chang E-mail: wcchen1990@126.com
Background and purpose: At present, gastric cancer is considered to be both genetic and epigenetic disease, and epigenetic alterations play a significant role in the development of gastric cancer. DNA methylation is the most well studied and most in-depth epigenetic modifications in human-beings. The silencing of tumor-related genes by DNA methylation is reversible. ERCC1 is a kind of DNA repair gene. The present study was aimed to detect the CpG island methylation status of ERCC1 gene promoter in gastric cancer tissues and corresponding peripheral blood, and to explore the relationship between methylation of ERCC1 gene in peripheral blood and in gastric cancer tissues. Methods: Methylation specific PCR was performed to detect the methylation status of ERCC1 gene in the tumor tissues and the paired peripheral blood from 30 gastric cancer patients. Results: The positive rate of methylation of ERCC1 gene promoter CpG island was 76.7% (23/30) in the tumor tissues and 63.3% (19/30) in serum of gastric cancer patients, and the difference had no statistical significance. Conclusion: Our studies suggest that ERCC1 gene promoter CpG island methylation can be detected in a high proportion of the serum consisting with that in tumor tissues of gastric cancer patients, and the detection of methylation status of ERCC1 gene in peripheral blood provides a more simple, fast and reliable way for the medical treatment of gastric cancer and also provides the possible theoretical basis for the CpG island methylation of ERCC1 gene promoter as a target for the treatment of gastric cancer.
Gastric cancer; ERCC1 gene; CpG island; Methylation; Methylation specific PCR
10.3969/j.issn.1007-3969.2013.11.008
R735.2
:A
:1007-3639(2013)11-0900-04
2013-08-13
2013-10-15)
陈卫昌 E-mail:wcchen1990@126.com
