黄芪与不同剂量柴胡配伍的退热作用及机制的探讨
2013-06-05赵荣华高秀兰谢鸣张敬升
赵荣华高秀兰谢 鸣张敬升
(1北京中医药大学国家重点方剂学学科,北京,100029;2山东中医药高等专科学校,莱阳,265200)
黄芪与不同剂量柴胡配伍的退热作用及机制的探讨
赵荣华1高秀兰2谢 鸣1张敬升1
(1北京中医药大学国家重点方剂学学科,北京,100029;2山东中医药高等专科学校,莱阳,265200)
目的:探讨黄芪与不同剂量柴胡配伍对脾虚发热大鼠模型的退热作用及机制。方法:雄性Wistar大鼠随机分为正常对照组、脾虚发热组、芪柴大、中、小剂量组、柴胡组共6组。采用饮食失节+游泳疲劳+LPS制备大鼠脾虚发热模型。实验第17d开始,各给药组大鼠分别按剂量4.56 g/kg、2.95 g/kg、2.41 g/kg、2.41 g/kg给予灌胃,正常组和脾虚发热组给予同体积蒸馏水,每日1次,连续6 d。第22天模型组和各给药组ip LPS(80μg/kg),正常对照组ip等量生理盐水。观测各组大鼠ip后不同时间点的体温,测定血中细胞因子和下丘脑体温调节递质的含量。结果:与正常组相比,脾虚发热组大鼠在ip LPS后各点体温均见不同程度升高,60 min和220 min时升高明显(P<0.05);血IL-2显著升高(P<0.05);下丘脑cAMP和PGE2显著升高(P<0.05),AVP呈下降趋势。与脾虚发热模型组相比,各给药组大鼠体温均出现不同程度下降(P<0.05),下丘脑PGE2或AVP呈现降低或升高趋势,其中柴胡组和芪柴小剂量组的体温下降明显,下丘脑IL-1β显著降低(P<0.05),芪柴大剂量组血IL-1β显著升高(P<0.05)。与芪柴大剂量组比,芪柴中、小剂量组及柴胡组血IL-1β均显著降低(P<0.05),芪柴中、小剂量组血IL -2显著升高(P<0.05)。结论:黄芪配伍柴胡不同剂量及单用大剂柴胡对脾虚发热模型均有不同程度的退热作用,其退热机制可能与降低中枢发热递质PGE2和升高AVP有关,黄芪与小剂柴胡配伍和单纯大剂柴胡的退热作用可能还涉及到中枢IL-1β的降低。
黄芪;柴胡;配伍;脾虚发热;退热
补中益气汤是中医治疗脾虚发热的代表方剂,方中较大剂量的黄芪与小剂量柴胡配伍是益气退热的主要药对。柴胡微寒、苦辛,具有解表退热、疏肝解郁和升阳等功效。根据方药病证相关的原理,方药的功效不仅与其所治证候有关,也与药物的使用剂量有关[1]。之前我们的研究发现大剂量单味黄芪对脾虚发热证模型具有一定的退热作用[2],本文则进一步考察大剂量黄芪与不同剂量的柴胡配伍对该模型的退热效用及机制。
1 材料
1.1 实验动物 雄性wistar大鼠,200~220 g,60只。购于北京市维通利华实验动物技术有限公司,动物许可证号:SCXK(京)-2006-0009。
1.2 药材 黄芪、柴胡由北京同仁堂药业股份有限公司提供,并经北京中医药大学中药学院中药鉴定教研室张媛教授鉴定为豆科植物内蒙黄芪的干燥根和伞形科植物柴胡的干燥根。实验用药液制备:黄芪24 g,分别与柴胡27 g、9 g、3 g配伍,组成三个不同配方(简称为芪柴大剂、中剂、小剂);柴胡27 g设为单味柴胡方。各方均按常规汤药制备方法,即取药材加5倍体积冷水浸泡30 min,加热煮沸后煎煮30 min,倾出药液;残渣加3倍体积水煮沸后煎煮30 min;合并先后两次的煎煮液,浓缩成1 g(生药)/mL的浓度,备用。
1.3 试剂 LPS注射液的制备:脂多糖(Escherichia coli endotoxin 055B5,L2880,LPS),Sigma公司生产。无菌条件下,用生理盐水将LPS配成浓度为20μg/m L的LPS注射液,备用。IL-1-RIA试剂盒(批号:20111216)、IL-2-RIA试剂盒(批号:20111223),PGE2-RIA试剂盒(批号:20111219)、cAMP-RIA试剂盒(批号:20111221)、AVP-RIA试剂盒(批号:20111225)均由北京华英生物技术研究所提供。
1.4 仪器 电脑数字温度计MC-3B型:OMROM欧姆龙(大连)有限公司生产。精密度:0.1°C。塑料钢化筒(执行标准:Q/WHC02-2002)。
2 方法
2.1 脾虚发热证动物模型的复制 采用饮食失节+游泳疲劳+腹腔注射LPS法[3]。
2.2 分组与处理 实验动物于25℃室温下适应性饲养4 d,第4~5 d连续两次肛温波动超过0.5℃或单次肛温超过39℃的大鼠剔除不用,取两次肛温的平均值作为基础体温。符合条件的大鼠随机分为正常对照组、脾虚发热模型组(模型组)、黄芪柴胡大剂量组(简称芪柴大剂组)、黄芪柴胡中剂量组(芪柴中剂组)、黄芪柴胡小剂量组(芪柴小剂组)、单纯柴胡大剂量组(柴胡组)共6组,每组10只。除正常对照组外其余各组大鼠采用饮食失节+游泳疲劳法制备脾虚模型[3]。模型复制第17 d开始,芪柴大剂量组、芪柴中剂量组、芪柴小剂量组、柴胡组四组大鼠分别按剂量4.56 g/kg、2.95 g/kg、2.41 g/kg、2.41 g/kg(相当于生药材含量)给予相应的药物灌胃,正常对照组和脾虚发热模型组给予同体积蒸馏水,1次/d,连续6 d。于造模第22天的上午8:00,脾虚发热模型组和各给药组大鼠腹腔注射LPS(80μg/kg),正常对照组注射等量生理盐水。腹腔注射后,各组灌胃给药1次。分别测定各组大鼠LPS注射后不同时间点的肛温;最后一次肛温测定后即刻断头取血,2500 r/min离心15 min,取血清,-20℃保存;低温条件下取下丘脑。
2.3 观测指标
2.3.1 体温 各组大鼠LPS注射后30 min、60 min、120 min、180 min、220 min的肛温,测算各组△T(实测体温与基础体温之间的差)并绘制平均体温曲线。
2.3.2 细胞因子 血清IL-1β和IL-2:放射免疫法测定,按试剂盒说明操作。
2.3.3 下丘脑热调节递质 PGE2、cAMP、AVP:取下丘脑组织0.3~0.5 g,滤纸吸干组织液和血液后,加生理盐水1 mL(含0.05 mol/L醋酸20μL),制备匀浆,3000 r/min 10 min,取上清液;加入0.05 mol的NaOH 25μL(pH 7.4)。取上清液10μL加入定量的蛋白试剂中,采用分光光度法测定蛋白含量;其余置4℃保存,测定前用1 mL醋酸缓冲液溶解,采用放免法检测[4]。
3 结果
3.1 黄芪与不同剂量柴胡配伍对脾虚发热大鼠体温的影响 结果见表1。如表1所示,与正常对照组相比,脾虚发热模型组大鼠体温升高,在60 min、220 min时的差异有统计学意义(P<0.05)。与脾虚发热模型组相比,各给药组大鼠体温均呈不同程度降低,其中芪柴大剂组体温在60 min、120 min、220 min时下降明显(P<0.05),芪柴中剂组、芪柴小剂组及柴胡组在60 min、180 min、220 min时的体温均下降明显(P<0.05)。
表1 黄芪配伍柴胡不同剂量对LPS诱导脾虚发热大鼠△T变化的影响(±s)

表1 黄芪配伍柴胡不同剂量对LPS诱导脾虚发热大鼠△T变化的影响(±s)
注:与正常对照组比,*P<0.05;与模型组相比,△P<0.05;与柴胡组比,▲P<0.05。
30 min 60 min 120 min 180 min 220 min正常对照组10-0.19±0.53-0.41±0.51-0.60±0.27-0.35±0组别例数不同时间点的△T .22-0.39±0.48模型组10 0.32±0.73 1.05±0.60*-0.09±0.91-0.05±1.16 0.81±0.81*芪柴大剂组10 0.19±0.54-0.64±0.76△-0.86±0.64△-0.48±1.47▲-1.83±0.94*△芪柴中剂组10-0.38±0.44△-0.38±1.10△0.09±1.20▲-1.08±1.21△-1.77±0.69*△芪柴小剂组10-0.11±0.79▲-0.43±0.56△-1.23±1.09△-1.22±1.15△-1.97±1.32*△柴胡组10 0.81±1.02△-0.72±0.71△-0.95±0.88△-1.84±0.74*△-2.04±0.94*△
3.2 黄芪与不同剂量柴胡配伍对脾虚发热大鼠血中细胞因子的影响 结果见表2。如表2所示,与正常组相比,脾虚发热模型组大鼠血IL-2明显升高(P<0.05),IL-1β见降低趋势(P>0.05)。与脾虚发热模型组相比,芪柴大剂组大鼠IL-1β升高(P<0.05)、IL-2有降低趋势(P>0.05),芪柴中剂和小剂量组IL-2呈升高趋势(P>0.05),芪柴中剂、小剂及柴胡组IL-1β均无明显变化。与芪柴大剂组比,芪柴中剂和小剂组的IL-1β均见降低、IL-2均见升高(P<0.05)。与柴胡组相比,芪柴大剂组IL-1β明显升高(P<0.05)。
表2 黄芪与不同剂量柴胡配伍对脾虚发热大鼠免疫因子的影响(±s,m L-1)

表2 黄芪与不同剂量柴胡配伍对脾虚发热大鼠免疫因子的影响(±s,m L-1)
注:与正常对照组比,*P<0.05;与模型组相比,△P<0.05;与芪柴大剂量组比,▲P<0.05;与柴胡组比,□P<0.05。
组别例数IL-2(ng)IL-1β(ng )9 5.82±0.68 0.28±0.34模型组9 6.89±0.86*0.24±0.08芪柴大剂量8 6.07±1.06 0.32±0.10△□芪柴中剂量8 7.54±0.98*▲0.25±0.05▲芪柴小剂量8 7.47±1.89*▲0.25±0.04▲柴胡组8 6.46±0.52 0.26±0.03对照组▲
表3 黄芪与不同剂量柴胡配伍对脾虚发热大鼠下丘脑相关递质的影响(±s,mg-1)
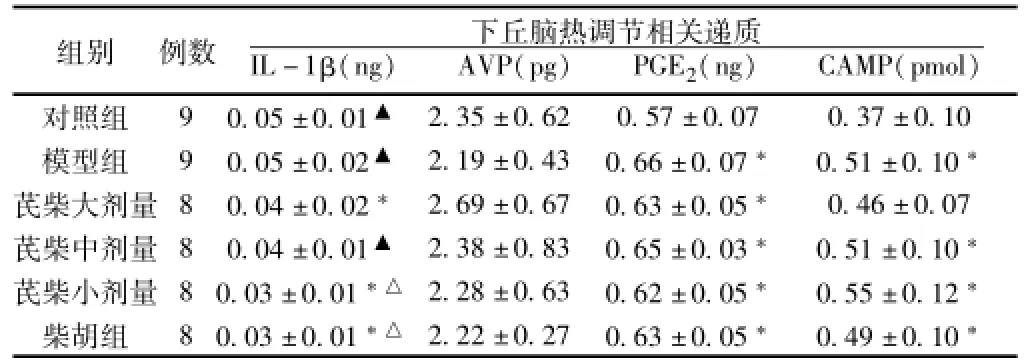
表3 黄芪与不同剂量柴胡配伍对脾虚发热大鼠下丘脑相关递质的影响(±s,mg-1)
注:与对照组比,*P<0.05;与模型组相比,△P<0.05;与柴胡组比,▲P<0.05。
组别例数下丘脑热调节相关递质IL-1β(ng)AVP(pg)PGE2(ng)CAMP(pmol )2.35±0.62 0.57±0.07 0.37±0.10模型组9 0.05±0.02▲2.19±0.43 0.66±0.07*0.51±0.10*芪柴大剂量8 0.04±0.02*2.69±0.67 0.63±0.05*0.46±0.07芪柴中剂量8 0.04±0.01▲2.38±0.83 0.65±0.03*0.51±0.10*芪柴小剂量8 0.03±0.01*△2.28±0.63 0.62±0.05*0.55±0.12*柴胡组8 0.03±0.01*△2.22±0.27 0.63±0.05*0.49±0.10对照组9 0.05±0.01▲*
3.3 黄芪与不同剂量柴胡配伍对脾虚发热大鼠下丘脑发热调质的影响 结果见表3。如表3所示,与正常组相比,脾虚发热模型组大鼠下丘脑cAMP和PGE2含量均明显升高(P<0.05),AVP呈下降趋势。与脾虚发热模型组相比,芪柴各剂量组和柴胡组大鼠下丘脑PGE2/AVP分别呈降低/升高趋势(P>0.05),芪柴小剂量及柴胡组下丘脑IL-1β含量降低明显(P<0.05)。与柴胡组相比,芪柴中剂量组大鼠IL-1β含量显著升高(P<0.05)。其余指标各组间差异均无统计学意义。
4 讨论
体温调节的高级中枢主要位于视前区下丘脑前部(POAH),由正负两种递质相互作用所调节,其中正调节递质有环磷酸腺苷(cAMP)、前列腺素E2(PGE2)、氧化亚氮(NO)等,负调节递质有精氨酸加压素(AVP)等。当外周致热信号传入中枢后,启动体温正负调节机制,正负调节相互作用的结果决定调定点上移水平和发热的幅度[5-7]。LPS是一种外源性致热原,LPS诱导的发热是通过刺激内源性致热源,如IL-1、IL-6等及介导细胞因子作用于中枢下丘脑视前区所致[8-9],目前普遍认为,PGE2是LPS诱导发热的主要中枢递质[10]。本实验中观察到,有LPS诱导的脾虚发热模型大鼠体温升高的同时伴有下丘脑cAMP和PGE2含量升高,AVP呈下降趋势,血中相关细胞因子未见明显变化,与LPS诱导正常大鼠发热见到的血IL -1β升高[11],下丘脑PGE2/AVP呈升高/下降及cAMP呈降低趋势[12]有所不同。结果表明该模型的发热机制主要涉及到中枢相关调质的变化,提示LPS致热机制可能因机体不同状态而有所不同。
IL是体内活跃的免疫促进因子,其水平高低不仅是机体细胞免疫的重要标志,也是LPS诱导发热的重要的内源性递质之一[13]。本次由脾虚大鼠注射LPS后,外周血IL-2升高与单纯脾虚证模型大鼠的血IL -2降低[14]不同。提示单纯脾虚模型和脾虚发热模型各自具有不同的免疫状态。联系到中医的理论和经验,脾虚发热的关键病机是脾虚或气虚,但临床上脾虚患者并不必然伴有发热,提示脾虚发热与单纯脾虚有所不同,或可能是脾虚证中的一个特殊类型。目前中医有关脾虚(气虚)发热机制有各种不同的认识[15],提示同一脾虚发热证在内涵上存在一定的异质性。而本次研究中的脾虚发热模型是基于“虚邪致热”机制及将LPS作为一种六淫因素的考虑而设计的[3],该模型大鼠所伴有中枢-免疫系统变化可能反映了某种脾虚发热类型的状态。
实验观察到,各给药组大鼠体温均呈不同程度降低,下丘脑PGE2/AVP分别呈降低/升高趋势,提示其降温与调节中枢体温正负调质的含量有关。实验中的大剂量柴胡组和芪柴小剂量组的体温下降幅度较为明显,同时伴有下丘脑IL-1β含量明显降低,表明此二组的降温作用还涉及到对下丘脑IL-1β的下调,提示其退热作用涉及到中枢的多个环节。
之前的研究表明大剂量黄芪对该模型具有明显的退热作用[2],本次观察到单味大剂柴胡对该模型也有较好的退热效应,而黄芪与小剂量柴胡配伍较之于与大、中剂量配伍的作用更好,表明方药配伍后的效用不是药物作用的简单相加。柴胡没有健脾益气作用,但对该模型也有良好的退热作用,提示中医药-证对应关系是相对的。但就对脾虚发热证的整体效应评估来说,柴胡是否还对该证中脾虚相关指标也有改善作用,值得进一步研究。
[1]张林,谢鸣.中药多向功效在方剂中选择性作用[J].湖南中医学院学报,2004,24(S1):37-38.
[2]高秀兰,赵荣华,谢鸣,等.不同剂量黄芪对脾虚发热大鼠模型作用的观察[J].中药药理与临床,2013,29(2):111-113.
[3]刘进娜,谢鸣,高秀兰,等.脾虚发热证大鼠模型的研究[J].中国中医基础医学杂志,2012,18(2):150-153.
[4]何维.医学免疫学[M].北京:人民卫生出版社,2005,1:416.
[5]王琳,焦红军.发热机制的研究进展[J].中医研究,2000,13(2):57-59.
[6]曹志友.下丘脑TRPV1在LPS致大鼠发热过程中对体温及脑内AVP含量、[Ca2+]i的影响[D].沈阳:中国医科大学,2010.
[7]黄启福.病理学[M].北京:科学出版社,2007:127-131.
[8]Lisa R L.Cytokine regulation of fever.studies using gene knockoutmice[J].Journal of Applied Physiology,2002,92(6):2648-2655.
[9]黄涛,孟立,沈字玲等.长时间运动对正常大鼠体温和LPS发热反应的影响与IL-6的关系[J].成都医学院学报,2008,3(1):16-19.
[10]唐晓峰,薛漫清,王晖.大鼠发热模型及发热机制的研究进展[J].广东药学院学报,2009,25(3):327-330.
[11]CONTIB,TABAREAN I,ANDREIC,etal.Cytokines fever[J].Front B iosci,2004,9:1433-1449.
[12]田文静.柴胡透邪退热功用与其用量、配伍及机体状态关系研究[D].北京中医药大学,2010.
[13]STEINER A A,IVANOV A I,SERRATS J,et al.Cellular and molecular bases of the initiation of fever[J].PLoSBiology,2006,4(9):284-293.
[14]王洪海,谢鸣.复合病因造模法致脾虚证大鼠模型在免疫系统方面的变化[J].中国实验方剂学杂志,2006,12(12):41-45.
[15]陈丹云,罗道珊.李东垣“气虚发热”的病机探讨[J].中医药学刊,2004,22(12):2312.
(2013-04-22收稿)
Study on Antipyretic Effects and Mechanism of Astragalus Complying with Different Dosages of Radix Bupleuri
Zhao Ronghua1,Gao Xiulan2,Xie Ming1,Zhang Jingsheng1
(1 Formulary Department,the National Key Discipline,Beijing University of Chinese Medicine,Beijing 100029,China;2 Shandong College of Traditional Chinese Medicine,Yantai246100,China)
Objective:To explore the antipyretic action and mechanism of Astragalus complying with different dosages of Radix Bupleuri on the ratmodels of spleen-qi deficiency with fever.Methods:Themale wistar rats were random ly assigned to the normal group,the spleen-qi deficiency with fever group,the astragaluswith large dosage radix bupleurigroup,the astragaluswithmedium dosage radix bupleuri group,the astragaluswith small dosage radix bupleurigroup,and the radix bupleurigroup.Themodel rats of spleen-qideficiency were prepared through excess fatigue and outof constant diet for21 days.Themedicine group ratswere fed with 4.56g/kg(large),2. 95g/kg(medium)2.41g/kg(small)and 2.41g/kg(radix bupleurionly)once a day and theother two groupswere given physiological saline from the seventeenth day.At8:00 am on the 22th day,the rats ofmodel group and medicine groupswere respectively intraperitonealy injected with lipopoly saccharide(LPS,8 0μg/kg)to induce fever.The rats of the normal group were given physiological saline. The rectal temperature wasmeasured at different time after ip LPS.And then the amounts of cytokines in blood and transmitters which regulate temperature in hypothalamus were also measured.Results:Compared with the normal group,the temperature of rats in the spleen-qi deficiency with fever group raised to some extent at every observation time after ip LPS,especially at60min and 220min(P<0.05).IL-2 in blood、CAMPand PGE2in hypothalamus increased significantly(P<0.05).AVP in hypothalamus had decreased.Compared with the spleen-qi deficiency with fever group,the temperature of rats in everymedicine group decreased significantly to some extent(P<0.05).CAMP and PGE2in hypothalamus increased or decreased(P<0.05).The temperature declined and IL-1βin hypothalamus decreased significantly(P<0.05)in the radix bupleuri group and the astragaluswith small dosage radix bupleuri group.Blood of IL-1βincreased significantly(P<0.05)in the astragaluswith large dosage radix bupleurigroup.Compared with the astragaluswith large dosage radix bupleuri group,blood IL-1βdecreased significantly(P<0.05)in the astragaluswithmedium and with small dosage radix bupleuri groups,aswell as the radix bupleuri group.Blood IL-2 increased significantly(P<0.05)in the astragalus withmedium and with small dosage radix bupleuri groups.Conclusion:Astragalus complying with different dosage of radix bupleuriand only application of large dosage of radix bupleuri had antipyretic effect to themodel ratof spleen-qideficiencywith fever.Its antipyreticmechanism may be connected with reducing central pyrexia amboceptor PGE2and increasing AVP.And astragalus complying with small dosage of radix bup leuri and the only application of large dosage radix bupleurimay be also related to declining of central IL-1β.
10.3969/j.issn.1673-7202.2013.10.032
山东省高等学校科技计划项目(编号:J10LF80)
谢鸣(1957.6—),男,博士生导师,教授,研究方向:“方证相关”的研究,E-mail:xieming603@263.net
Key W ords Astragalusmongholicus;Radix bupleuri;Compatibility;Spleen-qi deficiency with fever;Antipyretic
