黏质红酵母的鉴定及链格孢菌抑菌机制的研究
2013-05-10蔡文韬夏延斌易有金任佐华
蔡文韬 夏延斌 夏 菠 易有金 任佐华
CAIWen-tao XIA Yan-bin XIA Bo YIYou-jin REN Zuo-hua
(湖南农业大学,湖南 长沙 410128)
(Hunan Agricultrue University,Changsha,Hunan 410128,China)
链格孢菌是茄科植株中危害较大的病害之一。该病不仅发生在田间,更是采后贮藏过程中的重要性病害,可侵染番茄、茄子、辣椒、马铃薯等茄科类果蔬[1,2],侵害途径主要是通过气孔、皮孔、伤口或表皮侵入果实,在适宜条件下产生大量孢子,对果实造成严重危害[3]。目前主要采用化学法进行防治,但是长期使用化学农药不仅会造成环境污染,也会使得病原菌的抗药性增强[4],果蔬上残留的农药也会对人体健康产生危害[5,6]。因此,利用生物法进行果蔬采后病害防控,得到越来越多的关注。
植物内生菌是一类适宜在植物体内生长的微生物,一般具有较高的安全性,其中部分菌株具有潜在的抗病菌的能力[7]。近年来,利用植物内生细菌防治植物土传病的研究已取得较大进展。但是对利用微生物进行果蔬采后保鲜方面的研究甚少,且多数集中在细菌如枯草芽孢杆菌、解淀粉芽孢杆菌等生物防治方面,并取得了较好的成果。刘杰凤等[8]从番茄、辣椒、茄子中分离出14株对青枯病有较强抑制作用的内生细菌;何红[9],邱思鑫[10]等报道了内生芽孢杆菌(Bacillus sp.)对辣椒疫霉引起的辣椒苗和果疫病有良好的防治效果;阿里马斯等[11]报道了放线菌对辣椒疫霉菌和炭疽病防治效果,但是关于内生真菌用于茄科链格孢菌的生防研究未见报道。另外由于这些微生物主要源于土壤、果蔬表面,易受外界因素的影响,导致防治效果不稳定,极大地影响了拮抗菌的实用价值。因此植物内生菌的活性物质的提取及其环境稳定性的研究在生物防治和果蔬采后处理已成为研究的热点。本试验从湖南省长沙县果蔬中心采集的柿子椒中筛选到了链格孢菌的拮抗真菌,通过16SrDNA序列分析对该菌株进行了鉴定,为黏质酵母菌。用乙酸乙酯和无水乙醇对黏质酵母菌发酵液抗菌物质进行提取,并进行活性稳定性测试和防腐应用研究,以期为食品防腐寻求新的技术途径,使内生菌代谢产物成为果蔬采后微生物抑制剂和作为天然杀菌剂具有广泛应用前景和开发潜能。
1 材料与方法
1.1 供试菌株
Strain-39菌:由本实验室从柿子椒果肉中分离得到;
链格孢菌:由湖南农业大学微生物实验中心提供。
1.2 Strain-39分子鉴定
参照文献[12]、[13]进行16SrDNA分子鉴定,PCR产物直接测序由上海美吉生物医药科技有限公司完成。得到的序列运用Clust X软件校准排齐后,在GenBank数据库中进行BLAST(http://www.ncbi.nlm.nih.gov/blast/)同源性比对分析。以16SrDNA的序列同源性大于99%为标准进行属种归类。然后在对待测菌株与模式菌株16SrDNA序列利用程序MEGA3.1中的Neighbor-Joining法构建系统发育树,进一步进行种属鉴定[14]。
1.3 拮抗菌strain-39的抑病活性检测
辣椒和番茄用自来水反复清洗干净,用0.1%次氯酸钠溶液浸泡消毒1~2min,然后用自来水冲洗掉残余次氯酸钠,晾干。用灭过菌的打孔器在番茄和辣椒各部位打一个直径6mm深2 mm的洞,接种拮抗菌strain-39约106CFU/mL的培养滤液20μL,静止5 min后,接种病原菌链格孢菌约106CFU/mL的菌液20μL,以不接种病原菌和接种病原菌的未浸泡拮抗菌的辣椒和番茄作为对照,28℃培养72 h,观察果蔬是否出现病斑及感病的程度。
1.4 Strain-39菌液成分对链格孢菌抑菌测定方法
在PDA平板中心接直径为5mm的链格孢菌菌饼,28℃培养3 d后,在离菌落边缘2.5 cm处用口径9mm的打孔器打4个孔,每孔分别加入200μL经过处理菌液成分,以无菌水作为空白对照,待对照病原菌菌落长到孔边缘(6~7 d)后测量抑菌圈直径。
(1)抑制率的计算:
(2)Strain-39菌液滤液制备的方法:将strain-39接种于PDA液体培养基中,振荡培养过夜作为种子液,按1%接种量接种于液体培养基中(装液量100 mL/250 mL锥形瓶中),28℃,180 r/min培养 7 d,用 10 000 r/min离心 15 min,纱布双层过滤去菌丝,用0.22μm的过滤头过滤得到发酵液。
(3)乙酸乙酯提取物的制备:发酵液用乙酸乙酯(1倍体积)萃取3次,重复3次,用旋转蒸发仪浓缩置干,用磷酸缓冲液溶解得乙酸乙酯提取液。
(4)75%乙醇沉淀物的提取:将无水乙醇置于冰箱内进行预冷处理,在抑菌物质粗提液中缓慢加入乙醇使其在终浓度达到75%,于4℃静置4 h以上,10 000 r/min,4℃离心20min,收集沉淀,即为粗提物,将所得蛋白溶于pH值为6.8的20mmol/L tris缓冲液中,所得沉淀即为75%乙醇沉淀粗提液。
1.5 菌液成分的抑菌机制
1.5.1 不同浓度菌液成分对链格孢菌抑菌效果 将strain-39菌液的75%乙醇沉淀粗提液和乙酸乙酯提取物按照半稀释 法 配 成 一 系 列 质 量 浓 度 梯 度(100,50,25,12.5,6.25mg/mL)的75%乙醇沉淀粗提液和乙酸乙酯提取物,75%乙醇沉淀粗提液用pH为6.8的20mmol/L tris缓冲液稀释,乙酸乙酯提取物用磷酸缓冲液稀释,在PDA平板中心接直径为5mm的链格孢菌饼,25℃培养2~3 d后,在离菌落边缘2.5 cm处用口径9mm的打孔器打4个孔,每孔加200μL菌液成分,以无菌水作为空白对照,待对照快要长满全皿时,测量抑菌直径,3次重复,计算毒理回归方程、EC50值和95%置信区。
1.5.2 Strain-39菌液成分对果实病害的抑菌作用 菌液乙醇沉淀粗提液和乙酸乙酯提取物分别用缓冲液稀释到100mg/mL待用选取外观整齐、饱满圆润、无损伤的新鲜辣椒和番茄,用自来水清洗后在0.1%次氯酸钠溶液中浸泡消毒3min,再用自来水反复冲洗至残余次氯酸钠洗掉,晾干。用无菌的打孔器在番茄和辣椒的部位各打一个直径6 mm深2mm的洞,注入20μL菌液成分,静置2 h后,立即在伤口处加入20μL链格孢菌孢子悬浮液,以保鲜液和无菌水作为对照。用保鲜袋密封,以保持湿度,将蔬菜置于25℃培养箱内贮藏,7 d后计算烂果率,每个处理分3组。每组随机挑选60个果实,试验重复3次,结果取平均值。
1.5.3 Strain-39菌液75%乙醇沉淀粗提液以及乙酸乙酯提取物对链格孢菌菌丝形态影响 链格孢菌在PDA培养基上培养48 h活化,移接菌蝶5片于浓度为10%的75%乙醇沉淀粗提液和乙酸乙酯提取液中,以加相同量的不含菌的培养基为空白对照,培养48 h后在光学显微镜观察病原菌菌丝形态和结构的变化。
1.5.4 75%乙醇沉淀粗提液及乙酸乙酯提取物对链格孢菌分生孢子萌发的影响 将链格孢菌接种在PDA培养基上,于28℃培养10 d,然后加入一定量的无菌磷酸盐缓冲液冲洗斜面上的孢子,经无菌纱布过滤除去菌丝残体,用无菌磷酸盐缓冲液稀释至孢子浓度为106个/mL。每个视野60个孢子(10倍放大),取20μL滴加在凹玻片上,将凹玻片放在灭菌的培养皿内,培养皿内预先放入10 mL无菌水,在无菌水上平放一张灭菌滤纸。再滴加20μL 75%乙醇沉淀粗提液和乙酸乙酯提取液。混匀后置于28℃下培养12 h,以无菌水处理为对照,并按式(2)计算拮抗菌的抑制率,每处理3次重复,结果取平均值。
1.5.5 胞外蛋白以及乙酸乙酯提取物对链格孢菌分生孢子产生的影响 链格孢菌在PDA培养基上培养48 h,然后将菌蝶接种于PDA培养基中央,待菌落直径达3 cm时,将周围培养基挖出,将75%乙醇沉淀粗提液和乙酸乙酯提取物分别用磷酸缓冲液稀释2倍和10倍,分别取20mL淹没真菌菌落20min,倾去缓冲稀释液,每处理3次重复,以无菌水处理为空白对照,置于28℃下培养6 d,至孢子产生,每平板用10mL无菌磷酸盐缓冲液将孢子洗下,经4层纱布过滤,得孢子悬浮液,用血球计数板在显微镜下计数。
1.5.6 不同温度处理对75%乙醇沉淀粗提液和乙酸乙酯提取物抑菌活性的影响 将75%乙醇沉淀粗提液和乙酸乙酯提取液2mL装于试管中,在50,75,100℃条件下处理20min(恒温水浴锅内进行),121℃(高压灭菌锅内进行)处理20min,以未进行温度处理的各样品作为对照,测定抑菌活性,每处理3个重复,试验结果取平均值。
1.5.7 pH对75%乙醇沉淀提取液和乙酸乙酯提取物抑菌活性的影响 调节50 mmol/L磷酸钠缓冲液(pH 7.0)的pH值分别为 2.0,4.0,6.0,8.0,10.0,12.0,将 75%乙醇沉淀粗提液和乙酸乙酯提取物与不同的缓冲液等体积混合,置于4℃的冰箱内保存24 h,再用2 mol/L的盐酸、氢氧化钠调节pH至原菌液成分酸碱度(7.0左右),用0.45μm微孔滤膜过滤除菌。以链格孢菌为指示菌,测定抑菌活性,未经过处理的各样品作为对照,每处理3个重复,试验结果取平均值。
1.5.8 紫外线处理对75%乙醇沉淀粗提液和乙酸乙酯提取物抑菌活性的影响 取1 mL 75%乙醇沉淀粗提液和乙酸乙酯提取液置于60W紫外灯下30 cm照射1 h,以未经处理的各样品成分为对照,每处理3个重复,试验结果取平均值。
1.5.9 数据分析 用SAS统计软件对测定结果进行单因素方差分析,以P<0.05判断差异有显著性,P<0.01判断差异极显著,结果以“平均值±标准差”表示。
2 结果与分析
2.1 菌体和菌落特征

图1 菌株strain-39的16SrDNA序列PCR扩增结果Figure 1 PCR results of 16SrDNA sequences from the isolated srains-39

图2 基于16SrDNA序列的菌株strain-39系统发育树Figure 2 Phylogenetic tree based on 16SrDNA sequence analysis of strain-39
通过稀释洗液涂布平板后可以形成单独的菌落,这些内生拮抗真菌的菌落形态相似,边缘整齐,不着色,表面光滑,稍湿润,无光泽,菌体椭圆形,橘红色,取其中一个菌落,复红简单染色后,置普通光学显微镜下观察,菌体为革兰氏阳性。提取菌株strain-39基因组DNA,以内生菌株strain-39基因组DNA为模板,按1.2中的方法进行PCR扩增(图1),对PCR产物直接测序得到strain-39的16SrDNA长度为539 bp。利用Blast软件,将菌株的16SrDNA序列与GenBank中数据库已知的16SrDNA基因序列进行比对,真菌strain-39的 16SrDNA 序列(539 bp)与(Uncultured basidiomycota genomic DNA)的序列相同。用软件MEGA3.1按Neighbor-Joining法构建系统发育树(图2)相似性都达到100%,结合strain-39形态特征、培养特征及生理生化指标测定等表型鉴定结果,strain-39菌株鉴定为黏质红酵母(Rhodotorula mucilaginosa)。
2.2 拮抗菌strain-39的抑病活性检测
由图3可知,仅接种链格孢菌,不接种内生菌的辣椒和番茄上出现明显的链格孢菌病斑,而接种内生菌的辣椒和番茄上,链格孢菌产生的病斑较小。说明菌株stain-39发酵液能够较好的降低链格孢菌的致病力。
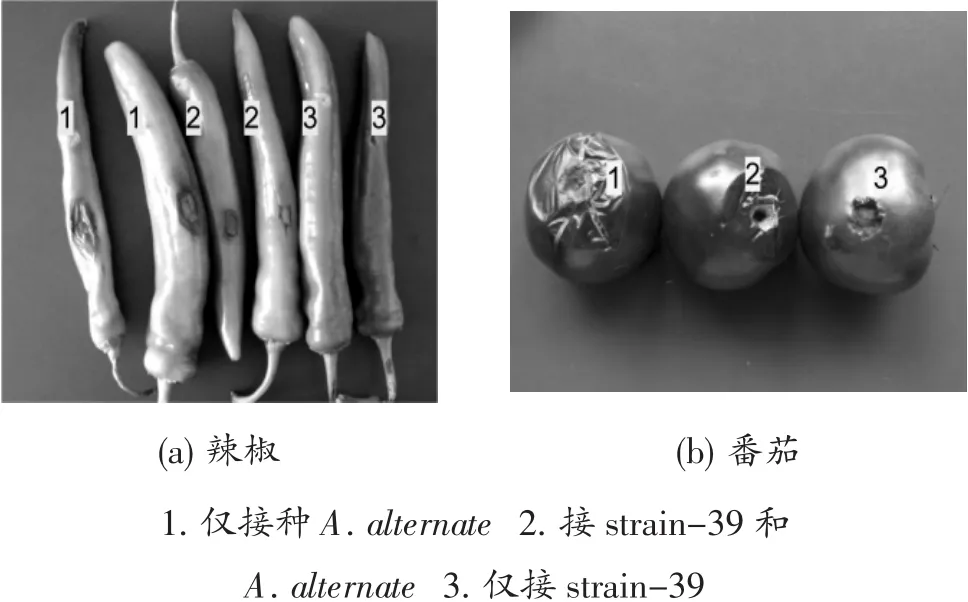
图3 黏质红酵母strain-39对链格孢菌的抑菌活性试验Figure 3 Detection of inhibitory activity of strain-39 against pathogen A.alternate
2.3 菌液75%乙醇沉淀粗提液和乙酸乙酯提取物对链格孢菌体外抑菌效果
对菌株strain-39 75%乙醇沉淀粗提液和乙酸乙酯提取液进行抑菌活性测定,由图4和表1可知,75%乙醇沉淀粗提液和乙酸乙酯提取物稀释不同浓度处理对链格孢菌都有较好的抑菌效果,strain-39菌液乙醇沉淀粗提液质量浓度梯度为 100,50,25,12.5,6.25mg/mL 时对链格孢菌的抑制率分别为85.45%,80%,54.55%,43.64%,28.88%。乙酸乙酯提取物质量浓度梯度为 100,50,25,12.5,6.25mg/mL 时对链格孢菌抑制率分别为 86.85%,81.97%,72.13%,45.90%,35.87%,其中75%乙醇沉淀提取液的EC50为16.353 1 mg/L,而乙酸乙酯提取物的EC50为11.800 3mg/L,后者抑菌效果较前者高。
2.4 Strain-39菌液成分对果实病害的抑菌作用
由图5可知,通过损伤接种,strain-39的菌液成分对茄科植物辣椒和番茄果肉都具有明显的抑菌作用,在一定质量浓度下均能降低辣椒和番茄的烂果率,乙酸乙酯提取物质量浓度为100 mg/mL时,辣椒的烂果率与无菌水相比下降了51.879%,番茄的烂果率与无菌水相比下降了58.47%,75%乙醇沉淀粗提液的腐烂率与无菌水相比辣椒的烂果率下降了47.5%,番茄的烂果率与无菌水相比下降了50.47%,不同菌液成分相比,乙酸乙酯提取物比75%乙醇沉淀粗提液的抑菌效果较好,与体外抑菌效果一致。与体外抑制作用效果相比,体内抑制作用的效果显然有所降低,但直接证明了strain-39抑菌成分对果实病害的抑制作用。
2.5 Strain-39菌液75%乙醇沉淀粗提液以及乙酸乙酯提取物对链格孢菌菌丝形态的影响
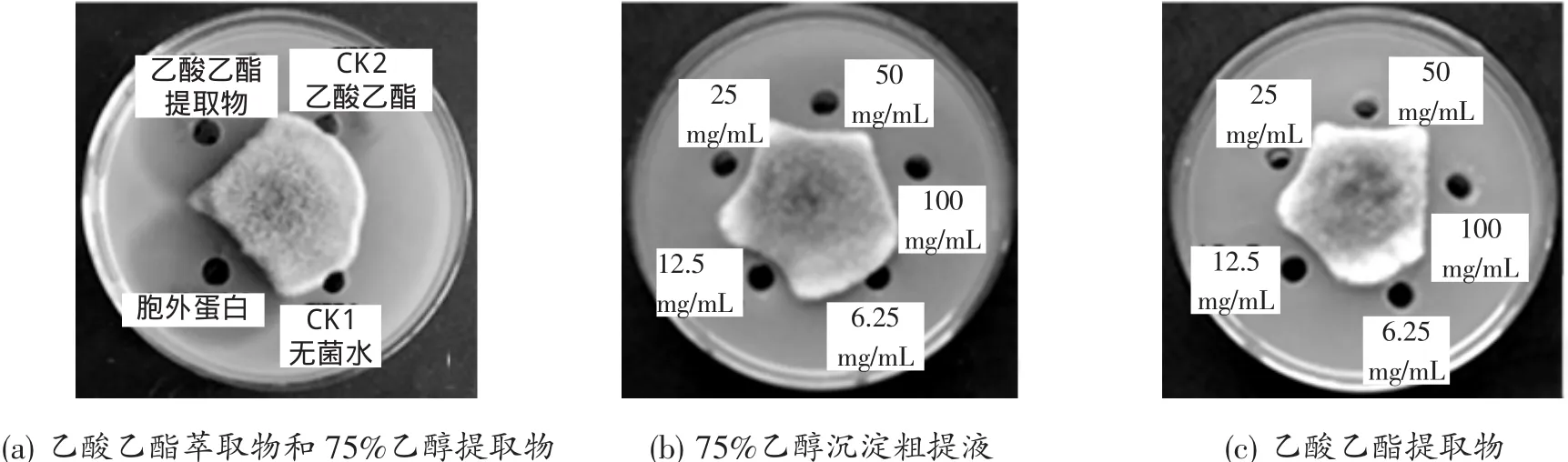
图4 75%乙醇沉淀粗提液和乙酸乙酯提取物对链格孢菌抑菌效果Figure 4 Effecton A.alternata by 75%ethanol sediment liquid and ethyl acetate extract produced from strain-39

表1 菌株strain-39不同菌液成分对链格孢菌的抑制作用Table1 Inhibition effects of extraction from strain-39 against A.alternate
由图6和7可知,strain-39菌液75%乙醇沉淀粗提液及乙酸乙酯提取物对链格孢病菌菌丝的形态均有影响,将链格孢菌与strain-39 75%乙醇沉淀提取液和乙酸乙酯提取物在PDA平板上对峙培养6 d后,产生明显的抑菌带,靠近菌液成分边缘处的病菌不能正常向外扩展,而且此处菌丝变成褐色,说明其活性物质可抑制链格孢菌的生长,调取边缘菌丝在显微镜下观察,活性成分边缘的链格孢菌的菌丝顶端及中间形成大量泡状体,以致整个菌丝变成串珠状,菌丝体分枝增多、畸形。且乙酸乙酯提取物处理的部分菌丝呈现原生质颗粒化,而正常生长的菌丝成细长状,且整个菌丝均匀透明。
2.6 Strain-39 75%乙醇沉淀粗提液及乙酸乙酯提取物对链格孢菌分生孢子萌发的影响
由表2可知,strain-39的75%乙醇沉淀粗提液处理后抑制链格孢菌分生孢子的萌发率为7.45%,而以无菌水处理的对照处理组分生孢子萌发率为75.36%;乙酸乙酯提取物处理过的孢子萌发率为9.6%,对照组为73.65%。由此说明,strain-39的75%乙醇沉淀粗提液和乙酸乙酯提取物对链格孢菌分生孢子的萌发都具有较好抑制作用。
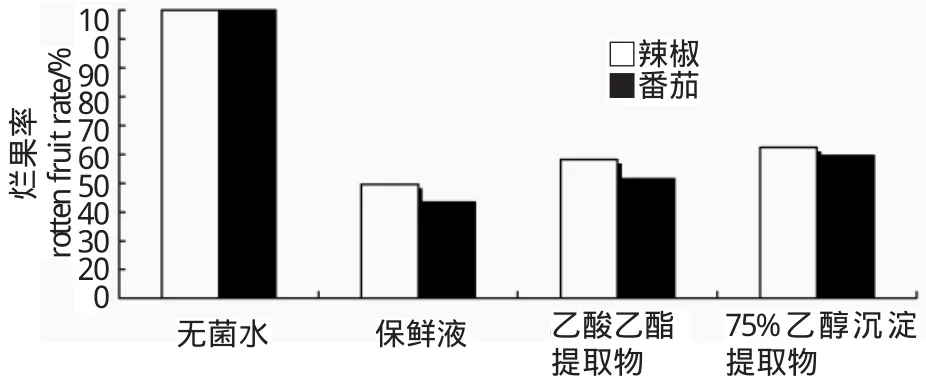
图5 Strain-39菌液成分对辣椒、番茄的抑制效果的影响Figure 5 Inhibitory effectof extraction from strain-39 on diseases of peppers and tomatoes

图6 Strain-39 75%乙醇沉淀提取液处理链格孢菌菌丝的形态Figure 6 Effectonmorphology by 75%ethanol sediment liquid produced from strain-39

图7 Strain-39乙酸乙酯提取物处理链格孢菌菌丝的形态Figure 7 Effectonmorphology by ethyl acetate extract produced from strain-39
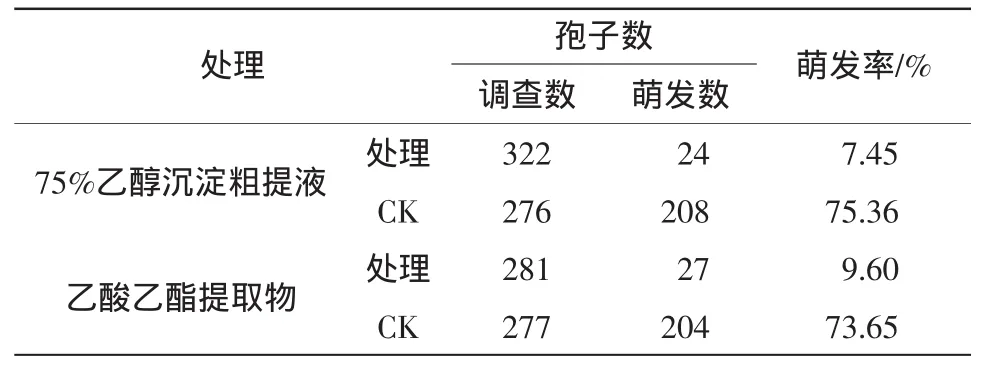
表2 Strain-39的75%乙醇沉淀粗提物和乙酸乙酯提取物对链格孢菌分生孢子萌发的影响Table2 Effecton germination of conidiospore of A.alternata by 75%ethanol sedimentand ethyl acetate extract produced from strain-39
2.7 Strain-39的75%乙醇沉淀粗提液以及乙酸乙酯提取物对链格孢菌分生孢子产生的影响
将PDA培养基中生长至3 cm的链格孢菌菌块分别加入稀释2倍、10倍浓度的75%乙醇沉淀粗提液和乙酸乙酯提取液20mL,浸没菌落20min后去除液体,以无菌水为对照,每个处理3次重复,6 d后计算孢子萌发率,结果见表3。不同稀释倍数的75%乙醇沉淀粗提液和乙酸乙酯提取液均对链格孢菌分生孢子产生显著性抑制作用,随其稀释倍数的增加,抑制作用也逐渐减弱,与对照相比,75%乙醇沉淀粗提液稀释2倍链格孢菌孢子数为0.106×106个,其抑制率达到84.7%,稀释10倍其孢子数为0.253×106个,孢子抑制率达到63.49%。而乙酸乙酯提取物稀释2倍对孢子抑菌率为66.42%,稀释10倍抑制率为71.87%,说明strain-39的75%乙醇沉淀粗提液和乙酸乙酯提取物可较好地抑制链格孢菌的产孢。
表3 Strain-39的75%乙醇沉淀粗提液和乙酸乙酯提取物对链格孢菌分生孢子产生的影响Table3 Effect on production of conidium of A.alternata by 75%ethanol sediment and ethyl acetate extract produced from strain-39(/×106 CELLS·mL-1)
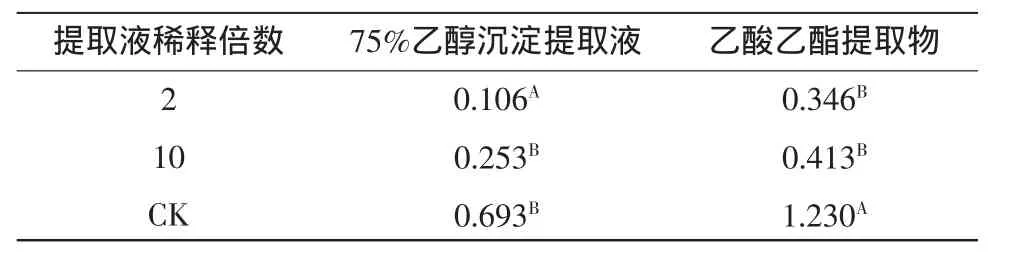
表3 Strain-39的75%乙醇沉淀粗提液和乙酸乙酯提取物对链格孢菌分生孢子产生的影响Table3 Effect on production of conidium of A.alternata by 75%ethanol sediment and ethyl acetate extract produced from strain-39(/×106 CELLS·mL-1)
同列不同行大写字母不同代表差异显著,P<0.05。
提取液稀释倍数2 10 CK乙酸乙酯提取物0.346B 0.413B 1.230A 75%乙醇沉淀提取液0.106A 0.253B 0.693B
2.8 不同温度处理对strain-39 75%乙醇沉淀粗提液和乙酸乙酯提取物液抑菌活性的影响
表4 不同温度处理下strain-39的75%乙醇沉淀粗提液和乙酸乙酯提取物对链格孢菌生长的影响Table4 Effecton growth of of A.alternate by 75%ethanol sedimentand ethyl acetate extract produced from strain-39 under different temperature
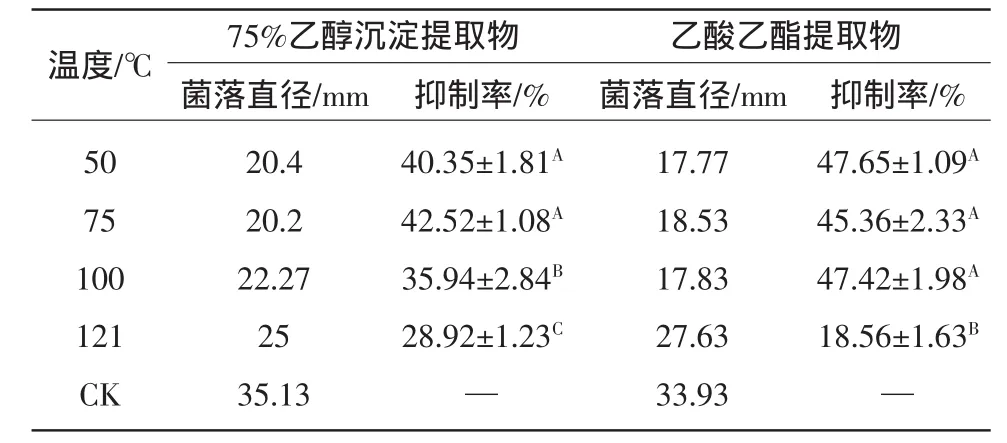
表4 不同温度处理下strain-39的75%乙醇沉淀粗提液和乙酸乙酯提取物对链格孢菌生长的影响Table4 Effecton growth of of A.alternate by 75%ethanol sedimentand ethyl acetate extract produced from strain-39 under different temperature
同列不同行大写字母不相同代表差异显著,P<0.05。
温度/℃75%乙醇沉淀提取物 乙酸乙酯提取物菌落直径/mm 抑制率/% 菌落直径/mm 抑制率/%50 75 100 121 CK 47.65±1.09A 45.36±2.33A 47.42±1.98A 18.56±1.63B—20.4 20.2 22.27 25 35.13 40.35±1.81A 42.52±1.08A 35.94±2.84B 28.92±1.23C—17.77 18.53 17.83 27.63 33.93
取strain-39菌液75%乙醇沉淀粗提液和乙酸乙酯提取物,不同温度处理后测定其抑制率。由表4可知,75%乙醇沉淀粗提液在50℃和120℃,随着温度的增加抑菌活性逐渐降低(P<0.05),乙酸乙酯提取物在50~100℃时无显著性差异(P<0.05),在121℃时,抑菌效果明显降低(P<0.05)。两者活性成分在不同温度处理下抑菌活性不同,说明Strain-39中抑菌活性物质可能含有几种,且总体抑菌效果受温度影响不大。即使120℃高温处理下,菌液成分仍保持部分抑菌活性。
2.9 pH对strain-39的75%乙醇沉淀提取物和乙酸乙酯提取物的抑菌活性影响
由表5可知,pH在2~12对不同成分均有抑菌活性,strain-39的75%乙醇沉淀提取液最适pH为4~6,且抑菌活性达到52.66%,抑菌活性随着pH的增加而增加,无显著性差异(P<0.05),说明pH在酸性条件下活性比较稳定,在碱性条件下随着pH的增加活性逐渐降低,pH 12时活性显著性降低(P<0.05),而乙酸乙酯提取物最适pH为6~8,在 pH 6时,抑菌活性达到38.97%,与75%乙醇沉淀提取物处理液相比,活性较稳定。在pH 2和pH 10条件下,仍具有活性。说明菌液成分活性物质具有较高酸碱稳定性。
表5 不同pH处理下strain-39的75%乙醇沉淀提取物和乙酸乙酯提取物对链格孢菌生长的影响Table5 Effect on the growth of A.alternata by 75%ethanol sedimentand ethyl acetate extract produced from strain-39 under different pH
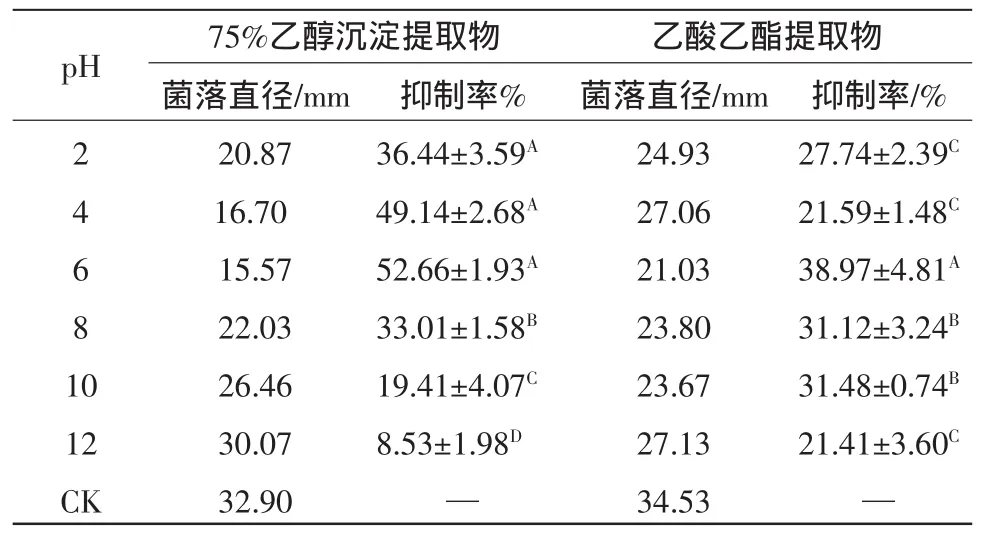
表5 不同pH处理下strain-39的75%乙醇沉淀提取物和乙酸乙酯提取物对链格孢菌生长的影响Table5 Effect on the growth of A.alternata by 75%ethanol sedimentand ethyl acetate extract produced from strain-39 under different pH
同列不同行大写字母不同代表差异显著,P<0.05。
pH 75%乙醇沉淀提取物 乙酸乙酯提取物菌落直径/mm 抑制率% 菌落直径/mm 抑制率/%2 4 6 8 1 0 12 CK 27.74±2.39C 21.59±1.48C 38.97±4.81A 31.12±3.24B 31.48±0.74B 21.41±3.60C—20.87 16.70 15.57 22.03 26.46 30.07 32.90 36.44±3.59A 49.14±2.68A 52.66±1.93A 33.01±1.58B 19.41±4.07C 8.53±1.98D—24.93 27.06 21.03 23.80 23.67 27.13 34.53
2.10 紫外线处理对strain-39的75%乙醇沉淀提取物和乙酸乙酯提取物抑菌活性的影响
表6 Strain-3975%乙醇沉淀提取物和乙酸乙酯提取物在紫外处理下对链格孢菌生长的影响Table6 Effecton the growth of A.alternata by 75%ethanol sedimentand ethyl acetate extract produced from strain-39 under UV
同列不同行大写字母不同代表差异显著,P<0.05。
紫外处理/min 75%乙醇沉淀提取物 乙酸乙酯提取物菌落直径/mm 抑菌率% 菌落直径/mm 抑制率/%30 60 90 CK 20.23 23.23 24.77 37.07 45.32±4.35A 37.25±2.75B 33.23±2.06B—23.87 28.54 31.7 37.7 41.02±6.35A 24.32±1.49B 15.89±1.44B—
由表6可知,在紫外照射下菌液不同成分都具有一定的抑菌活性,在紫外下照射30min,strain-39的75%乙醇沉淀提取物和乙酸乙酯提取物的抑菌效果最高,随着紫外照射的时间延长乙酸乙酯提取物的抑菌活性显著性降低(P<0.05),在90min时抑菌效果最弱,而75%乙醇沉淀提取物在处理90min后抑菌活性无显著变化。整体来说不同菌液成分经紫外处理后仍保持一定的抑菌活性。
3 讨论
本试验从新鲜辣椒果肉内筛选出一株对茄科链格孢菌具有抑菌效果的内生拮抗菌,通过16SrDNA鉴定为黏质红酵母(Rhodotorulamucilaginosa),该菌株能够明显降低链格孢菌的致病力,具有成为果蔬采后链格孢菌抑制剂和作为天然杀菌剂的广泛应用前景。
对该菌株的菌液成分75%乙醇沉淀提取物和乙酸乙酯提取物抑菌活性进行评价,结果发现strain-39的75%乙醇沉淀提取物和乙酸乙酯提取物均具有良好的抗菌活性。strain-39在链格孢菌菌丝生长和发育、孢子的产生和萌发等都具有抑制作用,表明拮抗菌strain-39有效抑制了链格孢菌的生长、繁殖等各个环节,且对链格孢菌侵染循环的抑制是各个环节共同作用的结果,具有广泛的开发和应用前景。
防腐保鲜试验结果显示strain-39菌液成分对抵御病原真菌的侵入,减少腐烂率,在防腐保鲜方面起到了重要作用,链格孢菌是茄科植物常见的病原菌,因此考虑将其替代化学杀菌剂用于果蔬采后保鲜方面,有望为食品防腐寻求新的技术途径。
Strain-39分泌的抗菌物质主要为低分子量抗菌素和胞外蛋白[14,15]。菌株strain-39 75%沉淀提取物在高温处理后对链格孢菌抑制效果逐渐降低,但不是很明显,是否为抑菌蛋白有待进一步研究。而乙酸乙酯提取物在121℃时抑菌活性明显下降,说明strain-39对链格孢菌的抑菌作用是为多种活性物质作用的共同结果,后期还将进一步分离纯化strain-39菌株代谢物的抑菌活性成分,并对其结构进行鉴定,进而对所分离出的各组分的抑菌活性和相互作用做更深入的研究。
1 邹凤莲,汪志平,卢钢.番红花链格孢菌的分离及其生物学特性研究[J].浙江大学学报,2006,32(2):162~167.
2 冯源,祖艳群,陈海燕,等.UV-B辐射增强对链格孢菌生长、生理及致病力的影响[J].植物学报,2010,36(4):64~69.
3 赵亚兰,朱圣洁,任素樱.番茄早疫病的综合防治[J].河套大学学报,2010,7(4):23~25.
4 Sharma R R,Singh D,Singh R.Biological control of postharvest diseases of fruits and vegetables by microbial antagonists:A review[J].Biol.Control,2009,50(3):205~221.
5 Korsten L.Advances in control of postharvest diseases in tropical fresh produce[J].International Journal of Postharvest Technology and Innovation,2006,1(1):48~61.
6 Mann A,Yahaya Y,Banso A,et al.Phytochemical and antibacterialscreening of anogeissus leiocarpus against somemicroorganisms associated with infectious wounds[J].African Journal of Microbiology Research,2008,2(3):60~62.
7 刘杰凤,韩寒冰,张进凤,等.茄类内生菌的分离及生防功能初探[J].安徽农业科学,2009,37(3):1 160~1 162.
8 何红,蔡血清,陈玉森,等.辣椒内生枯草芽孢杆菌BS-2和BS-1防治香蕉炭疽病研究[J].福建农林学报,2002,31(4):441~443.
9 邱思鑫,何红,阮宏椿.内生芽孢杆菌TB2防治辣椒疫病效果及其机理初探[J].植物病理学报,2004,34(2):173~179.
10 张晓鹿.辣椒疫病生防真菌与放线菌混合接种的防病促生效应研究[D].陕西:西北农林科技大学,2007.
11 别小妹,陆兆新,房耀维,等.利用16SrDNA序列分析鉴定一株抗菌物质的微生物菌株[J].食品科学,2006,27(11):466~470.
12 孔维嘉,王洋,尚楠,等.扩展青霉拮抗菌的筛选鉴定及抗菌物质分析[J].食品科学,2011,32(15):153~156.
13 东秀珠.常见细菌系统鉴定手册 [M].北京:科学出版社,2001:62~64.
14 Mcinroy J A,Kleopper JW.Population dynamics of endophytic bacteria in field-grown sweet corn and cotton[J].Can J.Microbiol.,1995(41):895~901.
15 刘伟成,卢彩鸽,刘学敏,等.利迪链霉菌A02抗真菌活性产物的分离和结构鉴定[J].生物工程学报,2009,25(6):840~846.
