NaCl和PEG6000胁迫下枣组培苗中ZjAPX的表达
2013-05-01孟玉平曹秋芬郭慧娜王国平
孟玉平 ,曹秋芬 ,2,,郭慧娜 ,,任 莹 ,王国平
(1.山西省农业科学院生物技术研究中心,山西太原030031;2.农业部黄土高原作物基因资源与种质创制重点实验室,山西太原030031;3.山西大学生物工程学院,山西太原030006;4.山西省农业科学院果树研究所,山西太谷030815)
为了从分子水平了解枣树适应性强、抗旱、耐盐碱、耐瘠薄的特性,为农作物的抗性育种提供优良的功能基因,近年来山西省农业科学院生物技术研究中心果树生物技术课题组构建了枣树结果枝(落性枝)的cDNA文库[1],并对获得的一些与抗逆性有关的功能基因进行了深入的研究。ZjAPX(DDBJ/EMBL/GenBank的注册号为AB608053)是其中获得的一个枣树抗坏血酸氧化酶基因,对其进行了原核表达蛋白的研究[2]和cDNA序列生物信息学分析及完整开放阅读框植物表达载体 PEZR(K)-LNY-ZjAPX的构建[3]。大量的研究表明,抗坏血酸过氧化物酶基因(APX)的表达受各种环境胁迫因子(如干旱、高盐、除草剂、低温、病原菌侵染)的诱导[4-6]。
本研究以枣树组织培养苗为供试材料,探讨了在不同浓度的NaCl和PEG6000模拟干旱胁迫条件下ZjAPX基因的表达,以了解枣树ZjAPX在逆境胁迫时的作用。
1 材料和方法
1.1 材料
试验所用的NaCl,PEG6000及MS培养基中所用试剂均购自天津天大化工;植物激素6-BA和 NAA,PEG6000,饱和酚,DEPC,RNA提取所用到的试剂均购自生工生物工程(上海)有限公司;DL 2000Marker购自北京全式金生物技术有限公司;反转录试剂盒( PrimeScriptRRTMaster Mix),荧光定量PCR试剂盒(SYBQRPremix EX TaqTMⅡ),荧光定量过程中所用的PCR管均购自大连TaKaRa(宝生物)工程有限公司;用于PCR鉴定和荧光定量的引物由生工生物工程(上海)有限公司合成;荧光定量PCR仪为Applied Biosystems的 7300Real Time PCR System。
植物材料采用组织培养的枣树苗(Ziziphus jujuba Mill)。 继代培养基为:MS+6-BA 0.5mg/L+琼脂6 g/L,pH值5.8~6.0;生根培养基为:1/2 MS+NAA 0.3mg/L+肌醇50mg/L+琼脂6 g/L,pH值 5.8~6.0。培养室温度为(25±1)℃,光照周期12 h/d,光照强度2 000~3 000 lx。
1.2 方法
1.2.1 枣苗胁迫处理 选取生长30~40 d健壮且长势较一致的生根枣苗植株用于胁迫处理。将植株放入加有NaCl和PEG6000的液体生根培养基中,单株处理,重复3次,以植株放入不加NaCl和PEG6000的液体生根培养基为对照。
PEG6000渗透压处理分别为 0.5,1.2MPa,处理后分别于 1,4,7,24,48 h取样。NaCl浓度处理分别为 50,300mmol/L,处理后分别于 3,6,24,48 h取样。所取样品立即冷冻于液氮后保存于-70℃冰箱,用于RNA的提取。
1.2.2 RNA提取和质量检测 采用CTAB法[7]提取1.2.1处理样品的总RNA,用DNaseⅠ除去DNA。用蛋白核酸分光光度计检测总RNA的OD和A260/A280值,甲醛变性凝胶电泳观察总RNA条带的完整性。
1.2.3 反转录 利用反转录试剂盒将1.2.2提取的总RNA反转录成cDNA。反转录体系:5×Prime ScriptRBuffer4μL,TotalRNA 1μg,总体积15μL;反应条件:37℃ 15min,85℃ 5 s。 反转录后测定OD值,并稀释成为100 ng/μL作为模板cDNA用于荧光定量分析。
用Real-time PCR相对定量的方法分析枣植株在不同胁迫条件下ZjAPX mRNA的相对表达量。内参基因选用枣树组蛋白ZjH3基因[8-9](GenBank:EU916201),根据其序列设计特异性引物。 上游引物 H1:5′-GAGGAAGCAACTGGCAAC TAAGG-3′;下游引物 H2:5′-ACCAGCCTCTGGA ATGGAAGTTTG-3′,可扩增出 165 bp的片段。目的基因ZjAPX的上游引物X1:5′-TCGATATCGC TGTCAGACTAC-3′;下游引物 X2:5′-TTGTCCTC TCTTCCTGGATG-3′,可扩增出145 bp的片段。引物委托北京六合华大基因科技股份有限公司合成。
1.2.4 荧光定量PCR 定量PCR反应体系总体积 20μL,包括上下游引物各 0.4μL( 20 pmol/μL),cDNA1μL(100 ng),SYBRRPremix EX TaqTMⅡ10μL,ROX Reference Dye 0.4μL,ddH2O 7.8μL。反应条件为:95℃预变性30 s;95℃变性5 s,60℃延伸31 s,循环40次。基因相对定量表达分析 采 用 2-ΔΔCt法, 其 中,ΔΔCt= 处 理 枣 苗( Ct(ZjAPX)值-Ct(Actin) 值)-对照枣苗(Ct(ZjAPX)值-Ct(Actin)值),每个样品重复3次。
2 结果与分析
2.1 枣组培苗胁迫处理后形态学观察
将正常生长且长势较一致的枣组培苗进行NaCl和模拟干旱PEG6000处理,各处理短时间胁迫后植株外观形态上没有什么异常,当处理至24 h时,300mmol/LNaCl和 1.2MPa PEG6000溶液处理过的枣组培苗叶片开始出现萎蔫;处理至48 h时,300mmol/L NaCl处理的枣组培苗叶片变白,有死亡迹象,1.2MPa PEG6000溶液处理的组培苗叶片全部变白死亡。
2.2 RNA的质量检测
用蛋白核酸分光光度计检测所提取的总RNA,结果表明,其A260/A280值在1.8~2.0之间,甲醛变性凝胶电泳发现28S和18S的rRNA条带完整,28S的rRNA条带亮度为18S的rRNA条带亮度的2倍,表明总RNA有较好的完整性和纯度,能满足反转录的要求。
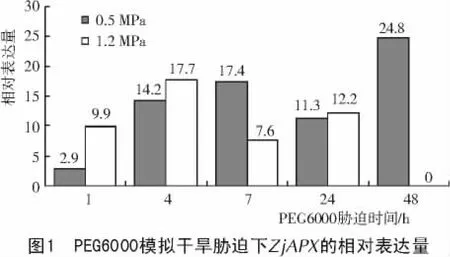
2.3 PEG6000模拟干旱胁迫下ZjAPX的表达
由图1可知,在不同渗透压、不同时间的PEG6000处理枣组培苗后,ZjAPX的表达量不同。0.5MPa处理下,1 h时ZjAPX的表达量较低,为2.9,随着胁迫时间的增加表达量也增高,7 h时增加到17.4,但24 h又降低到11.3,48 h时最高(24.8);增加PEG6000的浓度使渗透压达1.2 MPa时,处理1 h的ZjAPX表达量已增至9.9,4 h时最高(17.7),此后随着时间的增加表达量降低,24 h稍有回升,48 h时植株已干枯死亡。整体趋势表现为随着干旱胁迫时间和渗透压的增加,ZjAPX的表达量增高,在达到一定的量后开始降低,干枯死亡之前又有一个高峰。
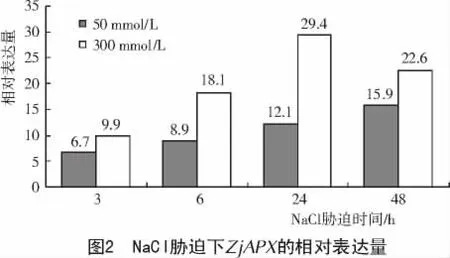
2.4 NaCl胁迫下ZjAPX的表达
由图2可知,低浓度50mmol/L的NaCl胁迫下,3~48 h的ZjAPX的表达量一直在增加;高浓度 300mmol/L的 NaCl胁迫时,3~24 h的ZjAPX表达量在增加,24 h时最高(29.4),48 h时叶片表现出死亡迹象,ZjAPX的相对表达量降低到22.6。整体表现为随着NaCl胁迫时间和浓度的增加,ZjAPX的表达量增高,当达到一定量时表达量开始降低,直至植株死亡。
3 讨论与结论
干旱、盐碱、低温以及高温等多种逆境将会破坏植物活性氧解毒系统,使活性氧累积损伤细胞膜。增强植物体内活性氧清除酶类的活性及抗氧化代谢的水平是提高植物抗逆性的重要途径之一。Gueta-Dahan等[10]通过比较耐盐和盐敏感柑橘中抗氧化酶的活性发现,超氧化物歧化酶、谷胱甘肽还原酶等的活性在二者之间差别不大,而耐盐柑橘中的抗坏血酸过氧化物酶活性大大高于盐敏感柑橘。Tsugane等[11]也发现,与野生型拟南芥相比,在盐胁迫条件下能进行光合自养的拟南芥隐性突变体中,抗坏血酸过氧化物酶的活性显著增强。马长乐等[12]利用Northern杂交分析了盐地碱蓬APX基因在400mmol/L NaCl胁迫下的表达,证明APX基因表达量增加,而且APX酶的活性也显著增加,说明该基因受盐诱导,推测APX可能在保护盐地碱蓬免受氧化损伤的过程中起到了一定作用。大量研究证明,植物在逆境下会诱导抗坏血酸过氧化物酶基因表达[13-15]。
本研究利用组织培养植株生长环境和培养基均易控制的特点,探讨了在其培养基中添加NaCl和PEG6000胁迫枣组培苗后ZjAPX基因的表达,结果表明,ZjAPX基因受NaCl和PEG6000诱导表达,而且在一定浓度和时间范围内,随着浓度的增大和胁迫时间的延长其表达量增高。说明ZjAPX基因参与了植株抵抗盐和干旱带来的伤害,但随着胁迫伤害的增大,植物体的耐性减弱,ZjAPX基因的表达随之降低。为了进一步证明ZjAPX基因在提高植物耐盐、耐旱中的作用,将利用模式植物拟南芥继续对ZjAPX基因的功能进行鉴定。
[1]孟玉平,曹秋芬,孙海峰,等.枣结果枝cDNA文库的构建与部分 ESTs分析[J].华北农学报,2009,24( 5):102-106.
[2]张晓娟,郝子琪,杨大威,等.枣树ZjAPX基因的原核表达[J].山西农业科学,2012,40( 3):189-192.
[3]郝子琪,许洪仙,孟玉平,等.枣树抗坏血酸过氧化物酶基因ZjAPX生物信息学分析及植物表达载体的构建 [J].山西农业科学,2011,39( 5):400-403.
[ 4] Schoner S,Krause GH.Protective systems againstactive oxygen species in spinach:response to cold acclimation in excess light[J].Planta,1990,180:383-389.
[ 5] Mittler R,Feng X,Cohen M.Post-transcriptional suppression of cytosolic ascorbate peroxidase expression during pathogen-induced programmed cell death in tobacco[J].Plant Cell,1998,10:461-473.
[6]李颖,马锋旺.抗坏血酸过氧化物酶基因转化苹果的研究[J].西北农业学报,2010,19( 1):140-143,163.
[7]曹秋芬,孟玉平,孙毅.苹果属植物总RNA有效、快速提取方法简介[J].农业生物技术学报,2003,11( 4):428-429.
[ 8] Sun H F,Meng Y P,CuiG M,et al.Selection of housekeeping genes for gene expression studies on the development of fruit bearing shoots in Chinese jujube(Zizyphus jujuba Mill.)[J].Molecular Biology Reports,2009,36( 8):2183-2190.
[9]孟玉平,曹秋芬,孙海峰.枣树内参基因ZjH3的克隆与筛选[J].生物技术通报,2010( 11):101-107.
[ 10] Gueta-Dahan Y,Yaniv Z,Zilinskas B A,etal.Saltand oxidative stress:similar and specific responses and their relation to salt tolerance in citrus[J].Planta,1997,203:460-469.
[ 11] Tsugane K,Kobayashi K,Niwam Y,et al.A recessive Arabidopsi s mutant that grows photoautotrophically under salt stress shows enhanced active oxygen detoxification[J].Plant Cell,1999,11:1195-1206.
[ 12] 马长乐,王萍萍,曹子谊,等.盐地碱蓬( Suaede sdlsa)APX基因的克隆及盐胁迫下的表达[J].植物生理与分子生物学学报,2002,28( 4):261-266.
[13]王超,杨传平,王玉成.白桦抗坏血酸过氧化物酶(APX)基因克隆及表达分析 [J].东北林业大学学报,2009,37(3):70-81.
[14]王聪,朱月林,杨立飞,等.NaCl胁迫对菜用大豆抗坏血酸-谷胱甘肽循环的影响 [J].植物营养与肥料学报,2010,16( 5):1209-1216.
[15]李惠华,赖钟雄.植物抗坏血酸过氧化物酶研究进展[J].亚热带植物科学,2006,35( 2):66-69.
