橙皮苷对慢性应激抑郁模型大鼠行为学及HPA轴的影响
2013-04-22蔡莉,李荣,吴清清,吴婷妮
蔡莉,李荣,吴清清,吴婷妮

[摘要] 目的:观察橙皮苷对慢性应激抑郁模型大鼠行为学及下丘脑-垂体-肾上腺(HPA)轴的影响。方法:采用慢性轻度不可预见性应激(CUMS)制备大鼠抑郁模型,60只雄性SD大鼠随机分为正常组、模型组、橙皮苷(40, 80, 160 mg·kg-1)组及阳性药氟西汀(10 mg·kg-1)组。连续灌胃给药3周,糖水偏爱实验和强迫游泳实验测定动物行为学,检测血清皮质酮(CORT)、肾上腺指数、下丘脑促肾上腺皮质激素释放激素(CRF) mRNA以及下丘脑室旁核糖皮质激素受体(GR)蛋白,探讨橙皮苷的抗抑郁作用及机制。结果:与模型组相比,橙皮苷(40, 80, 160 mg·kg-1)治疗组大鼠的糖水消耗量均明显增加、强迫游泳不动时间有不同程度的减少。同时,橙皮苷能逆转CUMS大鼠过高的血清CORT水平和肾上腺指数,并能抑制CUMS大鼠下丘脑CRF mRNA表达、上调室旁核GR蛋白表达。结论:橙皮苷能有效改善CUMS大鼠行为学,表现出抗抑郁作用,其机制可能与调节HPA轴的功能有关。
[关键词] 橙皮苷;慢性轻度不可预见性应激;抗抑郁;下丘脑-垂体-肾上腺轴
抑郁症是一种常见的危害人类身心健康的情感障碍性精神疾病,其患病率预计到2020年将跃升到第2位[1],而从天然植物和中药方剂中寻找安全、高效的抗抑郁药物,已成为抗抑郁研究的重要方向之一[2-3]。橙皮苷为二氢黄酮类化合物,广泛存在于柑桔属植物如橙、柚、桔等,具有抗炎、抗肿瘤、抗氧化、抗风湿等药理作用。研究证实,柑橘类水果的香味能降低强迫游泳实验大鼠不动时间,该作用与调控5-HT和多巴胺的功能密切相关[4-5];从柑橘类植物中分离得到的黄酮类化合物芹菜素,已被证实具有抗抑郁活性[6],提示从柑橘属植物中可能寻找到具有抗抑郁活性的天然化合物;此外,在具有抗抑郁作用的药用植物Byrsonima crassifolia和中药复方香苏散(日本称Koso-san)的有效成分中均含有橙皮苷[7-8],但橙皮苷本身是否具有抗抑郁活性迄今未见报道。本研究采用慢性轻度不可预见性应激(chronic unpredictable mild stress, CUMS)所致抑郁症大鼠为实验模型,观察橙皮苷长期给药对CUMS大鼠行为学的影响,并探讨橙皮苷对下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal, HPA)轴的调节作用,以阐明其可能的抗抑郁作用及内在机制。
1 材料
1.1 动物 雄性SD大鼠,体重(180±20) g,安徽医科大学实验动物中心提供,合格证号皖动准字01号。
1.2 药物与试剂 橙皮苷(纯度>98%)从陈皮中分离、纯化;氟西汀(北京诺华制药有限公司);橙皮苷和氟西汀临用前用0.5%羧甲基纤维素钠溶液配制成相应浓度。皮质酮(corticosterone, CORT) ELISA试剂盒(RapidBio公司);Trizol (Invitrogen公司);逆转录试剂盒(Fermentas公司);SYBR Green PCR Master Mix试剂盒(Applied Biosystems公司);促肾上腺皮质激素释放激素(corticotropin release factor, CRF)引物(上海生物工程技术服务有限公司);糖皮质激素受体(glucocorticoid receptor, GR)兔抗多克隆抗体、SP-9000免疫组化试剂盒(北京中衫金桥生物技术有限公司)。
1.3 仪器 BP211D型电子天平(德国Sartarius公司);MK3型全自动酶标仪(荷兰雷勃公司);ABI Prism 7000型荧光定量PCR仪(美国Applied Biosystems公司);Nikon 80i型荧光显微镜(日本尼康公司)。
2 方法
2.1 动物分组与给药方案 60只大鼠适应饲养1周,随机分为正常组、CUMS模型组、橙皮苷低、中、高剂量组(40,80,160 mg·kg-1)及阳性药氟西汀组(10 mg·kg-1),每组10只。于CUMS造模同时,各组动物灌胃给药,每日1次,连续21 d,正常组及模型组给予同体积的0.5%羧甲基纤维素钠。
2.2 CUMS抑郁模型的建立 正常组每笼5只饲养,无任何刺激,其余组单笼饲养,按下列应激程序制备慢性应激抑郁模型[9]:5 min冷水游泳(8 ℃)、24 h断食断水、24 h倾斜鼠笼(45°)、30 min温水游泳(30 ℃)、潮湿鼠笼过夜、拥挤鼠笼过夜、20 min水平摇晃,以上刺激随机安排,每日1种,同种刺激不能连续出现,连续给予21 d应激,造成大鼠慢性应激抑郁模型。
2.3 糖水偏爱实验 大鼠于实验前24 h被训练适应含糖饮水,在禁食禁水12 h后进行测试,同时给予每只大鼠称量好的1瓶2%蔗糖溶液和1瓶纯水,4 h后测量糖水和纯水消耗量,计算糖水偏爱即糖水消耗量占总液体消耗量的百分比。
2.4 强迫游泳实验 强迫游泳实验在慢性应激3周后进行,将大鼠放于盛有高35 cm水(30 ℃)的透明圆柱形容器(高60 cm,直径30 cm )中被迫游泳。先进行15 min预游泳(预游泳作为应激原对大鼠下次游泳时进入绝望状态起诱导作用),24 h后再进行5 min正式游泳实验,记录大鼠5 min内不动时间。每只大鼠单独测试,按预先设计顺序安排游泳测试,保证各组间测试时间无偏倚。
2.5 血清CORT水平和肾上腺指数的检测 末次实验后,称量大鼠体重并断头处死,收集全血,静置30 min后离心取上清,按ELISA试剂盒说明书检测CORT水平。同时迅速分离并取出大鼠双侧肾上腺组织,称重并计算肾上腺指数=肾上腺质量(mg)/体重(g)×100%。
2.6 实时定量PCR(Q-PCR)检测下丘脑CRF mRNA表达 分离大鼠下丘脑组织,Trizol法提取总RNA并进行逆转录,Q-PCR采用SYBR Green染料法,反应条件: 50 ℃ 2 min; 95 ℃ 10 min; 40个循环(95 ℃ 15 s; 64 ℃ 60 s)。引物序列:CRF sense 5′-CAGAACAACAGTGCGGGCTCA-3′, antisense 5′-AAGGCAGACAGGGCGACAGAG-3′; β-actin sense 5′-TTGCTGACAGGATGCAGAA-3′, antisense 5′-ACCAATCCACACAGAGTACTT-3′。目的基因mRNA的相对表达量根据2-ΔΔCt的公式及方法进行换算。
2.7 免疫组化法检测下丘脑室旁核GR的表达 按免疫组化试剂盒说明书进行,用PBS代替一抗作为阴性对照。具体如下:下丘脑组织石蜡切片常规脱蜡至水,高压抗原修复,3% H2O2灭活内源性酶,山羊血清封闭20 min,滴加一抗后4 ℃过夜,滴加二抗后37 ℃孵育15 min,DAB显色,脱水,透明,封片。采用南京大学捷达公司JD801型病理图像分析系统进行图像分析,每只大鼠选择3张切片进行观察,对每张切片的2个阳性表达区域分别计算所有染色的平均吸光度,以3张切片的均值进行半定量分析。
2.8 统计学方法 采用SPSS 11.5软件进行分析,数据结果以±s表示,组间比较采用One-Way ANOVA检验,P<0.05表示差异有统计学意义。
3 结果
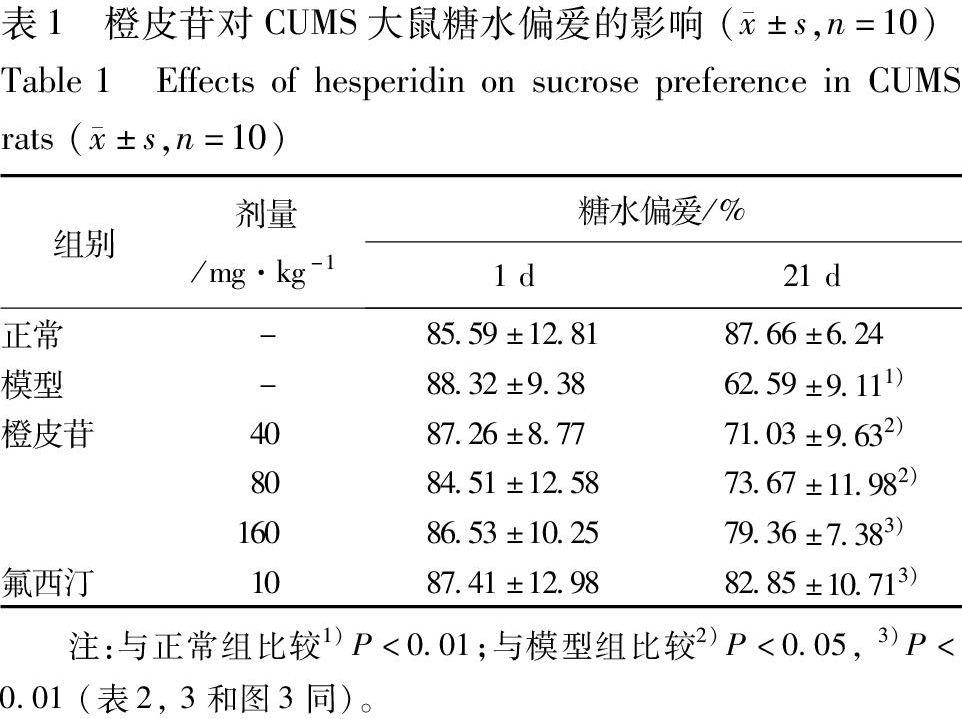
3.1 橙皮苷对CUMS大鼠糖水消耗量的影响 分别在应激第1天和第21天测定大鼠糖水偏爱,结果见表1。在第1天,各组大鼠的糖水偏好并无显著性差异。在第21天,与正常组比较,经长期慢性应激后,模型组大鼠的糖水偏爱显著性降低;与模型组相比,CUMS大鼠给予橙皮苷3周后,各剂量橙皮苷均能明显提高CUMS大鼠低下的糖水偏爱水平;阳性对照药氟西汀也能显著提高CUMS大鼠的糖水偏爱。
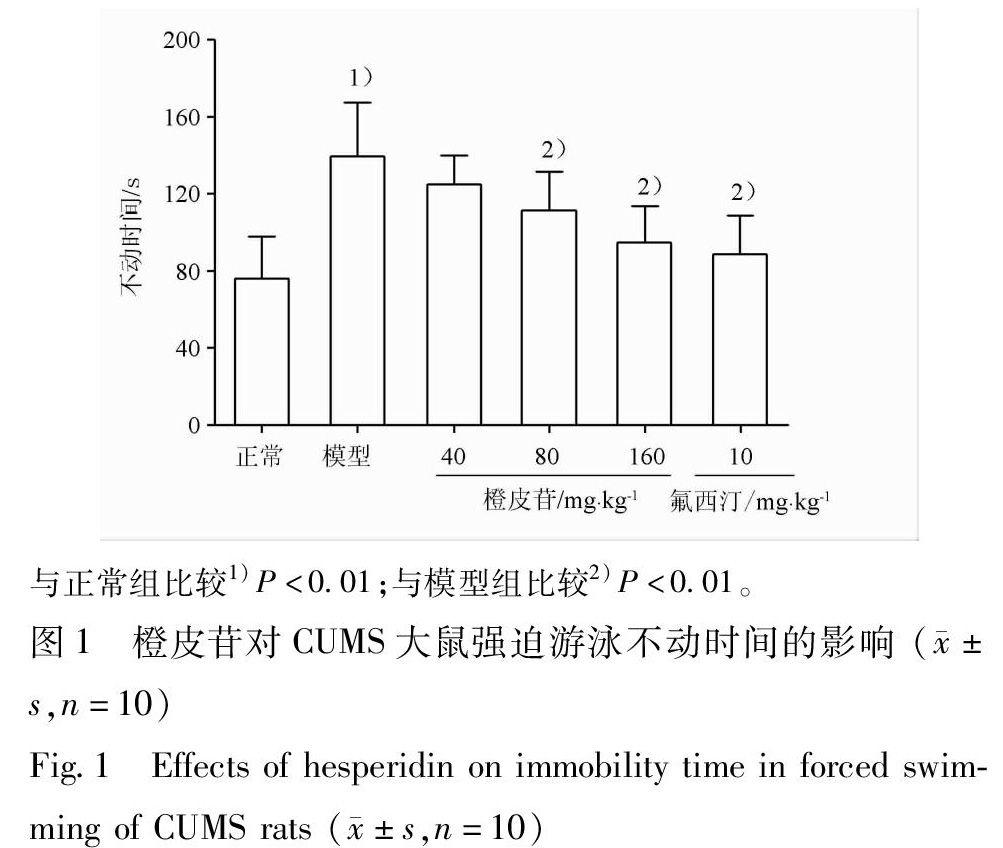
3.2 橙皮苷对CUMS大鼠强迫游泳不动时间的影响 在强迫游泳实验中,与正常组比较,长期慢性应激能延长模型组大鼠强迫游泳不动时间,并具有显著性差异。与模型组比较,橙皮苷(80,160 mg·kg-1)灌胃给药能显著降低CUMS大鼠不动时间(P<0.01),氟西汀组大鼠的不动时间也明显少于模型组大鼠,见图1。
3.3 橙皮苷对CUMS大鼠CORT血清浓度的影响 与正常组比较,模型组大鼠血清CORT含量明显升高(P<0.01);与模型组比较,橙皮苷能剂量依赖性地降低CUMS大鼠血清中CORT的水平,阳性对照药氟西汀也产生同样的抑制作用,并且橙皮苷(80,160 mg·kg-1)组和氟西汀组有显著性差异,见表2。
3.4 橙皮苷对CUMS大鼠肾上腺指数的影响 与正常组相比,模型组大鼠的肾上腺指数显著性升高。与模型组比较,橙皮苷(160 mg·kg-1)对CUMS大鼠过高的肾上腺指数具有明显的抑制作用,氟西汀也表现出显著的抑制作用,见图2。
3.5 橙皮苷对CUMS大鼠下丘脑CRF mRNA表达水平的影响 Q-PCR结果表明,与正常组比较,模型组大鼠下丘脑CRF mRNA表达明显增多;与模型组比较,CUMS大鼠经橙皮苷和氟西汀治疗后,其下丘脑CRF mRNA表达水平有不同程度的降低,橙皮苷(80,160 mg·kg-1) 组和氟西汀组有显著性差异,见图3。
3.6 橙皮苷对CUMS大鼠下丘脑室旁核GR蛋白表达的影响 免疫组化法检测大鼠下丘脑室旁核GR蛋白表达情况,光镜下可见GR阳性细胞的胞核出现棕黄色颗粒,各组切片可见不同数目和强度的GR染色阳性表达细胞。半定量分析结果表明,与正常组比较,模型组大鼠下丘脑室旁核GR蛋白表达显著减少。与模型组相比,橙皮苷(80,160 mg·kg-1)和氟西汀(10 mg·kg-1)均可以显著增加CUMS大鼠下丘脑室旁核GR蛋白的表达,见表3。
4 讨论
抑郁症患者的临床症状表现为活动力下降、兴趣丧失及食欲降低等。CUMS抑郁模型通过随机给予不同的低强度应激因子长期刺激动物,模拟人类慢性低水平应激源导致的抑郁症,该模型与抑郁症患者的临床表现有一定程度的相似性,被广泛用于抗抑郁药的活性筛选和发病机制的探讨[10]。行为学实验在评价药物是否具有抗抑郁活性方面发挥重要作用。本研究表明,CUMS模型组大鼠的糖水偏爱明显下降,糖水偏爱降低是衡量快感缺乏的有效客观指标[11],与抑郁症患者兴趣减低的症状相似,给予橙皮苷治疗后能明显增加CUMS大鼠的糖水偏爱。强迫游泳实验通过观察动物在不可逃避性应激状态下,因绝望致不动时间的改变反映药物的抗抑郁效应[12]。本研究发现CUMS模型组大鼠强迫游泳的不动时间显著增加,长期给予橙皮苷干预后,能减少CUMS大鼠的强迫游泳实验不动时间。上述行为学研究结果表明,橙皮苷对CUMS抑郁模型大鼠具有一定的治疗作用。
应激刺激引起机体产生一系列相应的生理和行为改变,即“应激反应”。应激反应最重要的特征是HPA轴活化及由此产生的糖皮质激素(动物表现为CORT)大量释放[13]。重复的HPA轴异常激活与抑郁症的发生、发展密切相关,有研究表明抑郁症患者血浆皮质醇水平显著升高、脑垂体和肾上腺明显肥大[14]。本研究发现,作为评价CUMS对HPA轴功能影响的重要指标,模型组大鼠血清CORT浓度显著升高、肾上腺指数明显上升,而CUMS大鼠经橙皮苷长期给药治疗后,橙皮苷治疗组大鼠的血清CORT和肾上腺指数均出现不同程度的翻转,与CUMS大鼠抑郁行为的改善同步。
作为HPA轴活性调节的起点,CRF是HPA轴的关键中枢驱动力,在应激反应中起重要作用[15]。来自下丘脑的CRF刺激腺垂体释放促肾上腺皮质激素(adrenocorticotrophic hormone, ACTH),促使肾上腺分泌糖皮质激素。生理情况下,过度升高的糖皮质激素通过负反馈调节抑制ACTH,CRF的合成,维持糖皮质激素相对稳定和适度的应激反应。糖皮质激素的负反馈调节由糖皮质激素受体GR介导实现,GR结合配体后进入胞核,特异性结合CRF基因启动子内的负性糖皮质激素反应元件(nGRE),抑制下丘脑CRF的基因表达[16]。研究证实,抑郁症患者下丘脑GR的活性和对配体的敏感性均降低,存在明显的HPA轴负反馈调节机制受损现象,最终引起HPA轴超敏[17]。在本研究中,模型组大鼠下丘脑CRF mRNA表达显著升高、下丘脑室旁核GR蛋白表达明显下降,表明模型组大鼠存在CRF功能亢进、GR功能低下,橙皮苷灌胃给药对CUMS大鼠下丘脑CRF mRNA及GR蛋白的异常表达均有一定的改善作用,表明橙皮苷可以通过增加下丘脑室旁核GR的表达,恢复糖皮质激素的负反馈调节作用,下调异常活化的下丘脑CRF的功能,进而维持HPA轴的稳态。
综上所述,橙皮苷能够有效改善CUMS模型大鼠的抑郁样行为,具有抗抑郁作用,其可能机制为抑制CUMS大鼠HPA轴的亢进、调节HPA轴的功能状态。
[参考文献]
[1] 郭秋平, 高英, 李卫民. 百合皂苷对抑郁模型大鼠HPA轴的影响[J]. 中国药理学报, 2010, 26(5): 699.
[2] Zhang Z J. Therapeutic effects of herbal extracts and constituents in animal models of psychiatric disorders[J]. Life Sci, 2004, 75(14): 1659.
[3] Kawabata K, Kawai Y, Terao J. Suppressive effect of quercetin on acute stress-induced hypothalamic-pituitary-adrenal axis response in Wistar rats[J]. J Nutr Biochem, 2010, 21(5): 374.
[4] Komori T, Fujiwara R, Tanida M, et al. Potential antidepressant effects of lemon odor in rats[J]. Eur Neuropsychopharmacol, 1995, 5(4): 477.
[5] Komiya M, Takeuchi T, Harada E. Lemon oil vapor causes an anti-stress effect via modulating the 5-HT and DA activities in mice[J]. Behav Brain Res, 2006, 172(2): 240.
[6] Yi L T, Li J M, Li Y C, et al. Antidepressant-like behavioral and neurochemical effects of the citrus-associated chemical apigenin[J]. Life Sci, 2008, 82(13/14): 741.
[7] Herrera-Ruiz M, Zamilpa A, Gonzalez-Cortazar M, et al. Antidepressant effect and pharmacological evaluation of standardized extract of flavonoids from Byrsonima crassifolia[J]. Phytomedicine, 2011, 18(14): 1255.
[8] Ito N, Nagai T, Yabe T, et al. Antidepressant-like activity of a Kampo (Japanese herbal) medicine, Koso-san (Xiang-Su-San), and its mode of action via the hypothalamic-pituitary-adrenal axis[J]. Phytomedicine, 2006, 13(9/10): 658.
[9] Chen X N, Meng Q Y, Bao A M, et al. The involvement of retinoic acid receptor-alpha in corticotropin-releasing hormone gene expression and affective disorders[J]. Biol Psychiatry, 2009, 66(9): 832.
[10] Yang D, Li Q, Fang L, et al. Reduced neurogenesis and pre-synaptic dysfunction in the olfactory bulb of a rat model of depression[J]. Neuroscience, 2011, 192: 609.
[11] Guo J Y, Li C Y, Ruan Y P, et al. Chronic treatment with celecoxib reverses chronic unpredictable stress-induced depressive-like behavior via reducing cyclooxygenase-2 expression in rat brain[J]. Eur J Pharmacol, 2009, 612(1/3): 54.
[12] Detke M J, Johnson J, Lucki I. Acute and chronic antidepressant drug treatment in the rat forced swimming test model of depression[J]. Exp Clin Psychopharmacol, 1997, 5(2): 107.
[13] 刘丽琴, 罗艳, 张瑞睿, 等. 人参皂苷对慢性应激抑郁模型大鼠行为学及HPA轴、BDNF的影响[J]. 中国中药杂志, 2011, 36(10): 1342.
[14] Swaab D F, Bao A M, Lucassen P J. The stress system in the human brain in depression and neurodegeneration[J]. Ageing Res Rev, 2005, 4(2): 141.
[15] Binder E B, Nemeroff C B. The CRF system, stress, depression and anxiety-insights from human genetic studies[J]. Mol Psychiatry, 2010, 15(6): 574.
[16] Bali B, Ferenczi S, Kovacs K J. Direct inhibitory effect of glucocorticoids on corticotrophin-releasing hormone gene expression in neurones of the paraventricular nucleus in rat hypothalamic organotypic cultures[J]. J Neuroendocrinol, 2008, 20(9): 1045.
[17] Adcock I M, Barnes P J. Molecular mechanisms of corticosteroid resistance[J]. Chest, 2008, 134(2): 394.
Effect of hesperidin on behavior and HPA axis of rat model of
chronic stress-induced depression
CAI Li1, LI Rong2*, WU Qing-qing2, WU Ting-ni2
(1. Department of Pathology, Anhui Medical University, Hefei 230032, China;
2. College of Pharmacy, Anhui Medical University, Hefei 230032, China)
[Abstract] Objective: To observe the effect of hesperidin on behavior and hypothalamic-pituitary-adrenal (HPA) axis of rat model of chronic stress-induced depression. Method: Chronic unpredictable mild stress (CUMS) was used to establish the rat depression model. Sixty male SD rats were divided randomly into six groups: the normal group, the model group, the hesperidin (40, 80, 160 mg·kg-1) group and the positive fluoxetine (10 mg·kg-1) group. They were orally administered with drugs for three weeks. The sucrose preference test and the forced swimming test (FST) were assayed to detect animal behavior. The levels of corticosterone (CORT) in serum, mRNA of corticotropin release factor (CRF) in hypothalamus as well as protein expression of glucocorticoid receptor (GR) in paraventricular nucleus (PVN) were determined to clarify the anti-depression effect and mechanism of hesperidin. Result: Compared with the model group, rats in the hesperidin (40, 80, 160 mg·kg-1) treatment group showed significant increase in the sucrose consumption and decrease in the immobility time in FST to varying degrees. Meanwhile, the excessively high serum CORT and adrenal index of CUMS rats were reversed by treatment with hesperidin. In addition, hesperidin inhibited CRF mRNA expression in hypothalamus and up-regulated GR protein expression in PVN among CUMS rats. Conclusion: Hesperidin could effectively improve the behavior of CUMS rats and show the anti-depression effet. Its mechanisms may be related to the function of regulating HPA axis.
[Key words] hesperidin; chronic unpredictable mild stress; antidepressant; hypothalamic-pituitary-adrenal axis
doi:10.4268/cjcmm20130217
[责任编辑 张宁宁]
