原儿茶酸衍生物的合成及活性研究
2013-04-22李取胜,王伟,韩秋俊,王鹏龙,李强,雷海民
李取胜,王伟,韩秋俊,王鹏龙,李强,雷海民


[摘要] 目的:探讨原儿茶酸(protocatechuic acid,PCA)及其衍生物体外清除DPPH自由基活性及对鸡胚绒毛尿囊膜(chick chorioallantoic membrane, CAM)血管新生的影响。方法:利用苄基保护及苄酯水解等相关反应,得到PCA系列衍生物PCA-1,PCA-2,PCA-3,结构经1H,13C-NMR及MS验证,并采用DPPH自由基体外抗氧模型、CAM对PCA及其衍生物的活性进行筛选。 结果:PCA及含有邻二酚羟基的PCA-1的体外清除DPPH自由基活性较强;PCA,PCA-3对新生血管有一定的抑制作用,而PCA-2则能促进血管的新生(P<0.001)。结论:PCA分子结构中的邻二酚羟基为体外清除DPPH自由基的活性部位;不含邻二酚羟基,同时有羧基时能增强其促血管新生活性,但需要进一步的实验验证。
[关键词] 原儿茶酸;衍生物;DPPH自由基;鸡胚绒毛尿囊膜;生物活性
水溶性酚酸类成分原儿茶酸(protocatechuic acid,PCA)广泛存在于老鹳草、丹参等常见中药[1-2]以及复方丹参注射液、冠心宁注射液[3-4]等经典复方制剂。不仅具有显著降低心肌耗氧量,提高心肌耐氧能力,减慢心率[5]等药理作用,而且大量文献报道其具有确切的体外抗氧化活性[6-8],但并没有通过实验的方法寻找其抗氧化活性的位点的报道。本实验采用苄基保护与苄酯水解的方法对PCA进行结构修饰,并选取体外清除DPPH自由基模型及鸡胚绒毛尿囊膜(chick chorioallantoic membrane, CAM)模型来研究PCA及其衍生物的体外抗氧化活性及对血管新生作用的影响,并探索PCA相关活性的活性位点。
1 材料
双线恒温加热磁力搅拌器SH-3A(北京金紫光科技发展有限公司),RE-52A旋转蒸发仪(上海亚荣生化仪器厂),分析天平(德国赛多利斯公司),LC-MS 2020(Shimadzu公司),Avance 500型核磁共振仪(F llanden, Switzerland),X-5显微熔点测定仪(北京泰克仪器有限公司),酶标仪specta Max190(美国Molecular Devices),PH计(梅特勒-托利多仪器有限公司),96孔板(美国Costar公司),鸡胚孵化箱(北京方通孵化器厂),显微镜(日本Olympus公司320040型),CJT型超净工作台(北京长城空气净化工程公司)。
原儿茶酸(南京泽郎医药科技);氯化苄、Vit C(北京化工厂);DPPH、叔丁基对苯二酚(TBHQ, 阿拉丁试剂);二甲基亚砜(DMSO,Amresco公司);鸡胚(北京梅里亚维通实验动物技术有限公司);吸附性明胶海绵(南京金陵制药)。
2 方法与结果
2.1 PCA衍生物的合成设计
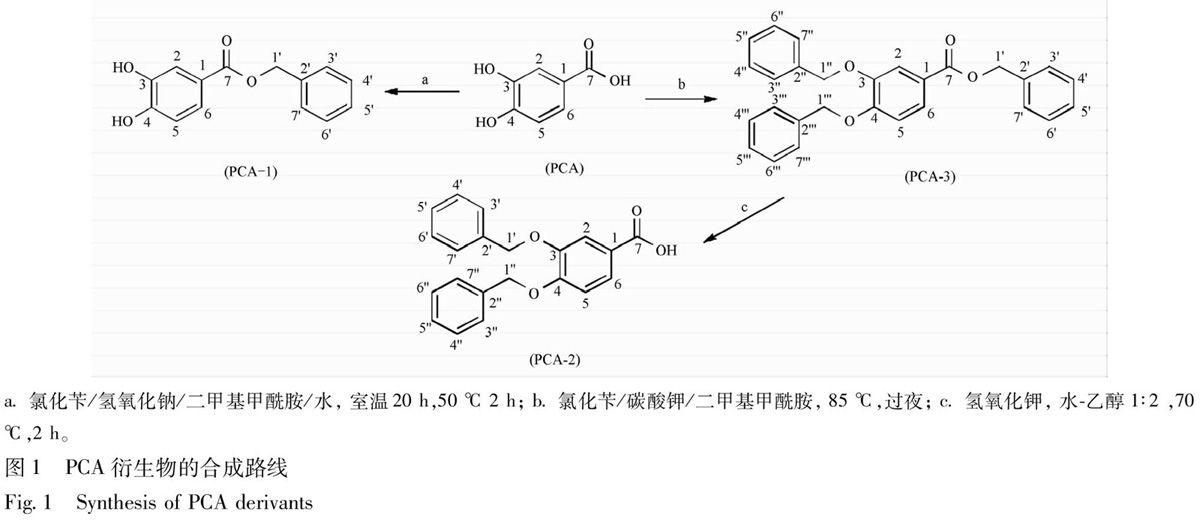
PCA结构中含有邻二酚羟基、羧基,要确定体外抗氧化活性位点,必须对其官能团进行选择性保护。苄基保护常被用于有机合成反应中,易与羧基、羟基选择性结合,尤其在邻二酚羟基保护中应用较多[9-11],且苄基本身没有其他官能团,故从实验操作简单角度选择将PCA与溴化苄反应,分别得其衍生物PCA-1, PCA-2和PCA-3,主要设计路线及方法见图1。
2.2 PCA衍生物的合成
2.2.1 化合物PCA-1的合成 取2.46 g PCA,溶解在20 mL干燥的二甲基甲酰胺(DMF)中,0.64 g氢氧化钠溶于4 mL水并逐滴加入到DMF,混合液在冰浴下逐滴加入氯化苄1.85 mL,继续搅拌20 min。室温下搅拌20 h,升温到50 ℃搅拌2 h。乙酸乙酯萃取3次,有机层依次水洗、饱和碳酸氢钠洗、饱和氯化钠洗,无水硫酸镁干燥,过滤,回收乙酸乙酯得棕色固体,甲苯反复洗涤并干燥得到白色固体1.26 g,收率43%。mp 147~148 ℃。LC-MS m/z
a. 氯化苄/氢氧化钠/二甲基甲酰胺/水, 室温20 h,50 ℃ 2 h; b. 氯化苄/碳酸钾/二甲基甲酰胺, 85 ℃,过夜; c. 氢氧化钾, 水-乙醇 1∶2 ,70 ℃,2 h。
图1 PCA衍生物的合成路线
Fig.1 Synthesis of PCA derivants
245.1 [M+H]+;1H-NMR(DMSO-d6,500 Hz)δ: 5.28(2H,s,1′-CH2-),6.83(1H,d,J=8.0 Hz,H-5),7.34~7.45(7H,m,Ar-H),9.40(1H,s,4-OH),9.81(1H,s,3-OH);13C-NMR(DMSO-d6,125 Hz)δ: 165.9(C-7),151.1(C-4),145.6(C-3),137.0(C-2′),129.0(C-4′,6′),128.5(C-5′),128.4(C-3′,7′),122.4(C-1),120.9(C-6),116.8(C-5),115.9(C-2),66.1(C-1′),与文献[12]相当。
2.2.2 化合物PCA-3的合成 取1 g PCA溶于20 mL干燥DMF中,搅拌下加入2.96 g干燥的碳酸钾,室温下逐滴加入2.98 mL氯化苄并持续搅拌10 min,之后在氮气保护下85 ℃搅拌过夜。反应结束冷却至室温,加100 mL水,用氯仿萃取3次(3×100 mL)。合并有机层,依次水洗、饱和氯化钠洗,无水硫酸钠干燥,过滤,回收氯仿得到油状物。将油状物通过硅胶柱,石油醚-丙酮(10∶1)为洗脱液,得到2.3 g白色固体,收率83.6%。mp 66~68 ℃;LC-MS m/z 425.2 [M+H]+;1H-NMR(CDCl3,500 Hz)δ: 5.23(2H,s,1″-CH2-),5.26(2H,s,1-CH2-),5.35(2H,s,1′-CH2-),6.95(1H,d,J=9.0 Hz,H-5),7.35~7.51(15H,m,Ar-H),7.70~7.71(2H,m,H-2,6);13C-NMR(CDCl3,125 Hz)δ: 166.1(C-7),153.0(C-4),148.3(C-3),136.8(C-2),136.5(C-2″),136.3(C-2′),128.7(C-4,6),128.6(C-4″,6″),128.5(C-4′,6′),128.2(C-5),128.1(C-5″),128.0(C-5′),127.9(C-3,7),127.4(C-3″,7″),127.2(C-3′,7′),124.1(C-1),123.0(C-6),115.5(C-2),113.2(C-5),71.2(C-1),70.8(C-1″),66.6(C-1′)。与文献[13]一致。
2.2.3 化合物PCA-2的合成 取1.5 g(3.53 mmol)化合物PCA-3于50 mL圆底烧瓶中,加入20 mL乙醇,取1 g(17.85 mmol)氢氧化钾溶于10 mL水中,慢慢加入烧瓶,反应液在70 ℃搅拌至反应液呈均一状态。蒸去反应液中过量乙醇,加100 mL水,冷却至室温。逐滴加入4 mol·L-1盐酸酸化至不再产生白色沉淀为止(pH 3~4),过滤,水洗,抽滤至干燥,得1.0 g白色固体,收率84.8%。mp 187~188 ℃;LC-MS m/z 335.2 [M+H]+;1H-NMR(DMSO-d6,500 Hz)δ: 5.18(2H,s,1″-CH2-),5.23(2H,s,1′-CH2-),7.16(1H,d,J=9.0Hz,H-5),7.31~7.47(10H,m,Ar-H),7.56~7.53(2H,m,H-2,6),12.3(1H,br s,-COOH);13C-NMR(DMSO-d6,125 Hz)δ: 167.5(C-7),152.5(C-4),148.0(C-3),137.5(C-2″),137.2(C-2′),129.0(C-4″,6″),128.9(C-4′,6′),128.4(C-5″),128.3(C-5′),128.0(C-3″,7″),127.9(C-3′,7′),124.0(C-6),123.7(C-1),115.0(C-2),113.5(C-5),70.4(C-1″),70.3(C-1′)。与文献[13-14]相当。
2.3 活性筛选
2.3.1 体外清除DPPH自由基活性筛选[15-18] 于DMSO中将Vit C,TBHQ,PCA及其衍生物PCA-1,PCA-2和PCA-3配制成质量浓度为10.0 g·L-1的溶液,其中Vit C,TBHQ为阳性对照药物;通过DPPH自由基清除实验对上述化合物进行筛选,以确定PCA体外抗氧化活性的作用位点。
在96孔板中,每个样品重复3次,待样品和95%乙醇全部加完后,再加入0.1 mmol·L-1 DPPH的95%乙醇溶液,室温下避光反应20 min,在517 nm处测定吸光度A;DPPH自由基清除率=[1-(As-A0)/Ac] ×100%。其中,样品组(As):20 μL样品+180 μL DPPH自由基溶液;对照组(Ac):20 μL DMSO +180 μL DPPH自由基溶液;空白组(A0):20 μL样品+180 μL 95%乙醇。
2.3.2 对CAM模型的作用 参照文献[19-20],在无菌环境下给药组加入PCA,PCA-1,PCA-2和PCA-3,给药剂量为30 μg/鸡胚;空白组加生理盐水。采用Image-Pro Plus5.0软件计数由载体辐射新生血管(直径<100 μm)数目。
2.4 结果
2.4.1 清除DPPH自由基活性结果 当样品在反应体系中质量浓度为1 g·L-1时,以Vit C,TBHQ为阳性对照,PCA及其衍生物对DPPH自由基清除率见表1。
2.4.2 CAM模型筛选结果 加药72 h后在解剖显微镜下观察给药组与空白组的CAM新生血管生长情况,发现给药组PCA-2中新生毛细血管从载体边缘辐射状发出,其数目与空白组相比有所增多,其他几组则不显著。说明衍生物PCA-2对CAM新生血管有显著性促进作用,见表2。
3 讨论及结论
在PCA衍生物的合成过程中,均是参照文献的操作来进行,但是PCA-1的产率(43%)与文献[12]较高的产率(>80%)有较大差距,分析原因是碱水加入的速度对反应的影响较大,速度越快,酚羟基也会被活化,副产物就会增多,所以加入碱水速度较慢时能提高反应产率。同时,可考虑采用较弱的碱,如碳酸氢钠、碳酸钾等。PCA-3的合成也可采用溴化苄,其反应速率在常温时就比较快,但其相对氯化苄价格较贵。故采用氯化苄时,为提高反应速率可提高温度或者在反应液中加入碘化钾。PCA-2由PCA-3水解得到,属常规反应。
抗氧化实验结果得出在体系质量浓度为1 g·L-1时,比较PCA,PCA-1,PCA-2,PCA-3对DPPH自由基清除作用, 初步验证了PCA体外清除DPPH自由基的活性位点为分子中邻二酚羟基。
对于血管新生实验,在药物浓度为30 μg/鸡胚时,PCA与PCA-3对血管新生有一定的抑制作用,但相对于空白组P>0.05(PCA: P=0.373;PCA-1: P=0.593;PCA-3: P= 0.063),组间差别不大。而PCA-2的新生血管数目为10.75±3.19,相对空白组P<0.001,说明衍生物PCA-2能促进血管的新生。比较上述衍生物的结构,可推测在PCA结构中不含邻二酚羟基,同时存在羧基时有促血管新生活性,但这需要进一步验证。
本实验采用苄基保护的方法,对PCA的不同位点进行修饰,得其衍生物,该合成方法成熟,易操作。并采用DPPH自由基体外抗氧模型、CAM模型对PCA及其衍生物的活性进行筛选,为酚酸类或具有类似结构的化合物的结构修饰与相关活性研究提供了一定的参考。
[参考文献]
[1] 张善玉,姜艳玲,朴惠顺,等. HPLC测定老鹳草中的原儿茶酸[J]. 华西药学杂志, 2007, 22(4): 453.
[2] 芮建中,邹汉法,袁倚盛,等. 毛细管电泳法分离丹参水溶性有效成分——丹参素、原儿茶醛和原儿茶酸[J].中草药,2000, 31(5): 337.
