甘草黄酮对大强度耐力运动大鼠肾脏组织Ca2+、Mg2+-ATPase及Bax,Bc1-2蛋白表达的影响
2013-04-19王东旭陈艳艳
王东旭,陈艳艳
甘草黄酮对大强度耐力运动大鼠肾脏组织Ca2+、Mg2+-ATPase及Bax,Bc1-2蛋白表达的影响
王东旭1,陈艳艳2
1. 塔里木大学体育工作部,新疆 阿拉尔,843300;2. 西北大学体育部,陕西 西安,710069。
目的:探讨甘草黄酮对大强度耐力运动大鼠肾脏组织Ca2+、Mg2+-ATPase及Bax、Bcl-2表达的影响。方法:选取SD雄性健康大鼠24只,随机分为安静组、大强度运动组和运动加药组;采用跑台训练6周后取材,应用试剂盒和免疫组织化学法测检测各组大鼠肾脏组织Ca2+、Mg2+-TPase活性及Bax和Bcl-2表达的变化。结果:与安静对照组相比,大强度运动组和运动加药组肾脏组织Ca2+、Mg2+-TPase活性均呈非常显著性下降(P<0.01);其中运动加药组Ca2+、Mg2+-TPase活性均较大强度运动组具有非常显著差异性提高(P<0.01);大强度耐力运动组和运动加药组大鼠细胞凋亡指数AI均有不同程度增加;大强度运动组Bax、Bcl-2蛋白表达(MOD)均呈非常显著差异性(P<0.01),运动加药组Bax蛋白表达(MOD)均呈非常显著差异性(P<0.01);运动加药组Bcl-2蛋白表达(MOD)与大强度运动组具有非常显著差异性(P<0.01);大强度运动组和运动加药组Bax/Bcl-2比值分布呈不同程度的显著差异性(P<0.05,P<0.01)。结论:甘草黄酮能够增强对大强度运动大鼠抗氧化能力,降低肾脏组织自由基的产生,抑制组织细胞的凋亡。
甘草黄酮;大强度耐力训练;肾脏;ATP;Bax;Bcl-2
随着竞技体育的迅猛发展,运动训练强度和量以及竞赛周期的增多,探索和利用运动营养补剂,减轻或消除运动疲劳、增强运动技能一直是运动训练学和营养学领域研究的热点之一。甘草黄酮(glycyrrhiza flavonoids,FG)是从甘草提取物中得到的一类生物活性较强的成分,现代中药学研究表明[1,2],甘草黄酮具有抗肿瘤,抗氧化,抗病原微生物作用、解毒、抗炎、抗病毒、增强免疫机能等作用。众多研究表明[3-5],急性、大强度运动及过度训练将引起肾脏缺血再灌注,诱导肾脏细胞凋亡增加,也可能是造成运动性疲劳和运动性蛋白尿发生的原因之一。目前关于中药补剂对大强度耐力运动肾脏组织的影响报道尚无。本实验通过建立大强度耐力运动大鼠模型和补充甘草黄酮的实验手段,采用透射电镜和生化检测等手段观察和分析了甘草黄酮对大鼠肾脏组织Ca2+、Mg2+-ATPase及Bax、Bal-2表达的影响,为进一步研究运动营养补剂对机体肾脏的保护机制提供理论依据。
1 材料与方法
1.1 实验动物及其分组
Sprague-Dawley(SD)雄性健康大鼠36只,体重180-220g,由西安交通大学医学院实验动物中心提供。国家标准啮齿类动物干燥饲料喂养,自由饮食,动物室湿度23℃±5℃,相对湿度40%-70%,分笼饲养备用。
1.2 实验模型建立
实验动物适应性饲养7d后,以以15 m/min、5min/d运动量对动物进行为期3 d的筛选,淘汰个别不适应跑台训练者。选取其中大鼠24只随机分为安静对照组、大强度运动对照组和运动加药组,每组8只。甘草黄酮购自西安天一生物制品公司,棕黄色粉末,其中总黄酮糖苷含量为75%。加药组采用甘草黄酮溶于蒸馏水溶液中,灌胃加药,用量为300mg/kg/d,其它组采用灌服同等量的蒸馏水作为对照。每天训练前以15 m/min的速度做适应运动5min后正式训练,训练模型基于Bedford模型结合实际略加调整,共为期6w(见表1)。
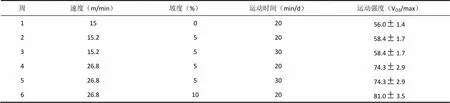
表1 实验动物运动方案
运动力竭判定标准为:动物跟不上预定速度,大鼠臀部压在笼具后壁,后肢随转动皮带后拖达30s,毛刷刺激驱赶无效。行为特征为呼吸深急、幅度大,神情疲倦,俯卧位,垂头,刺激后无反应。
1.3 动物的处死、取材及样品制备方法
1.3.1 动物处死与取材 组织匀浆的制备:第6周训练最后一天,用乙醚麻醉后,断头处死,取肾脏组织置于预冷的生理盐水中洗净血污后,称取适量组织(0.2-1g)按W(g)组织块重量/V(ml)匀浆介质为1/9的比例加取预冷的匀浆介质(0.8%的NaCL溶液)于烧杯中,用眼科小剪刀尽快剪碎组织块(以上操作均在冰水裕中进行)。手工制备匀浆后,3 000转/min低温离心15min,分离提取上清液4℃冰箱冷藏。
1.3.2 相关指标的检测 肾脏组织Ca2+、Mg2+-ATPase指标应用ATPase试剂盒测定,试剂盒由南京建成生物工程研究生提供。细胞凋亡采用TUNEL检测法,试剂盒购自武汉博士德生物工程有限公司,严格按照说明书操作;蛋白Bax、Bcl-2表达应用免疫组织化学法检测,检测试剂盒由武汉博士德生物工程有限公司提供,操作完全按试剂盒附带说明进行。
1.4 统计学处理
2 结果与分析
2.1 甘草黄酮对大强度运动大鼠肾脏组织Ca2+、Mg2+-TPase的影响
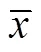
The kidneys of Ca2+, Mg2+-ATP expression in each group on rats

组别nCa2+-ATPaseMg2+-ATPase 安静对照组大强度运动组运动加药组8883.790.142.480.20**3.320.15**##3.680.162.400.19**3.260.16**##
**与安静对照组相比较P<0.01;##与大强度运动组比较P<0.01
Compared with th quiet group at the same time, ##P<0.01
Compared with the high-intensity group at the same time, ##P<0.01.
由表2可知,经6周大强度耐力运动,大强度运动组和运动加药组肾脏组织Ca2+、Mg2+-TPase活性均呈非常显著性下降(P<0.01);其中运动加药组Ca2+、Mg2+-TPase活性均较大强度运动组具有非常显著差异性提高(P<0.01)。
2.2 甘草黄酮对大强度运动大鼠肾脏组织细胞凋亡及Bax、Bcl-2表达的影响
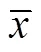
Expression of Bax,Bcl-2 protein expression on nephridial tissue in different groups

组别nAIBaxBcl-2Bax/ Bcl-2 安静对照组大强度运动组运动加药组8882.29±0.182.84±0.632.49±0.760.29±0.060.60±0.15**0.44±0.08**0.56±0.080.84±0.07**0.63±0.06##0.51±0.040.70±0.13*0.70±0.12**
*与安静对照组相比较P<0.05;**与安静对照组相比较P<0.01。##与大强度运动组比较P<0.01。
Compared with th quiet group at the same time, *P<0.05;**P<0.01. compared with the high-intensity group at the same time, ##P<0.01.
由表3可知,与安静对照组相比,大强度耐力运动组和运动加药组大鼠细胞凋亡指数AI均有不同程度增加;与安静对照组相比,大强度运动组Bax、Bcl-2蛋白表达的阳性细胞平均光密度值(MOD)均呈非常显著差异性(P<0.01),运动加药组Bax蛋白表达的阳性细胞平均光密度值(MOD)均呈非常显著差异性(P<0.01);运动加药组Bcl-2蛋白表达MOD与大强度运动组具有非常显著差异性(P<0.01);与安静对照组相比,大强度运动组和运动加药组Bax/ Bcl-2比值分别呈不同程度的显著差异性(P<0.05,P<0.01)。
3 讨论
3.1 甘草黄酮对大强度运动大鼠肾脏组织Ca2+、Mg2+-ATPase活性的影响
研究表明[6,7],ATPase存在于组织细胞及细胞器的膜上,是生物膜上的一种蛋白酶,它在物质运送、能量转换以及信息传递方面具有重要的作用,ATPase活力的大小是各种细胞能量代谢及功能有无损伤的重要指标。线粒体是细胞呼吸的重要器官,是细胞内重要的钙储存库,线粒体Ca2+-ATPase水解活性反映线粒体摄入Ca2+的能力,酶活性越大,单位时间内线粒体通过Ca2+-ATPase摄入的Ca2+量越多[8,9]。研究表明[10],镁离子(Mg2+)是线粒体中许多重要酶的辅助因子,在糖、脂肪、蛋白质代谢中发挥着至关重要的作用;Mg2+激活磷酸酶,使得ATP在内的有机磷酸基团水解、转移和反应,在能量的产生、转移、储存和利用中发挥着必不可少的作用。有关报道[11,12],细胞内游离Ca2+浓度可能主要依靠细胞内Mg2+浓度的变化调节,Mg2+的这一调节功能主要是通过肌浆网实现,Mg2+可以与Ca2+竞争肌质网Ca2+释放通道的活性位点。细胞内Mg2+浓度下降可使肌浆网释放Ca2+增多,细胞内Ca2+浓度增加,另外,胞内Mg2+还能抑制线粒体的Ca2+摄取,防止过多Ca2+进入线粒体造成损失[13]。研究报道[14],甘草中黄酮类成分对能引起生物组织膜因产生过氧化作用而导致结构和功能损伤的超氧阴离子(O-2·)和羟自由基(OH·)等自由基有明显的清除作用,从而起到对生物组织的保护作用。甘草中黄酮类成分普遍具有抗氧化活性,可以作为自由基清除剂[15]。
从本实验检测结果可知,与安静对照组相比,大强度运动组和运动加药组肾脏组织Ca2+、Mg2+-ATPase活性均呈非常显著性下降(P<0.01);其中运动加药组Ca2+、Mg2+-ATPase活性均较大强度运动组具有非常显著差异性提高(P<0.01);由此可见,甘草黄酮补剂对大强度耐力运动所引起的Ca2+、Mg2+-ATPase活性下降具有显著的抑制作用。分析认为,说明甘草黄酮可以有效地改善因长时间大强度耐力运动导致的Ca2+内流,减少线粒体Ca2+聚集,保证Ca2+的正常转运功能,维持线粒体和细胞内钙稳定,增加ATP的产生和保护细胞膜的完整性,从而保证细胞内的能量代谢,以及兴奋-收缩偶联和维持细胞膜的完整性等生命活动。提示甘草黄酮能有效提高Ca2+、Mg2+-ATPase的活性,从而保护器官各组织和提供机体能量,防止和延缓机体疲劳。
3.2 甘草黄酮对大强度运动大鼠肾脏组织Bax和Bal-2的影响
细胞凋亡是一种非炎症性细胞死亡,它是细胞在一定的生理或病理条件下受一系列基因控制的程序化细胞死亡方式,大强度运动中能源物质耗竭、代谢产物堆积及氧化应激所造成的自由基损伤等多种因素,均可引起肾细胞凋亡[16]。现代研究表明[17],细胞凋亡是受基因调控的,Bcl-2蛋白是细胞凋亡的重要分子机制,Bcl-2和Bax蛋白分别是Bcl-2家族中具有代表性的抑制细胞凋亡和促进细胞凋亡因子,两者主要分布于线粒体膜、核膜和内质网上。Bcl-2是目前最受关注的且被确认的对抗细胞凋亡的基因,它具有维持线粒体膜稳定性[18]、阻止线粒体释放Caspase和凋亡诱导因子及细胞色素C[19],抑制细胞凋亡的生理功能。Bax是促凋亡基因,Bax直接降低线粒体外膜稳定性或与Bcl-2结合形成异源二聚体结构,阻断Bcl-2的功用,使Caspase、细胞C等释放,促进细胞凋亡[20]。Bcl-2与Bax的相互作用是凋亡调控的中心环节,其比值大小决定抑制或促进细胞凋亡的走向。当Bax过度表达时,形成Bax同源二聚体,细胞趋向凋亡;当Bcl-2过度表达时,形成Bcl-2同源二聚体和Bcl-2/Bax异源二聚体,减少Bax同源二聚体的形成,从而抑制Bax/Bax的促凋亡作用[21]。田振军[22,23]等在对大鼠的睾丸和肾脏组织影响研究中发现,大强度训练可引起相关组织细胞凋亡明显增多,Bcl-2表达高于Bax表达;张桂兰[24,25]等同样研究报道,大强度急性力竭运动引起心、肝、肾组织细胞凋亡调控基因Bax与Bcl-2比例增高,促进凋亡发生增加。
从本研究结果知,经6周后,大强度耐力运动组和运动补充甘草黄酮组平均细胞凋亡指数(AI)为2.84和2.49均显著高于安静对照组2.29,补充甘草黄酮组又低于大强度运动组。运动组和运动补药组肾脏组织Bcl-2和Bax蛋白表达(MOD)及Bax/ Bcl-2比值较安静对照组呈不同显著差异性增高(P<0.01,P<0.05)。由此可见,大强度耐力运动造成肾细胞凋亡基因Bcl-2和Bax高度表达,其中补充甘草黄酮组细胞凋亡指数和相关Bcl-2和Bax蛋白表达显著低于大强度运动组,中药甘草黄酮对肾脏组织细胞凋亡具有一定的抑制作用。分析认为,长时间大强度耐力运动改变机体内环境,促进机体内能源物质耗竭、代谢产物堆积,随着运动后乳酸生成增多,使机体内环境酸化,产生大量的自由基,引起胞内钙超载,进而引起线粒体膜上PT孔打开,使线粒体内的细胞色素C释放入胞浆,使凋亡的抑制因子和或促进因子在高水平失平衡,进而引发细胞凋亡。补充甘草黄酮组大鼠细胞凋亡指数和相关Bcl-2和Bax蛋白表达(MOD)及Bax/ Bcl-2比值均较运动组有所降低,由此可见甘草黄酮对肾脏细胞具有保护作用,其机体机制可能与甘草黄酮能够降低组织中氧自由基的含量,减少自由基对神细胞的损伤及甘草黄酮在机体内经代谢可释放能量供细胞利用,可改善肾细胞的能力代谢,减轻Ca2+的运转障碍,从而抑制基因蛋白的表达等等有关。
3.3 肾脏组织中Ca2+、Mg2+-ATPase活性与细胞凋亡的关系
现代研究表明[26],线粒体在脊椎动物的凋亡调控中起着关键的作用,线粒体膜电位的改变会导致细胞凋亡发生。细胞钙稳态失衡是细胞凋亡的重要机制之一,细胞内游离钙离子在细胞凋亡中起重要作用,其既是凋亡信号转导分子,又是凋亡过程效应分子[27]。大量研究表明[28],许多细胞在凋亡初期,胞浆内游离钙离子浓度迅速持续性升高并随之出现核酸内切酶活化,DNA降解和细胞死亡。细胞外钙离子螯合剂及钙离子缓冲剂能抑制许多因素诱发的凋亡,都证明了钙离子稳态失调在启动细胞凋亡中具有重要作用[29]。在运动状态下,尤其在过度运动和力竭性运动状态下,肾脏细胞自由基产生增加,线粒体Ca2+超载,并发生缺血、缺氧性损伤,引起肾脏细胞凋亡[30]。从本研究结果可知,甘草黄酮对可抑制大强度运动大鼠肝脏组织中Ca2+、Mg2+-ATPase活性的降低,同时降低肾脏相应部位细胞的凋亡和抑制相关Bcl-2和Bax蛋白表达的过度升高,达到保护细胞活性和机体抵御内在环境变化的作用,本研究认为这可能与其抗氧化性及提高机体免疫机能的生物活性有关,其具体机制及其相关关联性有待于进一步的研究。
4 小 结
中草药甘草黄酮可有效抑制大强度耐力运动引起的线粒体Ca2+内流,维持线粒体和细胞内钙稳定,有效提高Ca2+、Mg2+-ATPase的活性;同时对大强度运动所引起的肾脏组织细胞凋亡和相关Bcl-2和Bax蛋白表达的过度升高具有一定程度的抑制作用。
[1] Taro Noumra, Toshio Fukai, Yoshio Hano. Chemistry and biological activities of isoprenylated flavonoids from medicinal plants (moraceous plants and Glycyrrhiza species)[J].Studies in Natural Products Chemistry,2003,28(9): 199~256.
[2] Yi-Cheng Xie, Xin-Wei Dong, Xi-Mei Wu. et al. Inhibitory effects of flavonoids extracted from licorice on lipopolysaccharide-induces acute pulmonary inflammation in mice[J]. International Immunopharmacology, 2009, 9(2): 194~200.
[3] 李 丽,常 波. 过度训练导致大鼠运动性蛋白尿机制的研究[J]. 西安体育学院学报,2007,24(3):80~84.
[4] 袁海平,陈佩杰,史仍飞,等. 运动性蛋白尿与肾脏细胞凋亡及氧自由基代谢关系的研究[J]. 中国运动医学杂志,2003,22(3):254~257.
[5] 刘祥梅,吴宇强,严 秋,等. 耐力训练对力竭运动诱导的大鼠肾实质细胞凋亡的影响[J]. 中国运动医学杂志,2008,27(4):488~451.
[6] Anibh M. Das. Regulation of the mitochondrial ATP-synthase in health and disease[J].Molecular Genetics and Metalolism, 2003, 79(2): 71~82.
[7] Frank Krause, Nicole H. Reifschneider, Sataro Goto.et al. Active oligomeric ATP synthases in mammalian mitovhondria[J].Biochemical and Biophysical Research Communications,2005,329(2): 583~590.
[8] Laura L. Wootton, Cymone C. H. Argent, Mark Wheatley, et al. The expression, activity and localization of the secretory pathway Ca2+-ATPsed(SPCA1) in different mammalian tissues[J].Biochimica et Biophysica Acta(BBA)-Biomembranes,2004,1664(2):189~197.
[9] David G. Nicholls. Mitochondria and calcium signling[J].Cell Calcium,2005,38(3-4):311~317.
[10] Haiping Li, Tao Feng, Pei Liang, et al. Effect of temperature on toxicity of pyrethroids and endosulfan, activity of meitochondrial Na+-K+-ATPase and Ca2+-Mg2+ATPase in Chilo suppressalis (Walker) (Lepidoptera:Pyralidae)[J].Pesticide Biochemistry and Physiology,2006,86(3): 151~156.
[11] J. Travis Parsons, David A. Sun, Robert J. Delorenzo. Etal. Neuronal-specific endoplasmic reticulum Mg2+/Ca2+ ATPase Ca2+ sequestration in mixed primary hippocampal culture homogenates[J].Analytical Biochemistry,2004,330(1): 130~139.
[12] Haris Carageorgiou , Constantinos Pantos, Apostolos Zarros. et al. Changes in acetylcholine esterase , Na, K+-ATPase, and Mg2+-ATPase activities in the frontal cortex and the hippocampus of hyper- and hypothyroid adult rats[J].Metabolism,2007,56(8): 1 104~1 110.
[13] Roberto Zayas, Jason S. Groshong, Christopher M. Gomez. Insitol-1,4,5-triphosphate receptors mediate activity-induced synaptic Ca2+ signals in muscle fibers and Ca2+ overload in slow-channel syndrome[J].Cell Calcium, 2007,41(4): 343~352.
[14] Oshio Fukai, Kazue Satoh, Taro Nomura, et al. Preliminary evaluation of antinephritis and radical scavenging activities of glabridin from Glycyrrhiza glabra[J].Fitoterapia, 2003, 74(7~8): 624~629.
[15] Zdzislawa Nowakowska. A review of anti-infective and anti-inflammatory chalcones [J].European Journal of Medicinal Chemistry ,2007, 42(2):125~137.
[16] Frederick L. Kiechle, Xinbo Zhang. Apoptosis: biochemical aspects and clinical implications [J].Clinica Chimica Acta, 2002, 326(1~2)27~45.
[17] Andrew M. Petros, Edward T. Olejniczak, Stephen W. Fesik. Structural biology of the Bcl-2 family of proteins [J].Bicchimica et Biophysica Acta(BBA)- Molecular Cell Research,2004,1644(2~3): 83~94.
[18] Michael R. Duchen. Mitochondria in health and disease: perspectives on a new mitochondrial biology[J].Molecular Aspects of Meidcine ,2001,25(4): 356~451.
[19] Hong He, Mildred Yim, Kevin H. Liu. et al. Involvement of G proteins of the Rho family in the regulation fo Bcl-2-like protein expression and caspase 3 activation by Gastrins[J].Cellular Signalling,2008,20(1): 83~93.
[20] Yasam Dogu, José Díaz. Mathematical model of a network of interaction between p53 and Bcl-2 during genotoxic-induced apoptosis[J].Biophysical Chemistry,2009,143(1~2): 44~54.
[21] Giovanni Corsetti, Evasio Pasini, Deodato Assanelli, et al. Effects of acute caffeine administration on NOS and Bax/Bcl-2 expression in the myocardium of rat[J].Pharmacological Research,2008,57(1): 19~25.
[22] 田振军,林琴琴,党利农. 运动训练对大鼠睾丸组织NOS、Bax、Bcl-2表达的影响[J]. 西安体育学院学报,2007,24(1):63~67.
[23] 田振军,孟辕丽. 不同强度运动对大鼠肾脏皮质区NOS、Bcl-2/Bax表达的影响[J]. 陕西师范大学学报(自然科学版),2006,34(2):105~109.
[24] 张桂兰,张伟华. 补充赖氨酸对大强度急性力竭运动大鼠心、肝组织Bax、Bcl-2的影响[J]. 体育科学,2008,28(1):49~53.
[25] 刘君雯,聂集林. 补充食醋对力竭运动大鼠肾组织bax、bcl-2和p53蛋白表达的影响[J]. 中国体育科技,2009,45(2):116~119.
[26] Enn K. Seppet, Tuuli Kaambre, Peeter Sikk. et al. Functional complexes of mitochondria with Ca,MgATPase of myofibrils and sarcoplasmic reticulum in muscle cells[J].Biochimica et Biophysica Acta(BBA)-Bioenergetics,2001,1054(2-3)379~395.
[27] Valeriy Lukyanenko, Aristide Chikando, W. J. Lederer. Mitochondria in cardiomyocyte Ca2+ signaling[J].The International Journal of Biochemistry & Cell Biology,2009,41(10): 1 957~1 971.
[28] Damon Poburko, Chen-Han Lee, Cornelis van Breemen. Vascular smooth muscle mitochondria at the cross road of Ca2+ regulation[J].Cell Calcium,2004,35(6): 509~521.
[29] Marisa Brini. Ca2+ signaling in mitochondria: mechanism and role in physiology and pathology [J].Cell Calcium,2003,34(4-5): 399~405.
[30] Howars S. Young, Larry R. Jones, David L. Stokes. Locating Phospholamban in Co-Crystals with Ca2+-ATPase by Cryoelectron Microscopy[J].Biophysical Journal,2001,81(2): 884~894.
Effect of High-Intensity Endurance Exercise on Ca2+,Mg2+-ATPase and Bax, Bcl-2 Protein Expression With Glycyrrhiza Flavonoids in rat Nephridial Tissue
WANG Dong-xu1,CHEN Yan-yan2
1. Dept. of P.E.; Tarim University, Xinjiang Alar, 843300, China; 2. P.E. Dept, Northwest University, Shaanxi Xi’an 710069, China.
Objective To explore Glycyrrhiza Elavonoids on the rat nephridial tissue of Ca2+, Mg2+-ATPase and Bax, Bcl-2 protein expression with high-intensity endurance exercise. Methods The twenty-four healthy male rats were randomly divided into quiet groups, high-intensity exercise group and exercise plus Glycyrrhiza Elavonoids group, After 6 weeks of treadmill training, Using the box of reagent and immunity histochemistry examined the changing of Ca2+, Mg2+-ATPase and Bax, Bcl-2 protein expression on each groups . Results Compared with the quiet groups, the activity of Ca2+, Mg2+-ATPase both had significant droped (P<0.01), and the groups of plus drog had very difference increased than high-intendity exerxise groups (P<0.01); High-intensity endurance exercise group and exercise dosing rats AI apoptosis index increased in varying degrees;high-intensity exercise group (MOD) were very significant difference(P<0.01), exercise plus drug group Bac protein expression (MOD)were very significant difference (P<0.01); Exercise plus drug group Bcl-2 protein expression(MOD) with the high-intersity exercise group had significant difference(P<0.01), High-intensity exercise group and exercise plus drug group Bax/Bcl-2 ratio of distribution is significantly difference degrees of difference(P<0.05,P<0.01).
Glycyrrhiza Flavonoids; High-intensity exerxise; Nephridial tissue; ATP; Bax; Bcl-2
1007―6891(2013)05―0030―05
G804.2
A
2012-04-10
