miRNAs在甲状腺乳头状癌中的表达及临床病理意义
2013-04-18戴璇璇周毅力刘超闫东升王瓯晨
戴璇璇 周毅力 刘超 闫东升 王瓯晨
miRNAs在甲状腺乳头状癌中的表达及临床病理意义
戴璇璇 周毅力 刘超 闫东升 王瓯晨
目的 探讨甲状腺乳头状癌(PTC)中特征性的miRNA表达谱以及临床病理意义。方法 对52例PTC及7例良性甲状腺肿瘤手术切除标本采用基因芯片技术及RNA印迹杂交法检测miRNA的表达,对过表达的miRNA表达水平与PTC临床病理特征之间的关系进行分析。结果 (1)用基因芯片技术筛检发现PTC组织中5例过表达的miRNAs(miR-375、miR-34a、miR-146b、miR-222、miR-31)。(2)RNA印迹杂交法验证芯片结果及检测其他miRNAs结果显示:miR-34a、miR-146b、miR-31、miR-21和miR-221在PTC组织中的表达水平较癌旁正常甲状腺组织显著升高(P<0.05)。MiR-146b和miR-221在PTC组织中的过表达率较良性甲状腺肿瘤组织显著升高(P<0.01)。PTC患者中包膜侵犯组、淋巴结转移组、TNM分期III-IV期组及AGES系统评分≥5分组miR-221的表达水平均明显高于相应对照组(P<0.05或0.01);而男性PTC患者的miR-146b表达水平明显高于女性PTC患者(P<0.05)。结论 miR-146b、miR-221、miR-21和miR-31的过表达与PTC的发生、发展有关;过表达的miR-221和miR-146b与PTC的预后不良有关。
甲状腺乳头状癌 微小RNA 芯片 RNA印迹杂交法
微小RNA(microRNA,miRNA)是一类全长约为21~25个核苷酸的非编码单链小RNA分子,这些miRNA能够识别特定的目标mRNA,在转录后水平调控基因的表达,从而参与调控细胞的生长、增殖、分化、凋亡等生命活动[1]。甲状腺癌是内分泌系统最常见的恶性肿瘤,全球发病率以每年4%的增幅上升,已跃居头颈部恶性肿瘤的首位[2]。近年来各国报道甲状腺癌发病率的增长多以甲状腺乳头状癌(thyroid papillary carcinoma,PTC)为主[3]。虽然PTC患者预后良好,但是部分患者会复发,最终死于并发症。本研究拟通过寻找与PTC相关的异常表达的miRNA,特别是与PTC预后相关的miRNA,探讨其在PTC诊治中的临床病理意义。
1 材料和方法
1.1 标本采集 52例PTC及7例良性甲状腺肿瘤标本均取自2009-01—2010-12温州医科大学附属第一医院术后病理检查证实的患者。组织病理类型的判断标准参照2007版美国癌症联合委员会甲状腺肿瘤的病理学分类,每例标本留取肿瘤组织和对应的距肿瘤边缘1cm以上的正常甲状腺组织,离体后10min内置于液氮中保存待检测。其中1例PTC标本用于基因芯片检测,其他标本用于RNA印迹杂交检测。
1.2 主要试剂及探针 miRNA寡核苷酸探针购自Ambion公司;Northern杂交液及抗地高辛抗体购自Roche公司;Trizol试剂购自Invitrogen公司;用以杂交的锁核酸(locked nucleic acid,LNA)探针序列为:miR-375:5′-UCACGCGAGCCGAACGAACAAA-3′;miR-34a:5′-AACAACCAGCUAAGACACUGCCA-3′;miR-146b:5′-AGCCUAUGGAAUUCAGUUCUCA-3′;miR-222:5′-GAGACCCAG UAGCCAGAUGUAGCU-3′;miR-31:5′-CAGCUAUGCCAGCAUCUUGCC-3′;miR-21:5′-UCAACAUCAGUCUGAUAAGCUA-3′;miR-221:5′-GAAACCCAGCAGACAATGTAGCT-3′;miR-181b:5'-CCCACCGACAGCAAUGAAUGUU-3′;miR-155:5′-UUAAUGCUAAUCGUGAUAGGGG-3′;U6:5′-GCAGGGGCCAUGCUAAUCUUCUCUGUAUCG-3′。
1.3 总RNA提取 取液氮中保存的组织标本,在液氮中研磨至粉状,按Trizol试剂说明书提取总RNA。用DEPC处理的蒸馏水溶解,采用Beckman公司分光光度仪测定RNA溶液A260/A280比值,计算RNA浓度和纯度,A260/A280比值>1.8方可用于检测;1%的琼脂糖变性凝胶电泳检测RNA的完整性。高质量RNA的28S与18S条带亮度在凝胶中约2︰1。所有RNA样品置-80℃保存备用。
1.4 基因芯片检测 总RNA用PEG方法分离miRNA,利用T4 RNA连接酶进行荧光标记,芯片杂交后用LuxScan 10K/A双通道激光扫描仪进行扫描。采用LuxScan3.0图像分析软件对芯片图像进行分析,最后用Significance Analysis of Microarrays(SAM,version 2.1)挑选差异表达基因。本实验检测1例PTC组织与癌旁正常组织的近400个miRNA差异表达谱,此过程由北京博奥公司完成。
1.5 RNA印迹杂交法(Northern blot)检测 先取5mg总RNA,95℃热变性3min,冰上冷却,15%丙烯酰胺(含7mol/L尿素)180V预电泳30min,用移液器吹走上样孔中的尿素,上样后180V电泳60min。胶、滤纸和尼龙膜组成“三明治”结构,在半干电转仪上以400mA转移1h。转膜后紫外交联2min。杂交管中放入适量杂交液,尼龙膜正面朝管中心放入杂交管,68℃预杂交30min,加入探针后42℃杂交过夜。2×SSC(含0.1%的SDS)洗膜3次,每次15min,Washing buffer洗膜10min。封闭液中封闭30min,然后2ml抗地高辛抗体结合60min,Washing buffer洗膜3次,每次10min。加入Detection buffer反应5min,与化学发光底物的CSPD结合后显色5min,暗室中压膜曝光。采用Scion Image软件计算miRNA的表达水平,用(miRNA条带灰度值-背景灰度值)/(U6条带灰度值-背景灰度值)表示。
1.6 临床病理特征 本试验选择分析的临床病理特征为患者性别、年龄、肿瘤大小(直径)、多灶性、包膜侵犯、淋巴结转移、TNM分期、AGES(患者年龄、肿瘤分级、侵犯程度和大小)系统评分。
1.7 统计学处理 采用SPSS 17.0统计软件,miRNA表达水平呈偏态分布,所得数据以中位数和四分位数间距表示,在PTC组织与对应癌旁正常组织之间的差异采用配对秩和检验;miRNA过表达率在PTC组织与良性甲状腺肿瘤组织之间的差异采用χ2检验或Fisher确切概率法检验;miRNA表达水平与各临床病理特征的关系采用两独立样本的秩和检验。
2 结果
2.1 基因芯片技术检测miRNA表达的结果 发现PTC中miR-375、miR-34a、miR-146b、miR-222和miR-31的表达水平明显高于癌旁正常组织,达1.75~4.89倍(中位数2.98倍),如图1所示。
2.2 Northern blot检测miRNA表达的结果 miR-34a、miR-146b、miR-31、miR-21及miR-221在PTC组织中的表达水平明显高于癌旁正常甲状腺组织,差异有统计学意义(P<0.05或0.01),见表1。miR-146b和miR-221在PTC组织中的过表达率也明显高于良性甲状腺肿瘤组织 [miR-146b为77.27%(17/22)vs14.29%(1/7);miR-221为82.35%(42/51)vs14.29%(1/7)],差异有统计学意义(均P<0.01),见表2。
2.3 miRNA表达水平与PTC临床病理特征的关系 见表3。
由表3可见,miR-221表达水平包膜侵犯者明显高于无包膜侵犯者,淋巴结转移者明显高于无淋巴结转移者,TNM分期Ⅲ~Ⅳ期者明显高于Ⅰ~Ⅱ期者,AGES系统评分≈5分者明显高于<5分者,差异均有统计学意义(P<0.05或0.01)。男性患者miR-146b表达水平明显高于女性患者,差异有统计学意义(P<0.05)。其他过表达的miRNA的表达水平与在各临床病理特征两组间无统计学差异(P>0.05)。

图1 基因芯片检测中miRNA在PTC(A)及癌旁正常组织(B)中的表达水平
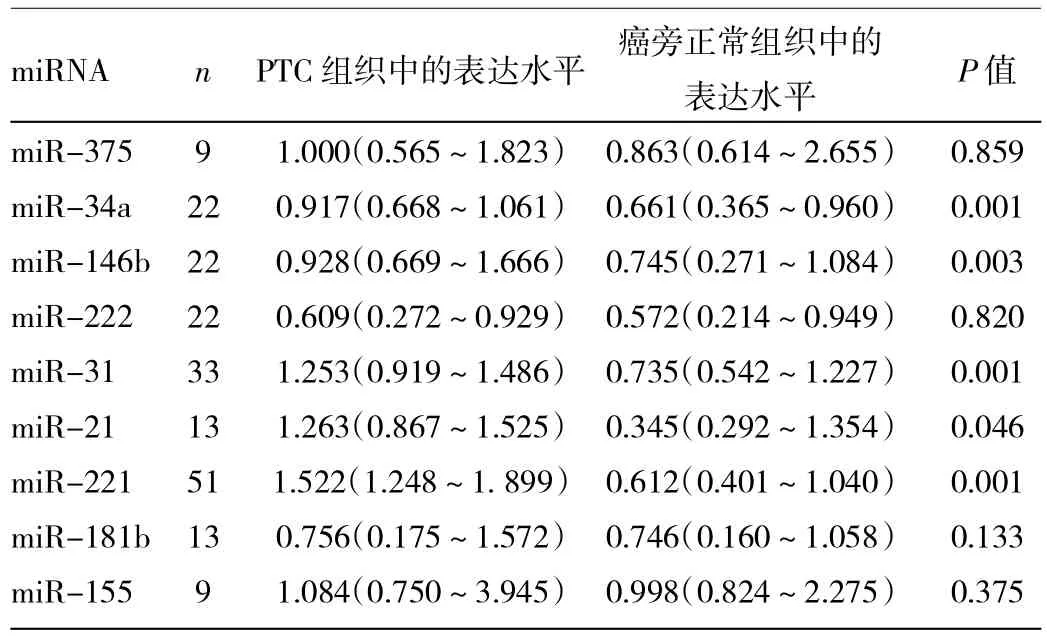
表1 PTC组织与癌旁正常甲状腺组织中miRNA表达水平的比较

表2 PTC组织与良性甲状腺肿瘤组织中miRNA过表达率的比较[例(%)]

表3 miR-221及miR-146b表达水平与PTC临床病理特征之间的关系
3 讨论
本研究通过基因芯片技术筛选人类全基因组miRNA表达谱,发现5个miRNA(miR-375、miR-34a、miR-146b、miR-222、miR-31)在PTC中过表达。由于基因芯片检测是半定量的检测手段,特异性不强,本研究采用RNA印迹杂交法验证芯片筛选的异常表达的miRNA并检测其他miRNA,最终发现5个miRNA(miR-34a、miR-146b、miR-31、miR-221、miR-21)在PTC中过表达。
现已发现miR-31、miR-21在多种恶性肿瘤中如结直肠癌、肝细胞癌中过表达[4]。以往的多项研究通过基因芯片和实时RT-PCR检测发现miR-31和miR-21在PTC中过表达[5-7]。本研究采用基因芯片及RNA印迹杂交法检测同样证实了这个结果,提示miR-31和miR-21可作为PTC的潜在标志物。miR-34a是p53调节系统的一部分,参与细胞凋亡。与以往多项研究认为miR-34a系抑癌基因不同,本研究通过基因芯片技术及RNA印迹杂交法均提示miR-34a在PTC中的表达明显高于癌旁正常组织,但miR-34a在PTC和甲状腺良性肿瘤之间表达水平无统计学差异。由于PTC分化程度高,预后良好,不同于以往研究中分化程度较低的恶性肿瘤或未分化癌,所以miR-34a可能在预测恶性肿瘤预后方面有一定的价值。MiR-31、miR-21的表达水平在PTC不同临床病理特征者之间均无统计学差异,这可能与临床收集的样本数较少有关,还需要进一步实验验证。
MiR-221定位在Xpl1.3区,与miR-222基因呈前后排列。He及Sheu等[5-6]通过基因芯片技术及RT-PCR方法的研究均提示miR-221在PTC组织中过表达。我们采用RNA印迹杂交法也发现miR-221在PTC中的表达水平明显高于癌旁正常组织,且在PTC组织中的过表达率明显高于良性甲状腺肿瘤组织。分组分析发现,miRNA-221过表达与肿瘤侵袭性的临床病理特征:包膜侵犯、淋巴结转移有关。Samaan及Simon等[8-9]的研究发现,PTC患者初始诊断时30%~65%颈部淋巴结发生转移,局部淋巴结转移与PTC复发和远处转移相关,而患者的主要死因之一是远处转移。本研究提示miR-221的过表达还与PTC风险及预后评估系统中的TNM分期Ⅲ~Ⅳ期及AGES系统评分≈5分有关。TNM分期法是应用最为普遍,也最为满意的分化型甲状腺癌预测系统,Loh等[10]的一项700例各期PTC病例的回顾性研究发现,不同TNM分期者复发率及病死率有明显统计学差异。张丽丽等[11]的多因素分析认为TNM分期是影响预后的一个独立因素。目前较常应用的甲状腺癌风险分级和预后评估系统AGES评分系统,有研究统计20年生存率根据这一系统评分≤3.99分者为99%,4~4.99分者为80%,5~5.99分者为67%,≈6分者为13%[12]。综上所述,miR-221过表达与PTC的侵袭和转移有关,miR-221过表达的PTC病例可能具有更为恶性的生物学行为,提示miR-221可以作为预测PTC预后的一个潜在标志物。Garofalo、Wang及Larson等[13-15]的研究提示miR-221可以抑制PTEN的表达,使细胞内PIP3的水平增高,PI3K/Akt的信号转导加强,细胞无限增殖而形成肿瘤,并发生浸润及转移。BRAF基因突变可通过NF-κB通路调控miR-221,miR-221可以与NF-κB通路中p65亚基相结合促进自身的表达,miR-221在BRAF基因突变组织中过表达,而BRAF基因突变与PTC的侵袭性有关,包括腺体外侵犯、局部浸润及远处转移[16-19]。Visone等[20]发现miR-221过表达的PTC组织或细胞系中,p27KIP1蛋白水平下降,促进癌细胞的增殖。这些可能都是miR-221可以在PTC中评价预后的分子机制。
MiR-146b位于10号染色体上,与miR-146a具有高度的序列同源性。He及Sheu等[5-6]研究通过基因芯片技术及RT-PCR方法均提示miR-146b在PTC组织中过表达。我们采用基因芯片筛选及RNA印迹杂交法验证发现miR-146b在PTC组织中的表达水平明显高于癌旁正常组织,其在PTC组织中的过表达率明显高于良性甲状腺肿瘤组织。此外,PTC组织中男性患者的miR-146b的表达水平明显高于女性患者,Cunninqham及Jukkola等[21-22]的研究指出男性PTC患者无病生存率低于女性患者,性别是PTC独立的预后预测因子。因此我们认为,miR-146b可以作为PTC预测预后的另一潜在标志物。Kim、Xing及Chou等[17-19,23]发现miR-146b在BRAF基因突变组织中表达明显升高,BRAF基因突变与PTC的侵袭性有关,这可能是miR-146b在PTC中过表达的一个分子机制。
本研究丰富了PTC的microRNA表达谱,筛选了一组与PTC相关过表达的miRNA。此外,研究结果显示,miR-221和miR-146在预测PTC预后中可发挥重要的作用。
[1]Ambros V.The functions of animal microRNAs[J].Nature,2004, 431:350-355.
[2]Nix P,Nicolaides A,Coatesworth A P.Thyroid cancer review 1: presentation and investigation of thyroid cancer[J].Int J Clin Pract,2005,59(11):1459-1463.
[3]Lubina A,Cohen O,Baechana M,et al.Time trends of incidence rates of thyroid cancer in Israel:what might explain the sharp increase[J].Thyroid,2006,16(10):1033-1040.
[4]Kutay H,Bai S,Datta J,et al.Downregulation of miR-122 in the rodent and human hepatocellular carcinomas[J].J Cell Biochem, 2006,99(3):671-678.
[5]He H,Jazdzewski K,Li W,et al.The role of microRNA genes in papillary thyroid carcinoma[J].PNAS,2005,102:19075-19080.
[6]Sheu S Y,Grabellus F,Schwertheim S,et al.Differential miRNA expression profiles in variants of papillary thyroid carcinoma and encapsulated follicular thyroid tumours[J].Br J Cancer,2010,102 (2):376-382.
[7]Tetzlaff M T,Liu A,Xu X,et al.Differential expression of miRNAs in papillary thyroid carcinoma compared to multinodular goiter using formalin fixed paraffin embedded tissues[J].Endocr Pathol,2007, 18(3):163-173.
[8]Samaan N A,Schultz P N,Hickey R C,et al.The results of various modalities of treatment of well differentiated thyroid carcinomas:a retrospective review of 1599 patients[J].J Clin Endocrinol Metab, 1992,75(3):714-720.
[9]Simon D,Goretzki P E,Witte J,et al.Incidence of regional recurrence guiding radicality in differentiated thyroid carcinoma[J].World J Surg,1996,20(7):860-866.
[10]Loh K C,Greenspan F S,Gee L,et al.Pathological tumor-nodemetastasis(pTNM)staging for papillary and follicular thyroid carcinomas:a retrospective analysis of 700 patients[J].J Clin Endocrinol Metab,1997,82(11):3553-3562.
[11]张丽丽,于学智,付荣湛,等.分化型甲状腺癌的治疗[J].中国普通外科杂志,2004,13(11):829-831.
[12]Dean D S,Hay I D.Prognostic indicators in differentiated thyroid carcinoma[J].Cancer Control,2000,7(3):229-239.
[13]Garofalo M,Di Leva G,Romano G,et al.miR-221&222 regulate TRAIL resistance and enhance tumorigenicity through PTEN and TIMP3 down regulation[J].Cancer Cell,2009,16(6):498-509.
[14]Wang Y,Hou P,Yu H,et al.High prevalence and mutual exclusivity of genetic alterations in the phosphatidylinositol-3-kinase/akt pathway in thyroid tumors[J].J Clin Endocrinol Metab, 2007,92(6):2387-2390.
[15]Larson S D,Jackson L N,Riall T S,et al.Increased incidence of well-differentiated thyroid cancer associated with Hashimoto thyroiditis and the role of the PI3k/Akt pathway[J].J Am Coll Surg,2007,204(5):764-773.
[16]Galardi S,Mercatelli N,Farace M G,et al.NF-kB and c-Jun induce the expression of the oncogenic miR-221 and miR-222 in prostate carcinoma and glioblastoma cells[J].Nucleic Acids Res,2011,39(9):3892-3902.
[17]Kim J,Giuliano A E,Turner R R,et al.Lymphatic mapping establishes the role of BRAF gene mutation in papillary thyroid carcinoma[J].Ann Surg,2006,244(5):799-804.
[18]Xing M,Westra W H,Tufano R P,et al.BRAF mutation predicts a poorer clinical prognosis for papillary thyroid cancer[J].J Clin Endocrinol Metab,2005,90(12):6373-6379.
[19]Kim T Y,Kim W B,Rhee Y S,et al.The BRAF mutation is useful for prediction of clinical recurrence in low-risk patients with conventional papillary thyroid carcinoma[J].Clin Endocrinol,2006, 65(3):364-368.
[20]Visone R,Russo L,Pallante P,et al.MicroRNAs(miR)-221 and miR-222,both overexpressed in human thyroid papillary carcinomas,regulate p27Kip1 protein levels and cell cycle[J].Endocr Relat cancer,2007,14(3):791-798.
[21]Cunninqham M P,Duda R B,Recant W,et al.Survival discriminants for differentiated thyroid cancer[J].Am J Surg,1990,160(4): 344-347.
[22]Jukkola A,Bloiqu R,Ebeling T,et al.Prognostic factors in differentiated thyroid carcinomas and their implications for current staging classifications[J].Endor Relat Cancer,2004,11(3):571-579.
[23]Chou C K,Chen R F,Chou F F,et al.MiR-146b is highly expressed in adult papillary thyroid carcinomas with high risk features including extrathyroidal invasion and the BRAF(V600E) mutation[J].Thyroid,2010,20(5):489-494.
Expression of specific miRNAs in papillary thyroid carcinomas and their clinicopathological significance
Objective To investigate expression of specific miRNAs in papillary thyroid carcinoma (PTC)and their clinicopathological significance.Methods Fifty two surgical specimens of PTC tissues and 7 specimens of benign thyroid tumor tissues were collected.The miRNA expression levels were detected by using microarray and Northern blot.The correlation between over-expressed miRNAs and clinicopathological features of PTC were analyzed.Results A set of 5 over-expressed miRNAs (miR-375,miR-34a,miR-146b,miR-222,miR-31)was distinguished by microarray in PTC tissues compared to cancer-adjacent tissues.Using Northern blot,the results of microarray were verified;and Northern blot results also showed that the expression levels of miR-34a,miR-146b,miR-31,miR-221 and miR-21 in PTC were significantly higher than those in cancer-adjacent tissues(P<0.05).Additionally,the over-expression rates of miR-146b and miR-221 in PTC tissues were significantly higher than those in benign thyroid tumor tissues(P<0.01).The expression levels of miR-221 in PTC patients with extrathyroidal invasion, lymph node metastasis,advanced TNM stage (III-IV)and AGES score≥5 were significantly higher than those in control groups (P<0.05 or 0.01);whereas the expression level of miR-146b in male PTC patients was significantly higher than that in female PTC patients(P<0.05).Conclusion Over-expression of miR-146b,miR-221,miR-21,and miR-31 may be associated with carcinogenesis and progression of PTC,and the over-expression of miR-221 and miR-146b are also correlated with poor clinical outcome of PTC patients.
Papillary thyroid carcinoma MiRNAs Microarray Northern blot

2013-07-16)
(本文编辑:沈叔洪)
浙江省自然科学基金资助项目(Y13H160115)
325000 温州医科大学附属第一医院肿瘤外科(戴璇璇、周毅力、刘超、王瓯晨);温州医科大学附属眼视光医院(闫东升)
王瓯晨,E-mail:woc099@sina.com
