乌司他丁对中性粒细胞介导的内皮细胞损伤的抑制作用
2013-04-10魏毅君段维勋熊红燕雷兰萍杨阳陈涛金振晓
魏毅君,段维勋,熊红燕,雷兰萍,杨阳,陈涛,金振晓
乌司他丁对中性粒细胞介导的内皮细胞损伤的抑制作用
魏毅君,段维勋,熊红燕,雷兰萍,杨阳,陈涛,金振晓
目的研究乌司他丁对中性粒细胞介导的内皮细胞损伤的抑制作用及其机制。方法 体外培养的人脐静脉内皮细胞(HUVECs)通过肿瘤坏死因子-α(TNF-α)和干扰素-γ(IFN-γ)孵育后活化,正常人血液分离的中性粒细胞经TNF-α孵育后激活,活化的HUVECs与激活的中性粒细胞共孵育建立中性粒细胞介导的内皮细胞损伤体外模型。共孵育体系中加入不同浓度的乌司他丁(100、500、1 500、3 000和5 000 U/ml),MTT法检测内皮细胞存活率,同时检测培养液中乳酸脱氢酶活性(LDH)、一氧化氮(NO)含量和弹性蛋白酶活性。中性粒细胞与TNF-α及不同浓度的乌司他丁共孵育后,流式细胞仪检测细胞内弹性蛋白酶活性。结果 激活的中性粒细胞与活化的HUVECs共孵育可以显著降低内皮细胞存活率,同时培养液中LDH活性显著升高、NO含量显著降低、弹性蛋白酶活性显著升高,乌司他丁可以剂量依赖性对抗上述变化。同时,乌司他丁可以剂量依赖性降低TNF-α激活的中性粒细胞内弹性蛋白酶的活性。结论 乌司他丁对中性粒细胞介导的内皮细胞损伤的抑制作用具有剂量依赖性,其机制与乌司他丁抑制中性粒细胞内及释放到细胞外的弹性蛋白酶的活性有关。
乌司他丁;内皮细胞;中性粒细胞;弹性蛋白酶
人类中性粒细胞内含有许多蛋白酶,这些蛋白酶产生的蛋白溶解作用是中性粒细胞吞噬和消灭病原微生物的主要机制,因此,在抗感染机制中具有重要作用。但是,如果这些蛋白酶从中性粒细胞中不受限制地释放出来,也会对细胞外基质和其它自身细胞造成损伤[1]。丝氨酸蛋白酶是哺乳动物体内种类最多的一类蛋白酶,其中弹性蛋白酶以激活形式储存在中性粒细胞的嗜天青颗粒中,在细胞外基质的降解过程中发挥着尤其重要的作用。弹性蛋白酶在中性粒细胞介导的内皮细胞损伤中也具有重要作用,是炎症反应引起血管损伤的重要基础[2]。近年来,多种弹性蛋白酶抑制剂在实验室中分离出来[3-5],有的已经用于临床抗炎症反应性疾病的治疗,有的还处于实验室研究阶段。目前,临床上最常用的蛋白酶抑制剂是乌司他丁,乌司他丁是一种从正常男性尿液中提取的蛋白酶抑制剂,常用于对抗过度炎症反应引起的各种组织损伤,可以有效抑制中性粒细胞分泌的弹性蛋白酶和胰蛋白酶的活性[6]。本研究的主要目的是观察乌司他丁是否能在体外抑制中性粒细胞介导的内皮细胞损伤,并初步探讨其对内皮细胞的保护作用与其对弹性蛋白酶活性的抑制作用之间的关系。
1 材料与方法
1.1 试剂、细胞与仪器 重组人肿瘤坏死因子α(rhTNF-α)(R&D公司,美国),干扰素γ(IFN-γ)(R&D公司,美国),乌司他丁(广州天普药业公司)。人脐静脉内皮细胞株由第四军医大学第一附属医院心血管外科实验室提供,小牛血清(杭州四季青公司),DMEM低糖培养液(Hyclone,美国),胰蛋白酶(Sigma,美国),MTT(Sigma公司),乳酸脱氢酶(LDH)试剂盒(南京建成生物工程研究所),弹性蛋白酶活性的检测试剂盒(南京建成生物工程研究所),DMSO(Sigma,美国),细胞裂解液(碧云天,上海)。弹性蛋白酶细胞荧光探针AAPV Elastase CellProbeTMReagent(Beckman公司,美国)。流式细胞仪(Becton Dickinson公司,美国),CO2细胞培养箱(Forma,美国),酶标仪(Biotech,美国),超净工作台(苏州净化设备仪器厂),倒置显微镜(Olympus,日本),低速离心机(赛特湘仪,湖南)。
1.2 人脐静脉内皮细胞(HUVECs)的培养和中性粒细胞的制备 HUVECs用含10%小牛血清的DMEM细胞培养液在37℃,5%CO2培养箱内培养2~3 d。待细胞融合后,用0.25%胰蛋白酶消化。镜下观察到细胞收缩变圆时弃去消化液,加入培养液以终止胰蛋白酶的作用。用滴管吹打壁上的细胞,使其完全脱落并分离。根据实验需要按2×105/ml接种于96孔培养板中。待细胞融合后,换用无血清的DMEM培养液培养24 h,使细胞同步化,然后即可进行分组实验。
肝素化全血采自自愿者,中性粒细胞的分离采用邹常春方法[7]简述如下:将肝素抗凝血3 ml,置于特制的细长试管,2 000 r/min离心10 min。血液分为淡黄色血浆层和白色的白细胞层以及红细胞层,分别吸取血浆和白细胞,置于洁净试管中。在离心管中依次加入1 ml 1.090 g/ml Percoll和1 ml 1.077g/ml Percoll,再将1~2 ml白细胞悬液缓缓铺在Percoll液密度梯度溶液上,2 000 r/mim离心15 min。吸取第2和第3层之间的细胞层,用自体血浆洗涤2次,加入适量DMEM培养液孵育10 min,瑞氏-吉姆萨染色法和台盼蓝染色法检验细胞的纯度和存活率均在97%以上。
1.3 MTT法检测不同浓度乌司他丁对中性粒细胞介导HUVECs损伤后细胞存活率的影响 中性粒细胞介导内皮细胞损伤需要内皮细胞和中性粒细胞处于激活状态[8-9]。
1.3.1 内皮细胞的激活 采用TNF-α(100 ng/ml)和IFN-γ(100 ng/ml)共同孵育12 h获得,采用DMEM培养基洗涤4次后,进行实验。
1.3.2 中性粒细胞的激活 正常健康人血液一般采用TNF-α(10 ng/ml)孵育5 min获得,DMEM培养基洗涤4次后,制成2.0×106/ml的细胞悬液,进行实验,每孔加入中性粒细胞1×104,37℃,5%CO2孵育12 h,观察中性粒细胞对内皮细胞的损伤作用。
1.3.3 实验分组 共分为10组,每组8个复孔。对照组1:HUVECs不进行活化处理,DMEM孵育12 h;对照组2:HUVECs进行活化处理,DMEM孵育12 h;对照组3:HUVECs不进行活化处理,加入未活化中性粒细胞孵育12 h;对照组4:HUVECs进行活化处理,加入未活化中性粒细胞孵育12 h;损伤组:HUVECs进行活化处理,加入活化中性粒细胞孵育12 h;乌司他丁保护组(分为5组):乌司他丁的剂量分别为100、500、1 500、3 000和5 000 U/ml,HUVECs进行活化处理,加入活化中性粒细胞,同时加入相应剂量的乌司他丁,孵育12 h。孵育完成后,收集培养液用于其它检测。加入DMEM培养液(100 μ1)和含0.5%MTT的培养液(10 μl),37℃,5%CO2培养箱内孵育4 h后,弃培养液,加入100 μl的DMSO原液,振荡10 min,待结晶完全溶解后,同时用酶标仪于490 nm波长处测定吸光值(OD值),实验重复3次。
1.4 培养液中LDH、NO含量和弹性蛋白酶活性的测定
1.4.1 LDH试剂盒购至南京建成生物工程研究所,按照试剂盒说明书对上述收集到的培养液进行LDH含量检测。实验重复3次。
1.4.2 以Griess法测定细胞培养液中NO含量[10]。方法简述如下:100 μl细胞培养液与100 μl的Griess试剂(1%磺胺溶于2.5%磷酸与等体积的0.1%萘乙二胺盐酸盐混合液)在室温下反应10 min,在酶标仪上于540 nm测定吸光度。根据NaNO2的标准曲线,计算出细胞培养液中NO的含量。实验重复3次。
1.4.3 中性粒细胞弹性蛋白酶活性采用显色性底物方法检测,弹性蛋白酶将其特异性底物N-methoxysucciny-Ala-Ala-Pro-Val-p-nitroanilide分解后,释放出p-nitroanilide,即可在分光光度计测定其含量[11]。方法简述如下:培养上清液400 g离心10 min后,加入含有显色底物和NaCl(0.5M)的Tris-HCl(0.1 mM)缓冲液,37℃孵育10 min,0.1M NaOH终止反应,弹性蛋白酶消化底物释放出的p-nitroanilide的含量在405 nm波长分光光度计下检测。以损伤组的平均OD值为1,其它各组培养液中弹性蛋白酶的活性表示为1的倍数。实验重复3次。
1.4.4 流式细胞仪测定中性粒细胞内弹性蛋白酶活性 中性粒细胞采用TNF-α活化5 min,PBS洗涤后,分为6组,对照组和乌司他丁100、500、1 500、3 000和5 000U/ml组,每组6个样本。37℃下DMEM培养液孵育1 h。PBS洗涤3次,重新悬浮在PBS中,调整细胞密度为3×106/ml,加入弹性蛋白酶细胞荧光探针,37℃下孵育10 min。荧光探针转入细胞后,与细胞中的弹性蛋白酶发生反应,释放出荧光物质rhodamine 110。设定流式细胞仪门控参数为中性粒细胞群,细胞内弹性蛋白酶含量以通过FL1滤光镜的荧光强度判定。数据由CellQuest(Becton Dickinson)软件采集。
1.5 统计学分析 统计学处理应用SPSS 12.0统计软件进行统计分析,所有实验数据均以均数±标准差(D)表示,采用Mann-Whitney检验进行组间比较,P<0.05为有统计学差异。
2 结 果
2.1 乌司他丁对中性粒细胞介导的内皮细胞损伤的保护作用 MTT法检测与单纯DMEM孵育组相比,仅仅采用TNF-α和IFN-γ活化HUVECs、未活化的HUVECs与激活的或者未激活的中性粒细胞共孵育,活化的HUVECs与未激活的中性粒细胞共孵育,都不能引起显著的内皮细胞存活率下降,只有激活的中性粒细胞与活化的HUVECs共孵育可以引起显著的内皮细胞存活率下降。乌司他丁对激活中性粒细胞介导的活化内皮细胞的损伤的保护作用具有剂量依赖性,1 500 U/ml以上的乌司他丁可以产生显著的保护效应,见图1。
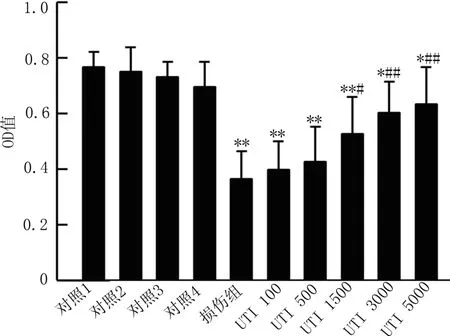
图1 MTT法检测不同处理组内皮细胞存活率比较
2.2 LDH含量 各组细胞处理后检测培养液中的LDH含量,与单纯DMEM孵育组相比,仅仅采用TNF-α和IFN-γ活化HUVECs、未活化的HUVECs与激活的或者未激活的中性粒细胞共孵育,活化的HUVECs与未激活的中性粒细胞共孵育,都不能引起培养液中LDH含量显著上升,只有激活的中性粒细胞与活化的HUVECs共孵育可以引起培养液中LDH含量的显著升高。500 U/ml的乌司他丁即可有效抑制激活中性粒细胞与活化HUVECs共孵育引起的培养液中LDH的升高,且乌司他丁的抑制效果具有剂量依赖性,见图2。
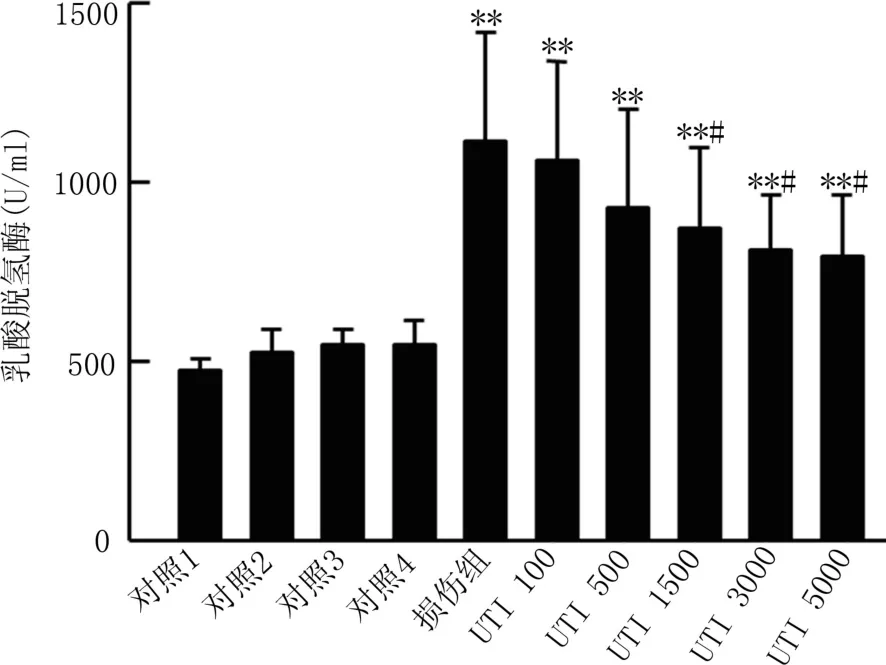
图2 不同处理组内皮细胞培养液中LDH含量比较
2.3 NO含量 各组细胞处理后检测培养液中的NO含量,与单纯DMEM孵育组相比,未活化的HUVECs与激活的或者未激活的中性粒细胞共孵育不能显著降低培养液中的NO含量,而采用TNF-α和IFN-γ活化HUVECs,及活化的HUVECs与未激活的中性粒细胞共孵育,都能引起培养液中NO含量显著升高,激活的中性粒细胞与活化的HUVECs共孵育可以引起培养液中NO含量的显著下降。500 U/ml的乌司他丁即可有效抑制激活中性粒细胞与活化HUVECs共孵育引起的培养液中NO含量下降,且乌司他丁的抑制效果具有剂量依赖性,见图3。
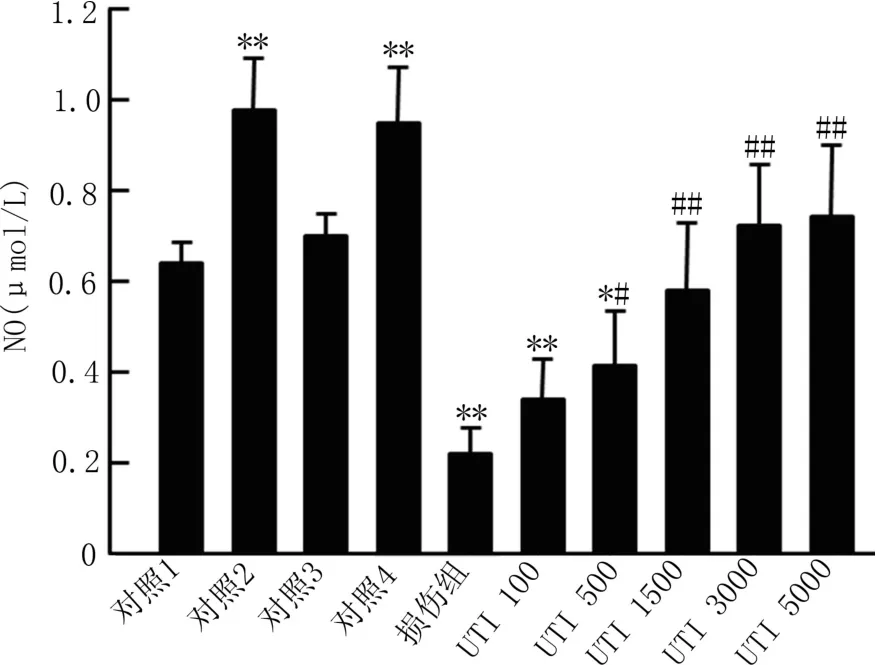
图3 不同处理组内皮细胞培养液中NO含量比较
2.4 弹性蛋白酶活性 各组细胞处理后检测培养液中的弹性蛋白酶的活性,与单纯DMEM孵育组和活化HUVECs组的培养液中几乎检测不到弹性蛋白酶的活性,未活化的HUVECs与激活的或者未激活的中性粒细胞共孵育培养液中含有很少的弹性蛋白酶活性,激活中性粒细胞与活化的HUVECs共孵育可以引起培养液中弹性蛋白酶活性显著升高。500 U/ml的乌司他丁即可有效抑制激活中性粒细胞与活化HUVECs共孵育引起的培养液中弹性蛋白酶活性,且乌司他丁的抑制效果具有剂量依赖性,见图4。
2.5 流式细胞仪检测TNF-α激活中性粒细胞内弹性蛋白酶活性 为了检测不同剂量乌司他丁对TNF -α激活中性粒细胞内弹性蛋白酶活性的影响,100~5 000 U/ml的乌司他丁加入到TNF-α激活中性粒细胞悬液中孵育1 h后,采用流式细胞仪检测细胞内弹性蛋白酶的活性,显示为各组细胞的荧光密度。结果显示,乌司他丁可以剂量依赖性降低激活中性粒细胞中弹性蛋白酶的活性,见图5。
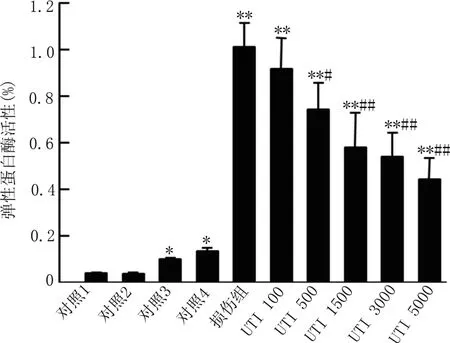
图4 不同处理组内皮细胞培养液中弹性蛋白酶活性比较

图5 乌司他丁剂量依赖性降低TNF-α激活的中性粒细胞内弹性蛋白酶活性
3 讨 论
人类中性粒细胞是多种炎症反应性疾病,如风湿病、成人呼吸窘迫综合征(ARDS)、脏器缺血再灌注损伤等病理过程中,造成组织损伤的主要效应成分[12]。内皮细胞在这些疾病的发生和发展过程中是最初的也是最重要的靶细胞,因为中性粒细胞要发挥其损伤作用,必须首先作用于内皮细胞。系统性炎症反应综合征,ARDS和多脏器衰竭的发生发展过程中都有激活中性粒细胞介导内皮细胞损伤的发生[13-14],中性粒细胞中释放出的活性氧物质和蛋白酶协同作用,造成内皮损伤[15-16]。目前已经有多种丝氨酸蛋白酶抑制剂用于临床胰腺炎、DIC和心血管疾病的治疗[17-20]。到目前为止,乌司他丁是其中临床应用最多,而且研究最深入的一种蛋白酶抑制剂。过去有研究表明乌司他丁可以抑制中性粒细胞介导的牛颈动脉内皮细胞和HUVECs损伤[21-22],但是对于其具体机制的探索还不够深入,特别是乌司他丁对中性粒细胞弹性蛋白酶的抑制在这个过程中的作用还不完全清楚。
本研究提示乌司他丁在体外实验中可以抑制中性粒细胞介导的内皮细胞损伤,这种作用可能是通过乌司他丁对中性粒细胞弹性蛋白酶活性的抑制实现的。本研究的结果表明,乌司他丁不但对释放到细胞外的弹性蛋白酶活性有抑制作用,而且对激活的中性粒细胞内的弹性蛋白酶具有抑制作用。乌司他丁是否具有抑制中性粒细胞释放弹性蛋白酶的作用,本研究的结果还不能证实,而且本研究的结果并不能排除乌司他丁通过其它途径发挥其抗损伤效应。有研究表明,乌司他丁也可以抑制白细胞介素-1(IL-1)和TNF-α介导的内皮细胞-中性粒细胞黏附[23],以及TNF-α诱导的内皮细胞上细胞间黏附分子-1(ICAM-1)的表达[24]。所以乌司他丁抑制中性粒细胞介导的内皮损伤还可能是通过抑制中性粒细胞-内皮细胞黏附来实现。
人体中有多种内源性的蛋白酶抑制剂,其中α1蛋白酶抑制剂(α1-protease inhibitor,A1PI)可以与弹性蛋白酶形成复合物,从而抑制游离弹性蛋白酶的活性[1,12]。但是,激活的中性粒细胞会释放出活性氧物质,能够将A1PI氧化灭活。在生理状态下,弹性蛋白酶与A1PI处于平衡状态,在病理情况下,异常激活的中性粒细胞会打破这种平衡,弹性蛋白酶释放出来并出现不可控制的酶学消化作用[1,12],从而造成组织损伤。据报道,乌司他丁可以降低中性粒细胞释放活性氧物质[25],因此,乌司他丁的保护效果可能部分来源于对内源性蛋白酶抑制剂A1PI的保护作用。但是,一旦中性粒细胞与内皮细胞或者细胞外基质黏附,A1PI就不能扩散到黏附紧密的区域,弹性蛋白酶引起的组织消化和破坏进程就会加速[1,12]。外源性的蛋白酶抑制剂,如乌司他丁,也不太可能弥散进入黏附紧密的区域并使弹性蛋白酶失活。本研究显示,乌司他丁通过直接作用于中性粒细胞而抑制其细胞内弹性蛋白酶的活性,说明即使中性粒细胞和内皮细胞发生了黏附,乌司他丁也可以抑制中性粒细胞产生和释放活化的弹性蛋白酶,对内皮细胞产生保护作用。
有研究表明,乌司他丁可以抑制心肺复苏患者循环中中性粒细胞释放弹性蛋白酶[26]。乌司他丁还可以通过其胰蛋白酶抑制功能区对细胞膜的作用,抑制中性粒细胞钙离子的内流[27-28],进而抑制已经激活的中性粒细胞的功能,但是本研究并没有对这种机制进行探索。多种细胞上均有乌司他丁受体[29],外源性乌司他丁可以被培养细胞通过内吞途径内化到细胞内[30],因此,中性粒细胞可能也会摄取乌司他丁,从而发挥其抑制乌司他丁释放弹性蛋白酶的作用。
总之,本研究采用体外实验模型对乌司他丁抑制中性粒细胞介导的内皮损伤机制进行了初步探索,表明乌司他丁即可能通过抑制中性粒细胞分泌到细胞外弹性蛋白酶活性,也可能通过抑制中性粒细胞内的弹性蛋白酶活性发挥其保护作用。提示,临床上使用乌司他丁对于多种中性粒细胞参与的炎症反应性疾病如系统性炎症反应综合征,ARDS等多种疾病具有一定的治疗作用。
[1] Owen CA,Campbell EJ.The cell biology of leukocyte-mediated proteolysis[J].J Leukoc Biol,1999,65(2):137-150.
[2] Smedly LA,Tonnesen MG,Sandhaus RA,et al.Neutrophilmediated injury to endothelial cells.Enhancement by endotoxin and essential role of neutrophil elastase[J].J Clin Invest,1986,77(4):1233-1243.
[3] Leβig J,Reibetanz U,Schonberg M,et al.Efficient inhibition of human leukocytic elastase by means of α1-antitrypsin/peptide complexes[J].Cytometry A,2013,83(5):461-471.
[4] Wan H,Lee KS,Kim BY,et al.A spider(Araneus ventricosus)chymotrypsin inhibitor that acts as an elastase inhibitor and a microbial serine protease inhibitor[J].Comp Biochem Physiol B Biochem Mol Biol,2013,165(1):36-41.
[5] Wagsater D,Johansson D,Fontaine V,et al.Serine protease inhibitor A3 in atherosclerosis and aneurysm disease[J].Int J Mol Med,2012,30(2):288-294.
[6] Ogawa M,Nishibe S,Mori T,et al.Effect of human urinary trypsin inhibitor on granulocyte elastase activity[J].Res Commun Chem Pathol Pharmacol,1987,55(2):271-274.
[7] 邹常春.全血中性粒细胞分离方法的改进研究[J].实验与检验医学,2009,27(4):337-338.
[8] Bratt J,Palmblad J.Cytokine-induced neutrophil-mediated injury of human endothelial cells[J].J Immunol,1997,159(2):912-918.
[9] von Asmuth EJ,Leeuwenberg JF,van der Linden CJ,et al.Tumour necrosis factor-alpha induces neutrophil-mediated injury of cultured human endothelial cells[J].Scand J Immunol,1991,34(2):197-206.
[10] 杨阳,段维勋,金振晓,等.姜黄素对血管内皮细胞过氧化氢损伤的保护作用及其机制研究[J].中国体外循环杂志,2011,9(4):239-242.
[11] Hagio T,Nakao S,Matsuoka H,et al.Inhibition of neutrophil elastase activity attenuates complement-mediated lung injury in the hamster[J].Eur J Pharmacol,2001,426(1-2):131-138.
[12] Weiss SJ.Tissue destruction by neutrophils[J].N Engl J Med,1989,320(6):365-376.
[13] Chen X,Christou NV.Relative contribution of endothelial cell and polymorphonuclear neutrophil activation in their interactions in systemic inflammatory response syndrome[J].Arch Surg,1996,131(11):1148-1153.
[14] Gildea TR.Pulmonary disease in small-vessel vasculitis[J].Cleve Clin J Med,2012,79 Suppl 3:S27-30.
[15] Varani J,Ginsburg I,Schuger L,et al.Endothelial cell killing by neutrophils.Synergistic interaction of oxygen products and proteases[J].Am J Pathol,1989,135(3):435-438.
[16] Ward PA,Varani J.Mechanisms of neutrophil-mediated killing of endothelial cells[J].J Leukoc Biol,1990,48(1):97-102.
[17] Ohwada M,Watanabe N,Maeda M,et al.New endoscopic treatment for chronic pancreatitis,using contrast media containing ulinastatin and prednisolone[J].J Gastroenterol,1997,32(2):216-221.
[18] Taenaka N,Shimada Y,Hirata T,et al.Gabexate mesilate(FOY)therapy of disseminated intravascular coagulation due to sepsis[J].Crit Care Med,1983,11(9):735-738.
[19] Jang IK,Brown DF,Giugliano RP,et al.A multicenter,randomized study of argatroban versus heparin as adjunct to tissue plasminogen activator(TPA)in acute myocardial infarction:myocardial infarction with novastan and TPA(MINT)study[J].J Am Coll Cardiol,1999,33(7):1879-1885.
[20] Lewis EC.Expanding the clinical indications for α(1)-antitrypsin therapy[J].Mol Med,2012,18:957-970.
[21] Fujita H,Morita I,Ishikawa K,et al.The synergistic effect of elastase and hydrogen peroxide on vascular endothelial cell injury is due to the production of hydroxylradical in the endothelial cells[J].J Atheroscler Thromb,1996,3(1):32-38.
[22] Nakatani K,Takeshita S,Tsujimoto H,et al.Inhibitory effect of serine protease inhibitors on neutrophil-mediated endothelial cell injury[J].J Leukoc Biol,2001,69(2):241-247.
[23] Okumura Y,Inoue H,Fujiyama Y,et al.Effects of serine protease inhibitors on accumulation of polymorphonuclear leukocytes in the lung induced by acute pancreatitis in rats[J].J Gastroenterol,1995,30(3):379-386.
[24] Aosasa S,Ono S,Seki S,et al.Inhibitory effect of protease inhibitor on endothelial cell activation[J].J Surg Res,1998,80(2):182-187.
[25] Ito K,Mizutani A,Kira S,et al.Effect of Ulinastatin,a human urinary trypsin inhibitor,on the oleic acid-induced acute lung injury in rats via the inhibition of activated leukocytes[J].Injury,2005,36(3):387-394.
[26] Xu CE,Zou CW,Zhang MY,et al.Effects of high-dose ulinastatin on inflammatory response and pulmonary function in patients with type-a aortic dissection after cardiopulmonary bypass under deep hypothermic circulatory arrest[J].J Cardiothorac Vasc Anesth,2013,27(3):479-484.
[27] Rui M,Duan YY,Zhang XH,et al.Urinary trypsin inhibitor attenuates seawater-induced acute lung injury by influencing the activities of nuclear factor-?B and its related inflammatory mediators[J].Respiration,2012,83(4):335-343.
[28] Hemmer CJ,Vogt A,Unverricht M,et al.Malaria and bacterial sepsis:similar mechanisms of endothelial apoptosis and its prevention in vitro[J].Crit Care Med,2008,36(9):2562-2568.
[29] Kobayashi H,Gotoh J,Fujie M,et al.Characterization of the cellular binding site for the urinary trypsin inhibitor[J].J Biol Chem,1994,269(32):20642-20647.
[30] Yamasaki F,Shinkawa T,Watanabe M,et al.Uptake of human urinary trypsin inhibitor by the kidney epithelial cell line,LLC-PK1[J].Pflugers Arch,1996,433(1-2):9-15.
Inhibitory effect of ulinastatin on neutrophil mediated endothelial cell injury
Wei Yi-jun,Duan Wei-xun,Xiong Hong-yan,Lei Lan-ping,Yang Yang,Chen Tao,Jin Zhen-xiao Department of Cardiovascular Surgery,Xijing Hospital,Fourth Military Medical University,Shaan'xi Xi'an 710032,China
Jin Zhen-xiao,Email:jinzx10262@aliyun.com
ObjectiveTo investigate the inhibitory effect of ulinastatin on neutrophil mediated endothelial cell injury and its underlying mechanisms.MethodsHuman umbilical vein endothelial cells(HUVECs)were activated with TNF-α and IFN-γ in vitro.Neutrophil cells obtained from health people were separated and primed with TNF-α.In vitro neutrophil mediated endothelial cell injury model was established by activated HUVECs and primed neutrophial co-culture,serial concentrations(100,500,1500,3000 and 5000 U/ml)of ulinastatin were added to the co-culture system.Cellular viability was determined with MTT assay,lactate dehydrogenase(LDH)content,NO content and elastase activity in the culture medium were examined.Meanwhile,serial concentrations of ulinastatin were added to TNF-α primed neutrophial cells,and the intracellular elastase activity was measured with a flow cytometer.ResultsThe co-culture process of primed neutrophil and activated HUVECs significantly decreased the viability of HUVECs,decreased the NO content and increased the LDH and elastase content in the culture medium.Ulinatatin inhibited these changes in a dose dependent manner when added in the co-culture system.Furthermore,TNF-α alone could activate the neutrophil and increased the intracellular elastase activity,and ulinastatin could decrease the intracellular elastase activity in a dose dependent manner.ConclusionUlinastatin can dose-dependently inhibit the neutrophil mediated endothelial cell injury in an ex vivo model,this inhibitory effect is associated with the ability of ulinastatin decreasing the intracellular and extracellular elastase activity.
Ulinastatin;Endothelial cell;Neutrophil;Elastase
R654.1
A
1672-1403(2013)04-0242-06
2013-06-04)
2013-07-15)
陕西省攻关计划项目(2012SF2-21-1,2012K15-02-01);天普研究基金项目(01201104)
721004宝鸡,解放军第三医院神经外科(魏毅君),710032西安,第四军医大学第一附属医院心血管外科(魏毅君,段维勋,雷兰萍,杨 阳,陈 涛,金振晓),710003西安,西安市中心医院胸心外科(熊红燕)
金振晓,Email:jinzx10262@aliyun.com
