蛋白激酶CK2β亚基在肝癌中上调表达及其对肝癌细胞增殖和迁移的影响
2013-04-09张元元
张 薇,张元元,蔡 灏,余 龙
(复旦大学 生命科学学院 遗传学研究所,上海 200433)
肝癌是世界上常见的恶性肿瘤之一,全球发病率已超过100万/年,我国一直是世界范围内肝癌高发区,我国的肝癌死亡率位于癌症死亡率的第二位.发病率约为欧美国家的10倍[1].肝癌因其恶性程度高,浸润和转移性强,病情进展快,以及缺乏有效的早期诊断方法,大部分患者就诊时已为晚期.肝癌是先天耐药的癌症,细胞毒化疗药物对晚期肝癌疗效差,治疗技术有限,有效治疗尚无标准方案[2].因此肝癌致病基因以及致病机理的研究对于肝癌的病理诊断和针对肝癌特异靶点的药物研发尤为重要.
蛋白激酶CK2最初发现于1954年,曾经被称为酪蛋白激酶Ⅱ,是一种在真核细胞中普遍存在的信使非依赖性丝/苏氨酸蛋白激酶,高度保守且功能多样[3-6].在细胞的生长,增殖,凋亡以及生物节律的调控中均发挥重要的作用.CK2是一类酶家族,由两类催化亚基(α和α')和一类调节亚基(β)构成.CK2可以以全酶的形式存在,形成异源四聚体(α2β2;α'2β2;αα'β2),各个亚基也可能以游离的状态存在[7].CK2是一种具有底物水平磷酸化能力的蛋白激酶,有多种底物,这些底物涉及细胞功能的许多方面,如DNA复制与转录,RNA加工与翻译,细胞信号转导与加工,癌基因与抑癌基因活性的调节等[8,9].
目前的研究表明CK2不仅对于细胞的存活和正常的生理功能的行使必不可少,而且与众多疾病,特别是肿瘤的发生发展关系密切,在迄今为止已检测过的肿瘤中,CK2均表达失调.CK2激酶活性的增高可能与肿瘤细胞的分化程度及侵袭转移等有关.如Pallares等在研究发现,在头颈癌中CK2的激酶活性的增高与肿瘤的分级分期密切相关[10].一些动物实验也证实,CK2的表达失衡导致动物体内致癌潜能被激发.如CK2联合C-Myc的转基因表达可以显著增加小鼠患淋巴瘤和白血病的几率.这些研究表明,CK2参与肿瘤的发生可能与其对细胞中其他致癌信号的调控有关[11].因此CK2已经成为一个有前景的治疗靶点,不同作用模式的CK2抑制剂相继诞生,根据其作用模式的不同,可以分为ATP竞争性和非ATP竞争性抑制剂,后者又包括底物靶向抑制剂,CK2α亚基外部靶向抑制剂及阻断亚基相互作用抑制剂[12].
CK2的β亚基,是催化亚基α或α'的特异配体,对全酶活性及稳定性起调节作用.其N端(5~104AA)组成的α螺旋酸性环区通过与α亚基的赖氨酸富含区相互作用,调节CK2的激酶活性,控制其对底物的磷酸化.与催化亚基具有多种异构体不同的是,目前在哺乳动物中调节亚基CK2β只发现了一种,由215个氨基酸残基组成,在种属间具有高度保守性(如人与果蝇之间可达88%同源性),这提示CK2β是CK2细胞功能重要介导剂[12,13].过去曾认为CK2β只存在于全酶中,对催化亚基起靶向调节作用,因此以往的研究多针对CK2α催化亚基,特别是以其作为抑制CK2激酶活性并作为抗肿瘤药物的靶点,而往往忽视了调节亚基CK2β的功能.然而,现在越来越多的资料表明,CK2β拥有的独立于CK2激酶的功能,具有更为重要和广泛的调节作用,它通过与c-Mos,Chk1,A-Raf等激酶直接互作调节其激酶活性,在细胞周期调控、DNA损伤修复等过程中发挥独特的生物学功能[14-17].如Martel等人用特异性小肽靶向CK2β,可增加P53蛋白量,通过P53途径来诱导细胞凋亡[18].也有文献显示,在非小细胞肺癌中,CK2β的表达明显上升,特异性靶向CK2β的siRNA可下调CK2β的蛋白表达,提示CK2β亚基可能作为一有效的抗癌药物筛选的分子靶点[19,20].此外,小鼠和秀丽隐杆线虫CK2β缺失是致死型突变[21],说明其在细胞生存中起着举足轻重的作用.
报道显示,CK2β在肿瘤中的表达变化仅在头颈部肿瘤、非小细胞肺癌、乳腺癌、前列腺癌、肾癌等中有报道[22-25],其在肿瘤中的功能也缺少深入的研究.本文拟研究CK2β在肝癌中的表达变化及功能,考察CK2β在肝癌中的表达变化及其对肝癌细胞增殖和迁移的影响.此外,还将研究消减CK2β表达能否提高肝癌细胞对化疗药物的敏感性,对siRNA消减靶向CK2β与现有化疗药物联合使用进行了初步探讨.
1 材料与方法
1.1 材料
91例原发性肝癌及癌旁组织cDNA样品来自复旦大学附属中山医院.75例原发性肝癌与癌旁组织样品购自上海芯超生物科技有限公司,所有诊断均经病理切片证实,染色强度评分由病理科医生独立完成.
1.2 细胞的siRNA转染
采用SMMC-7721肝癌细胞均匀接种,使其16h后达40%~50%汇合度.将4μL Lipofectamin2000与100μL DMEM混合孵育,siRNA片段与100μL DMEM混合孵育,静置15min.将已贴壁的细胞用PBS清洗一遍,更换无血清DMEM培养基,45min后将转染混合物均匀滴加,使得siRNA的终浓度达到10~20nmol/L.4h后更换为完全培养基继续培养.CK2β的敲减siRNA片段序列为(上海吉玛生物公司):SiRNA-1:sense5'-3'CGCUACAUCCUUACCAACCGU,Antisense5'-3'ACGGUUGGUAAGGAU GUAGCG;SiRNA-2:sense5'-3'CUUUGGUUACUGUCCUCUUGU,Antisense5'-3'ACACGAGGACA GUAACCAA;siRNA-Ns:sense5'-3'UUCUCCGAACGUGUCACGUTT,Antisense 5'-3'ACGUGAC ACGUUCUCATAA.
1.3 Real-time PCR
按照TOYOBO公司SYBR Green Supermix试剂盒说明书操作.利用温度梯度PCR摸索适合CK2β实时PCR引物的退火温度.退火温度60℃,35个循环.4复孔,以β2-MG作为内参基因,基因的表达量用相对定量的方法进行比较.引物序列(上海生物工程公司)CK2β-F:GTCCTGGATTTCCTGGTTC TGTG;CK2β-R:CTGCTCAATCAGGTCACTCTGG.
1.4 Western blot
配置SDS-PAGE分离胶和浓缩胶,用SDS上样缓冲液充分裂解细胞,收集裂解液,100℃水浴变性8min.室温100V电压下进行电泳.卸胶,转移缓冲液平衡凝胶和硝酸纤维素膜20min.4℃湿转法100V 2h,脱脂牛奶室温封闭1h.封闭缓冲液稀释一抗,室温下孵育2h或4℃摇床过夜.将膜浸泡在TBST洗涤缓冲液中,漂洗10min,重复3遍.封闭缓冲液中稀释二抗(1∶5000~1∶10000),室温下摇床孵育1h,洗膜3次.用ECL法进行显色.抗体来源:β-actin单克隆抗体(Sigma公司);抗人CK2βmonoclonal antibody(Epitomics公司).
1.5 免疫组化检测CK2β在肝癌及癌旁组织中的表达
将组织芯片放入全自动染色机中进行脱蜡;用纯水冲洗3次,1次1min.放入阻断剂中15min;用PBS缓冲液冲洗3次;一抗放入离心机中7200r/min离心30s,按照1∶50稀释度用DAKO抗体稀释液稀释;滴加一抗,放入4℃冰箱过夜孵育;室温放置30~45min;将片子用PBS缓冲液冲洗3次;滴加DAKO公司的EnVisionTM+/HRP兔工作液,孵育30min;时间到后用PBS冲洗3次,1次1min;在片子上滴加稀释后的DAB,显色5min,到时后自来水冲洗5min;在片子上滴加哈氏苏木素(Sigma公司)40s,用自来水冲洗2min;将片子放入全自动染色机进行脱水,取出封片.镜检拍照.
1.6 MTS法测定消减细胞增殖实验
将细胞种于6孔板中,至40%~50%汇合度时,按细胞siRNA转染方法转染.24h后,消化细胞,计数后接种于96孔板中(2×103/孔).每24h,每孔加入10μL MTS/DMEM混合液,继续培养3h后显色,连续检测6d.以没有任何细胞的无血清DMEM为对照.检测前摇晃培养板8s,混匀.用BioTek H4酶标仪检测波长450nm时各孔的光吸收值.
本研究结果显示,相对于NIPPV单用,纳洛酮联用NIPPV能显著增加PO2水平和降低PCO2水平,增加SaO2水平,两组比较差异均有统计学意义(P<0.01),说明纳洛酮联用NIPPV能显著纠正机体酸碱平衡,纠正低氧血症;其次,住院死亡率和再次有创气管插管率显著降低,说明纳洛酮能显著降低NIPPV治疗失败率,同时显著减少住院时间,有利于减轻患者经济负担。用药期间未发生严重不良反应,患者耐受性好,说明纳洛酮联用NIPPV安全性较好。
1.7 细胞划痕试验
细胞接种和饥饿:首先在35mm的皿底端做好标记,将细胞分为不同的区域.将目的细胞按每孔约1.5×106个细胞接种,贴壁后细胞密度约为100%的汇合度时,用PBS漂洗细胞2遍,加入无血清的DMEM培养基进行饥饿培养.
细胞划痕:细胞饥饿24h后,用20μL的枪头在铺满细胞的皿中划一条痕迹,然后用PBS洗2遍,洗去细胞碎片.Leica DM RA2显微镜镜检:取不同时间点用倒置显微镜拍摄细胞相同位置的迁移情况.
2 结 果
2.1 CK2β在肝癌组织mRNA水平显著上调表达及其与肝癌临床病理学特征的关联分析
用实时定量PCR的方法检测了91对肝癌和癌旁标本中CK2β的mRNA水平.采用△△Ct值法,试验中以β2-MG基因作为内参基因,计算每对样本中癌组织的CK2β的mRNA与β2-MG的mRNA的相对表达量之比(T/N),对相对表达量取log2值作图(图1).分析时,显著性差异的阈值设定为±1.分析时,正一为上调一倍,负一为下调50%.在69对样品(75.8%)中,CK2β在癌组织中呈现显著性上调,在8对样本(8.79%)中差异不明显,20对样本(21.98%)中呈现显著性下调.
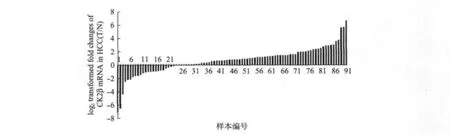
图1 CK2βmRNA水平在肝癌组织中显著性上调Fig.1 The high expression of gene CK2βmRNA level in HCC
为了观察CK2β的表达变化是否对临床诊断和治疗具有指导性意义,我们将91对肝癌样本中CK2β的mRNA变化数据与临床病理特征进行了相关性分析(表1(见第250页)).尽管在AFP(Alphafetoprotein),病理分化程度(Pathological differentiation),肿瘤包膜(Tumor encapsulation),肝硬化结节(Hepatic cirrhotic nodule),癌栓(Portal vein tumor thromb)等指标中没有观察到相关性,但是发现CK2β的表达变化与临床分期(TNM clinical stage)具有相关性.卡方检验得出的P值为0.02.这一结果表明,CK2β的上调表达可能参与肝癌的发生与发展.
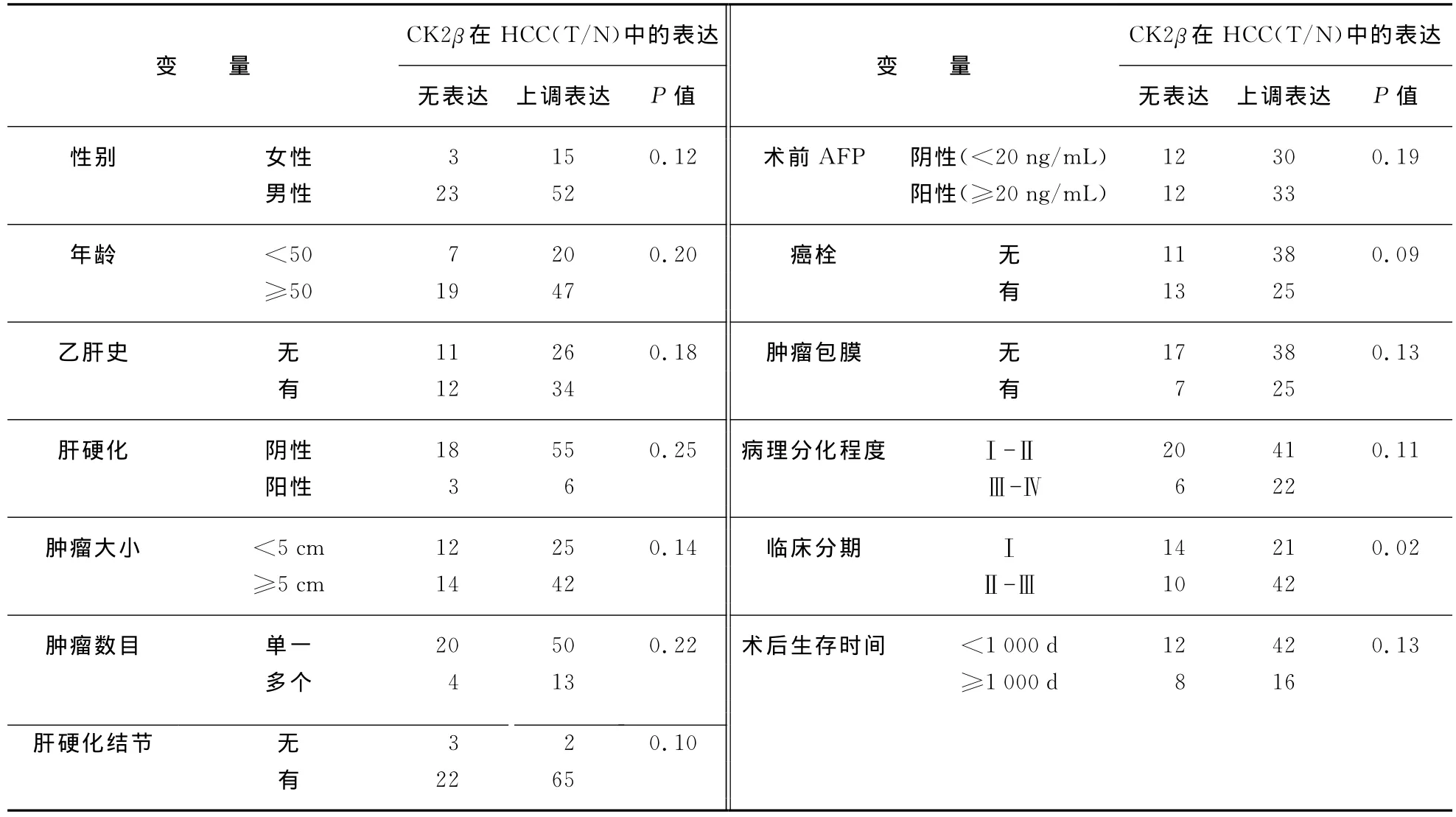
表1 CK2βmRNA水平在HCC中的表达与病理资料相关性分析Tab.1 The correlation between CK2βmRNA expression and clinical pathological data
2.2 CK2β在肝癌组织中的分布和表达情况及其与临床病理资料的相关性分析
对75对肝癌组织和相应的癌旁组织进行免疫组化检测,将CK2β的多克隆抗体以1∶50比例稀释,检测结果如下图所示(图2).随后对75对样本染色强弱进行了分级,0、+、++、+++分别代表染色强度弱、中等、强、较强.经过统计分析:在肝癌和癌旁组织中,CK2β在细胞核与细胞浆中均有表达,表达强度有所不同,CK2β在肝癌组织较之癌旁组织总体表达强度显著增高(P<0.01)(表2).这提示我们CK2β的表达强度的增高与肝癌的发生发展有显著性的关系.
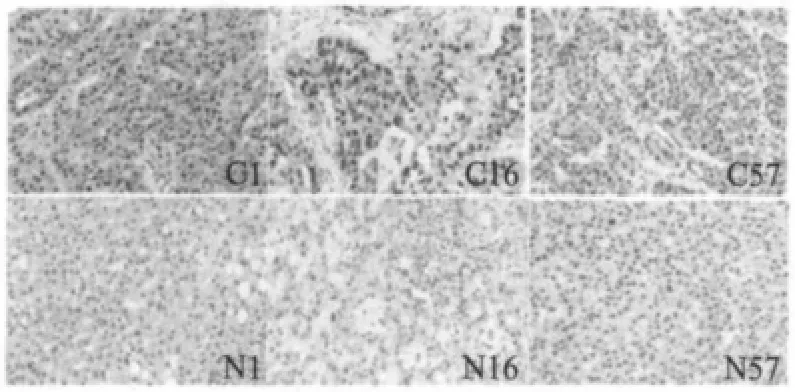
图2 CK2β在癌及癌旁中免疫组化检测结果Fig.2 The expression of CK2βby immunefluorescent
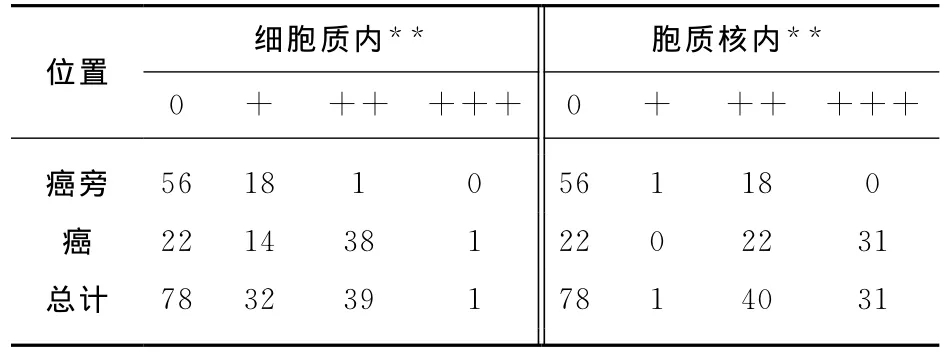
表2 75对肝癌及癌旁DAB染色分级统计分析表Tab.2 The analysis result of DAB staining of 75HCC cancer and adjacent cancer tissues
为了观察CK2β的表达变化是否对于临床诊断和治疗具有指导意义,我们将75对肝癌样品中CK2β的免疫组化染色强度与临床病例资料进行了相关性分析(表3).对细胞核内的染色强度分析得出:CK2β的表达与年龄(Age),是否小肝癌(Small hepatocellular carcinoma),病理分化程度具有相关性.卡方检验计算其P值分别为:0.02、0.03、0.01.其中与病理分化程度高度显著相关.对细胞浆内的染色强度分析得出:CK2β的表达与是否结节(Hepatic cirrhotic nodule)病理分化程度有相关性.卡方检验计算其P值分别为:0.02、0.04.结果显示无论在胞核染色还是胞浆染色中,CK2β的表达和病理分化程度均呈现显著相关性.
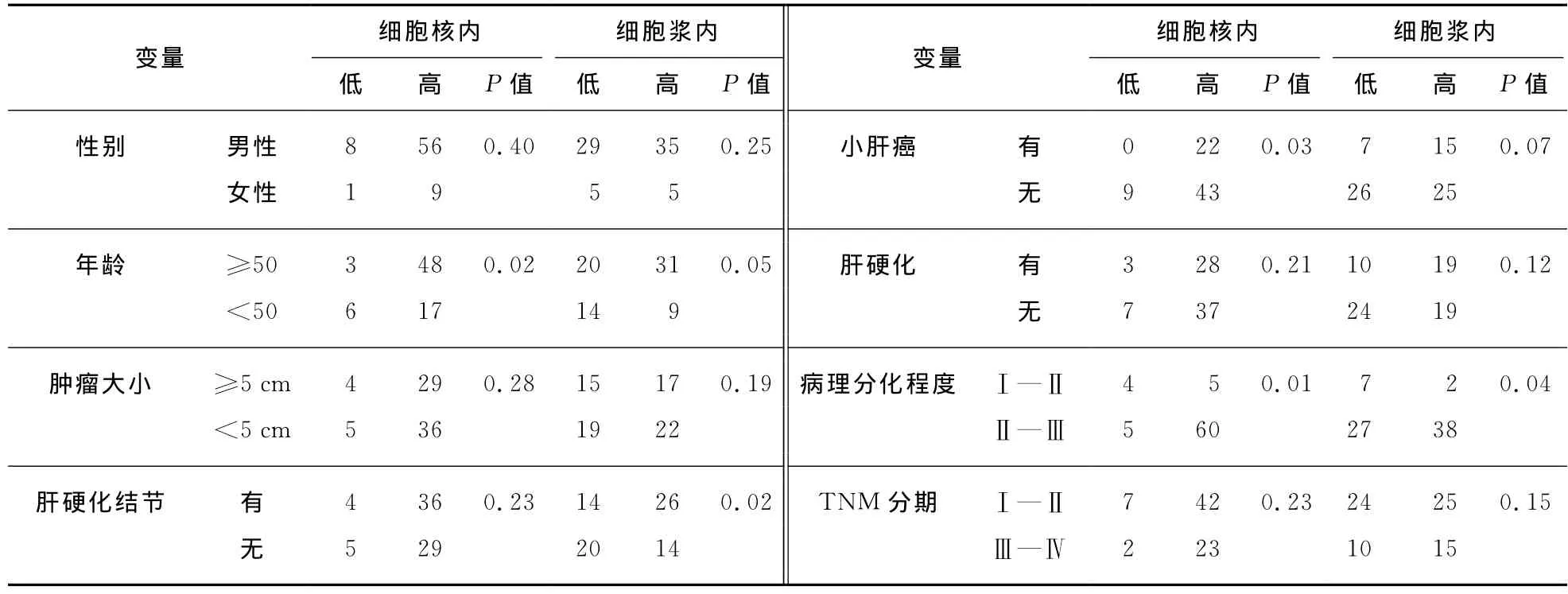
表3 CK2β染色强度与病理资料相关性分析Tab.3 The correlation between CK2βstaining degree and clinical pathological data
2.3 siRNA消减CK2β基因表达抑制细胞的生长
经siRNA小片段转染SMMC-7721细胞后,48h收集蛋白裂解液样.敲减内源CK2β的细胞裂解样品经检测后,在敲减片段作用下杂交条带强度与对照组相比,蛋白表达不同程度的减弱,结果显示该抗体能够准确识别该目的基因.因此从蛋白水平证实了敲减片段的有效性,细胞中的CK2β蛋白的表达被有效的抑制(图3(a)).
为了观察CK2β基因对细胞生长的生物学的影响,用经过有效性验证的CK2β的siRNA小片段转染SMMC-7721细胞.MTS实验结果如图3(b)显示,经过6天的连续检测,敲减掉内源的CK2β后,细胞的生长速度明显减慢.与对照转染Ns小片段的实验组和未转任何片段的non实验组相比,细胞从第4~5天起,增殖情况出现显著性差异,生长减缓(P<0.01).
克隆形成实验(图3-(c)),将SMMC-7721细胞接种于6孔板中,贴壁后,至40%~50%汇合度时,转染CK2β敲减siRNA片段1#2#,每组均种有3复孔.Control组为未转入任何片段组,Ns组为转入nonsilence片段的对照组.24h后,消化细胞,并计数.于6孔板中每孔种入1000个细胞.37℃培养箱中静置培养2周,期间每3天更换1次新鲜培养基.2周后结晶紫染色显示克隆的形成情况.瞬时敲减掉CK2β基因的克隆形成的大小和密度明显减小,克隆个数减少.实验结果显示敲CK2β除后能够明显抑制肝癌细胞中克隆的形成.
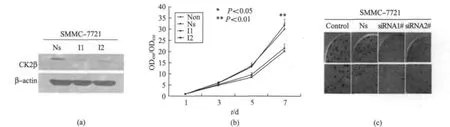
图3 消减CK2β表达后对细胞株生长的影响Fig.3 The effect on cell growth when downregulate the expression of CK2β
2.4 敲减CK2β表达减弱细胞株的迁移和侵袭能力
为研究CK2β对于细胞株迁移能力的影响,在SMMC-7721细胞中转染siRNA小片段24h后,消化细胞计数并种板,使细胞达到100%汇合度.细胞贴壁后更换无血清培养基饥饿细胞,24h后划痕,分别在0,24,48,72h时显微镜10倍镜下观察同一区域并拍照.如下图所示:NS为对照转染non-silence片段组,I1为转染1#敲减小片段实验组.结果显示实验组敲减掉CK2β,在48h后迁移的面积明显小于对照组(图4).细胞迁移区域有显著性差异,细胞迁移速度减慢.
2.5 消减CK2β表达丰度能够增强肝癌细胞对抗肿瘤药物的敏感性
CK2β在肝癌组织中明显的上调表达,并且能够促进肝癌细胞的生长增殖,因此可能在肝癌的发生发展和转移中起着重要的作用.那么消减CK2β是否能够增加肝癌细胞对抗肿瘤药物的敏感性,是否可能成为某种抗肿瘤药物或联合用药的潜在药物靶点?
用临床上常用的10种抗肿瘤药,将实验组分为四组:A转染non-silence片段,不加药;B转染nonsilence片段,加药;C转染CK2β消减siRNA片段,加药;D转染CK2β消减siRNA小片段,不加药组.48 h后用MTS方法检测.细胞相对存活率用后3组的数据除以对照组A组数据的平均数来计算.t-test结果显示(图5):相对于其他3组对照组,消减CK2β能够增强SMMC-7721细胞对于喜树碱,长春新碱,阿霉素和柔红霉素的敏感性.
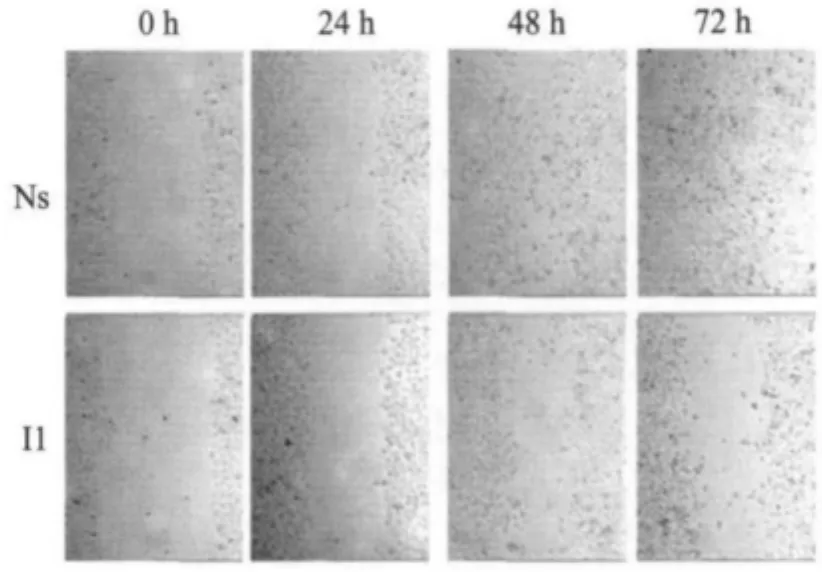
图4 划痕实验结果图Fig.4 The cell erasion trace test result
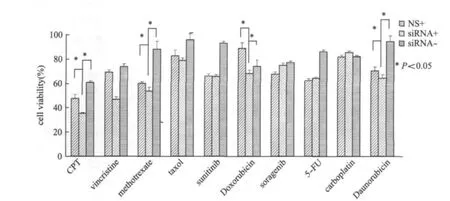
图5 10种抗肿瘤药物作用下细胞生存率效果图Fig.5 The cell viability after the treatment of 10different anti-cancer drugs
3 讨 论
目前对于CK2在肿瘤中的作用已有深入的研究.CK2的表达水平与活性的明显增高,不仅与肿瘤细胞扩散能力,癌症预后相关,还反映其病理生理学特征.
蛋白激酶CK2一直被认为是治疗肿瘤的一个具有潜力的分子靶点,目前已知的小分子抑制剂主要包括活性肽,卤代化合物TBB衍生物,多酚衍生物,以及以吲哚喹啉为基础的衍生物.其中CK2抑制剂CX4945已进入Ⅰ期临床,开始面向晚期实体瘤和多发性骨髓瘤患者.这些靶向CK2激酶的药物研究主要是设计针对CK2催化亚基的小分子抑制剂[26].由于长久以来研究者仅认识到CK2β存在于全酶中对催化亚基起靶向调节作用的功能,忽视了其独立于该复合物的功能,因而CK2β的研究一直比较粗浅,特别是缺少其在肿瘤中的功能性研究.近年来现在越来越多的研究开始关注CK2β独立于CK2激酶的功能,揭示了其更为重要和广泛的调节作用,它通过与c-Mos、Chk1、A-Raf等激酶直接互作调节其激酶活性,在细胞周期调控、DNA损伤修复等过程中发挥独特的生物学功能[7-10].
对于CK2β在肿瘤发生发展中的作用也逐渐引起研究者的重视.在血液系统肿瘤中:具有正常核型的急性髓细胞样白血病患者中,CK2抑制剂的敏感性与CK2β基因的表达水平密切负相关;慢性淋巴细胞白血病细胞的存活方面,抑制CK2β基因表达影响白血病细胞的存活率.在实体肿瘤中:Laramas等人的研究显示,男性前列腺癌中,针对CK2β的小干扰RNA能够特异性抑制前列腺细胞而对良性细胞没有作用.女性子宫内膜癌中CK2β的表达率和强度都明显升高,利用短发夹RNA(shRNA)下调CK2β,癌细胞的集落形成受阻.在宫颈癌,乳腺癌,头颈癌,神经胶质瘤,胃癌,非小细胞肺癌,结直肠癌中通过抑制CK2β的表达,都不同程度抑制癌细胞的生长[27,28],发挥重要功能.
CK2β在肝癌中的表达变化和功能研究尚属空白.本研究首先91对肝癌样本的CK2β的mRNA水平进行了检测,发现CK2β较癌旁组织显著性上调表达.对75对组织标本的免疫组化检测结果同样显示,较癌旁组织,CK2β蛋白水平表达明显上升,分析显示有显著性差异(P<0.01),胞浆和胞核中均显著性上调表达.这提示:CK2β可能在肝癌的发生和转移中行使一定的功能.
随后合成了针对CK2β的敲减小片段,从mRNA水平和蛋白水平验证了其具有明显的消减效果.瞬时消减SMMC-7721细胞内源的CK2β蛋白,经过MTS检测,细胞的生长速率显著性减慢.克隆形成的实验也相互佐证了该结果,在敲减掉CK2β的细胞株中,克隆形成的大小和个数有显著性差异,细胞生长和克隆形成减慢.在划痕实验中,瞬时消减SMMC-7721细胞内源的CK2β蛋白表达,48h及72h后开始可以观察到显著性差异,细胞迁移的速度减慢.这些都提示:CK2β与肝癌细胞的增殖和迁移能力有关.这些结果表明,CK2β在肝癌中显著上调表达,其表达量与临床分期呈正相关,提示其可能作为辅助肝癌诊断的分子marker.瞬时消减细胞内源的CK2β表达可以有效抑制肝癌细胞的增殖和迁移,提示CK2β是肝癌细胞快速增殖和迁移所必需的.将进一步在裸鼠成瘤动物模型上进一步验证其在体内对瘤体生长的影响.
本研究还就CK2β在肝癌中能否影响抗肿瘤药物对肝癌细胞的敏感性做了初步的探讨.发现CK2β的下调能够促进肝癌细胞对阿霉素,柔红霉素,喜树碱,长春新碱的敏感性.因喜树碱等药物通过参与DNA的损伤来发挥抑制肿瘤作用,而CK2β亦影响DNA的损伤与修复.因此猜测可能发挥协同的效应.但分子机制有待进一步的实验证明.长期以来,由于肝癌的治疗没有很有效的治疗药物,采用手术的切除率还不到15%,抗肝癌治疗至今处于技术有限,有效药物很少的困难境地.诺拉曲特(Nolatrexed)是目前唯一针对肝癌的处于三期临床研究阶段的化合物.因此开发有效的化疗药物应用于肝癌的治疗非常必要.由于传统的化疗药物如阿霉素,5-FU反应率低,选择性差,毒副作用较大,而用紫杉醇,氟达拉宾等药物进行全身化疗时的反应率几乎为零[1].因此寻找肝癌特异性的治疗靶点成为当前肝癌化疗药物开发的热点和难点.本研究不仅提示了CK2β作为新的抗肿瘤药物靶点的可能,并且为通过联合用药提高现有抗肿瘤药物药效的肿瘤治疗思路提供了新的线索.
[1]田学禄.肝癌治疗药物的研究新进展[J].中国药业,2009,18(24):64-66.
[2]胡琼莹,蒋建东.新的抗肝癌分子靶及相关药物研究[J].中国药理学通报,2005,2(1):2-5.
[3]Pallares J,Llober D.CK2βIs expressed in endometrial carcinoma and Has a role in apoptosis resistance and cell proliferation[J].Am J Pathol,2009,174(1):287-296.
[4]Yde C W,Olsen B B,Meek D,et al.The regulatory beta-subunit of protein kinase CK2regulates cell-cycle progression at the onset of mitosis[J].Oncogene,2008,27(37):4986-4997.
[5]Pinna L A.Protein kinase CK2:a challenge to canons[J].J Cell Sci,2002,115(20):3873-3878.
[6]Litchfield D W.Protein kinase CK2:structure,regulation and role in cellular decisions of life and death[J].Biochem J,2003,369(1):1-15.
[7]Volodina luL,Shtil A A.Casein kinase 2,the versatile regulator of cell survival[J].Mol Biol,2012,46(3):423-433.
[8]Gietz R D,Graham K C,Litchfield D W.Interactions between the subunits of casein kinase II[J].J Biol Chem,1995,270(22):13017-13021.
[9]刘振杰,刘新光,梁念慈.蛋白激酶CK2在细胞周期调控中的作用[J].中国药理学通报,2006,22(11):1281-1285.
[10]梁景耀,刘新光.蛋白激酶CK2与肿瘤发生[J].国外医学:生理病理科学与临床分册,2004,24(3):277-279.
[11]魏小华.蛋白激酶CK2在肿瘤生物学中的作用[J].医学综述,2011,17(1):75-77.
[12]Kikkawa U,Mann S K,Firtel R A,et al.Molecular cloning of casein kinase II alpha subunit from Dictyostelium discoideum and its expression in the life cycle[J].Mol Cell Biol,1992;12(12):5711-5723.
[13]Glover C V.On the physiological role of casein kinase II in Saccharomyces cerevisiae[J].Prog Nucleic Acid Res Mol Biol,1998,59:95-133.
[14]Boldyreff B,Mietens U,Issinger O G.Structure of protein kinase CK2:dimerization of the humanβsubunit[J].FEBS Lett,1996,379(2):153-156.
[15]Marin O,Meggio F,Sarno S,et al.Physical dissection of the structural elements responsible for regulatory properties and intersubunit interactions of protein kinase CK2β-subunit[J].Biochemistry,1997,36(23):7192-7198.
[16]Chantalat L,Leroy D,Filhol O,et al.Crystal structure of the human protein kinase CK2regulatory subunit reveals its zinc finger-mediated dimerization[J].EMBO J,1999,18(11):2930-2940.
[17]Graham K C,Litchfield D W.The regulatoryβ-subunit of protein kinase CK2mediates formation of tetrameric CK2complexes[J].J Biol Chem,2000,275(7):5003-5010.
[18]Bjørling-Poulsen M,Siehler S,Wiesmüller L,et al.The regulatoryβ-subunit of protein kinase CK2 negatively influences p53-mediated allosteric effects on Chk2 activation[J].Oncogene,2005,24(40):6194-6200.
[19]阮 杰,王菲菲,刘新光,等.蛋白激酶CK2βsiRNA对肺腺癌细胞A549增殖的抑制作用[J].中国肿瘤临床,2009,36(12):10.
[20]郭 澍,孙长伏,王玉新.蛋白激酶CK2β在腺样囊性癌肺转移细胞中的表达及意义[J].中国肿瘤临床,2007,17(4):536-538.
[21]French A C,Luscher B,Litchfield D W.Development of a stabilized form of the regulatory CK2βsubunit that inhibits cell proliferation[J].J Biol Chem,2007,282(40):29667-29677.
[22]Deshiere A,Duchemin-Pelletier E,Spreux E,et al.Regulation of epithelial to mesenchymal transition:CK2βon stage[J].Mol Cell Biochem,2011,356(1-2):11-20.
[23]Olsen B B,Guerra B.Ability of CK2βto selectively regulate cellular protein kinases[J].Mol Cell Biochem,2008,316(1-2):115-126.
[24]Yde C W,Olsen B B,Meek D,et al.The regulatoryβ-subunit of proteinkinase CK2regulates cell-cycle progression the onset of mitosis[J].Oncogene,2008,27(37):4986-4997.
[25]Pinna L A,Meggio F.Protein kinase CK2(“casein kinase-2”)and its implication in cell division and proliferation[J].Prog Cell Cycle Res,1997,3:77-97.
[26]许维恒,张俊平.蛋白激酶CK2抑制剂的研究进展[J].国际药学研究杂志,2012,39(2):143-145.
[27]黄轶轩,周少华,薛洪省.蛋白激酶CK2与人类恶性肿瘤[J].中国肺癌杂志,2009,201(7):439-441.
[28]Daya-Makin M,Sanghera J S,Mogentale T L,et al.Activation of a tumour-associated protein kinase(p40TAK)and casein kinase II in human squamous cell carcinomas and adencarcinomas of the lung[J].Cancer Res,1994,54(8):2262-2268.
