油茶EMF2基因的全长cDNA克隆及序列分析
2013-04-04邬萌萌谭晓风詹文勇胡孝义
邬萌萌,谭晓风 ,周 荣,詹文勇 ,胡孝义
(1.安徽农业大学 林学与园林学院,安徽 合肥 230036;2.中南林业科技大学 经济林育种与栽培国家林业局重点实验室,湖南 长沙 410004;3.安徽省油茶良种工程技术研究中心,安徽 舒城 231340)
油茶Camellia oleifera是我国重要的木本油料树种[1],广泛分布于我国南方各省区[2]。油茶秋季开花,春季果实才开始膨大,这期间缺少昆虫等传粉媒介,这对其坐果率有一定的影响[3]。因此,改变油茶的花期对于油茶生产具有重大意义。EMF2(EMBRYONIC FLOWER2)基因是植物抑制开花而维持正常营养生长的一个应激基因。当EMF2基因的抑制作用解除后,植物才能实现营养生长向生殖生长的转变[4-5]。有关研究者发现,EMF2基因编码PcG蛋白复合物的一个亚基,该复合物能引发许多与开花相关基因的抑制基因位点的核小体组蛋白H3K27me3(组蛋白H3的N端第27位赖氨酸的3甲基化)水平[6-7]。H3K27me3标记由PRC2复合物引发,被PRC1样复合物识别并维持[8-10],它们的功能缺失都能减弱或消除H3K27me3,导致幼嫩的芽苗也能够分化出花器官。因此,有关CoEMF2的研究对于油茶开花机理的研究具有重要意义。拟南芥EMF2蛋白正是PRC2复合物的核心组件[11],而目前有关油茶EMF2基因的研究尚未见诸报道。为此,笔者基于茶树Camellia sinensis EMF2同源基因的一个片段,采用 3′RACE(RACE System for Rapid Amplification of cDNA Ends) 和 5′RACE技术对CoEMF2 基因的全长cDNA进行克隆,同时对基因全长和编码蛋白进行序列分析与理化性质研究,结果发现了CoEMF2蛋白中含有VEFS-Box结构域和C2H2型锌指蛋白两个保守区,这为油茶从芽到开花的诱导的进一步研究提出了新思路。
1 材料和方法
1.1 材 料
实验所用材料为“华鑫”油茶的组织培养幼苗[12],来自中南林业科技大学经济林育种与栽培国家林业局重点实验室。
1.2 方 法
1.2.1 油茶叶片的总RNA提取及反转录
采用Invitrogen的总RNA提取Kit(12183-018),并加入CTAB(Cetyltrimethyl Ammonium Bromide上海生工生物工程有限公司),以裂解法提取油茶叶片的总RNA,再用Invitrogen的RACE Kit(18373-019)、(18374-058)进行反转录。
1.2.2 特异引物设计及RACE扩增
参照茶树Camellia sinensis EMF2基因的一个片段,设计3′RACE和5′RACE的首轮及巢式特异引物(见表1)。

表1 特异引物序列Table 1 Sequence of special primers
PCR反应体系(25 μL):5×HS PCR Buffer(Mg+plus)5.0 μL,dDTP Mixture(2.5 mM) 2.0 μL,primer(10 μM)0.5 μL,AUAP(10 μM)0.5 μL,模版 1.0 μL,PrimerSTAR HS DNA Polymerase 0.25 μL,灭菌蒸馏水15.75 μL。
PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,分别在72、70、68 ℃下退火30 s,72 ℃延伸80 s,每个退火温度各循环5次;94 ℃变性30 s,65 ℃下退火30 s,72 ℃延伸80 s,20个循环;最后72 ℃延伸8 min,4 ℃下保存。
电泳检测巢式PCR结果,采用Ambiogen公司的Puprep Gel Extraction Kit回收和纯化目的条带,连接于TransGen公司的pEASYTM-Blunt Zero Cloning Vector载体后,转化DH5α感受态,于37 ℃下培养,挑选单菌落进行菌液PCR检测,并将含有目的片段的阳性克隆送至博尚公司测序。
1.2.3 目的基因的全长cDNA克隆及分析
将测序得到的EMF2基因3′端和5′端序列进行拼接,并在NCBI网站上进行比对,获得油茶EMF2基因的全长cDNA序列。利用Vector NTI软件获得油茶EMF2基因理论上的开放读码框,并进行氨基酸序列比对;用AnthePro5.0软件对蛋白跨膜结构进行预测;在网址http://www.expasy.org/cgi-bin/protscale.pl上分析和预测蛋白的亲疏水性;采用网址http://www.predictprotein.org/分析蛋白质二级结构;在网址http://cello.life.nctu.edu.tw上进行亚细胞定位预测。
2 结 果
2.1 油茶叶片总RNA的提取结果
油茶叶片总RNA提取后的电泳检测结果如图1所示。图1显示,28 S与18 S条带清晰明亮,两者的总亮度约处于2∶1的状态中,符合反转录和RCAE的实验要求。

图1 油茶叶片总RNA提取结果Fig.1 Detection of total RNA in C. oleifera leaf
2.2 目的基因的 3′RACE 与 5′RACE
3′RACE首轮PCR电泳检测结果显示,虽然有两个大小不同的条带,但经巢式PCR扩增后,检测到的仅有单一清晰的条带,约900 bp,进一步进行巢式PCR验证,结果与预计的相符(如图2左所示)。5′RACE产物目的条带十分明亮,约1 700 bp,如图2右所示。

图2 3′RACE产物与5′RACE产物的电泳图Fig.2 Electrophoresis distribution of 3′RACE and 5′RACE products
2.3 CoEMF2基因的全长cDNA序列分析
3′RACE 和 5′RACE 测 序 得 到 892 和 1 801 bp的片段,将二者进行拼接,获得序列2 210 bp(如图3所示,图3的方框为起始和终止密码子,下划线为PolyA尾),包含1个完整的1 866 bp CDS 及 37 bp 5′UTR 和 307 bp 3′UTR,编码621个氨基酸。将其与其它物种EMF2氨基酸序列进行在线比对,结果发现,其与茶树、葡萄、毛果杨的同源性分别高达97%、80%、81%。因此推测,该序列为油茶EMF2基因的全长cDNA序列。
通过NCBI在线比对后发现,油茶EMF2蛋白含有一个高度保守的VEFS-Box家族区域(如图4所示)。其中VEFS是VRN2-EMF2-FIS2-Su(z)12的简称,VRN2(VERNALIZATION2)为春化作用相关基因[13]、FIS2(FERTILIZATION INDEPENDENT SEEDS2)是胚乳发育相关基因[14]、Su(z)12是染色质表达及精细胞形成的相关基因[15]。
与其它植物该蛋白质序列进行系统树分析,结果如图5所示。图5表明,油茶与茶树EMF2的亲缘关系最接近,在氨基酸序列和保守元件VEFS-Box上也极为相似。根据上述分析结果可以初步断定,所获得的序列为油茶EMF2基因的全长cDNA序列,并命之名为CoEMF2。

图3 油茶EMF2基因的全长cDNAFig.3 Full-length cDNA sequence of C.oleifera EMF2 gene

图4 油茶EMF2蛋白的保守结构域Fig.4 Conserved domains in C. oleifera EMF2 protein

图5 油茶与其它物种EMF2的亲缘进化关系Fig.5 Phylegenetic tree of EMF2 in C. oleifera and other species
2.4 理化性质分析与结构预测
借助在线软件分析预测蛋白质的理化性质:CoEMF2的ORF编码621个氨基酸,分子量为70.54 KD;等电点为6.17,其中负电荷氨基酸残基(Asp+Glu)的数目为78,正电荷氨基酸残基(Arg+Lys)的数目为70;分子式可写成C3108H4875N867O936S37;不稳定系数为53.04,属于不稳定蛋白质。
疏水性的分析结果如图6所示。图6表明,CoEMF2蛋白的疏水指数从-2.733到2.978(横坐标为氨基酸顺序,纵坐标为亲、疏水值;“-”表示亲水性,“+”表示疏水性),疏水区大于亲水区,因此推测,CoEMF2为疏水性蛋白。该蛋白有两个跨膜区域:分别位于N端的137~153位,方向由外向内;C端的573~591位,跨膜方向由内向外(如图7所示)。
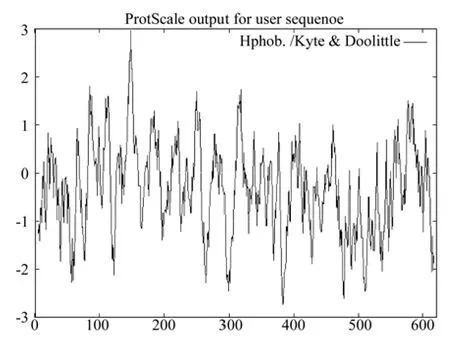
图6 油茶EMF2蛋白质疏水性分析结果Fig.6 Hydrophobicity analysis of C. oleifera EMF2 protein

图7 油茶EMF2蛋白跨膜区预测结果Fig.7 Prediction on membrane-spanning region in C. oleifera EMF2 protein
卷曲螺旋预测结果表明,CoEMF2蛋白质中可能存在8个较为明显的螺旋结构。Predictprotein软件预测的CoEMF2蛋白的二级结构如图8所示。图8中,H表示α螺旋,E表示β折叠,L表示无规则卷曲。该蛋白α螺旋结构为21.74%,β折叠10.95%,无规则卷曲及其它结构67.31%。CoEMF2蛋白的312-333位氨基酸处存在一个C2H2型锌指蛋白(Zinc finger protein),该蛋白依靠其指型空间结构伸入到DNA双螺旋的大沟内,通过α螺旋与DNA的碱基形成特异性接触[16],有助于PRC2复合体结合到染色质上,进而对染色质进行标记修饰。
2.5 亚细胞定位和修饰位点预测
在http://cello.life.nctu.edu.tw网址上对CoEMF2进行亚细胞定位预测,结果见表2。由表2可知,其位于细胞核中的可靠性最高。运用KinasePhos软件在线对CoEMF2蛋白序列修饰位点进行预测,结果表明了含有55个丝氨酸激酶、25个苏氨酸激酶、15个酪氨酸激酶潜在磷酸化位点、1个组氨酸磷酸化位点,这说明该蛋白被磷酸化修饰的可能性很大。

图8 油茶EMF2蛋白质二级结构的预测结果Fig.8 Secondary structure predictions in C. oleifera EMF2 protein
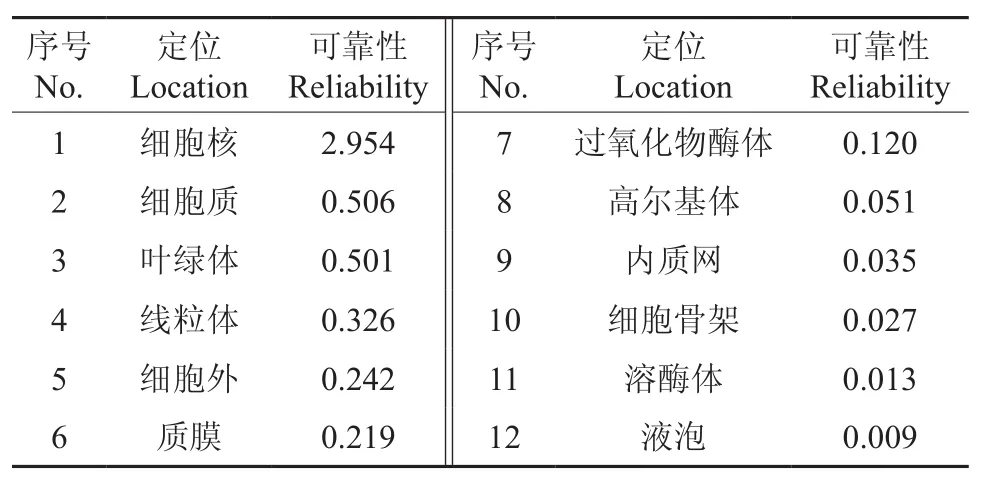
表2 油茶CoEMF2基因亚细胞定位预测结果Table 2 Prediction on subcellular localization in C. oleifera CoEMF2
3 结论与讨论
本研究克隆了CoEMF2基因,并利用生物信息学方法对其进行了分析,结果表明:开放阅读框为1 866 bp,编码621个氨基酸,蛋白分子量为70.54 kD,其为不稳定的疏水性蛋白。亚细胞定位预测结果表明,CoEMF2位于细胞核中,这与CoEMF2对于染色质进行H3K27me3的功能执行是相一致的。
实验中发现,CoEMF2蛋白中含有两个保守区:VEFS-Box结构域和C2H2型锌指蛋白。CoEMF2蛋白具有VEFS-Box家族基因的保守域结构特征:通过抑制AP1(APETALA1)、CAL(CAULIFLOWER)、FUL(FRUITFULL)等基因的作用从而抑制植物开花[17-18]。同时,VEFS-Box结构域很可能结合锌指蛋白一起参与到油茶开花的转录调节过程中。由于CoEMF2基因在结构和功能上与Su(z)12基因相似,编码PcG蛋白复合体,而PcG蛋白复合体的下游靶基因中,有开花同源基因AG(AGAMOUS)、AP3(APETALA3)和PI(PISTILLATA)[19-20],所以推测,CoEMF2也会通过对染色质进行标记修饰(例如H3K27me3)来实施对这些下游基因表达的调控,进而控制营养细胞向生殖细胞转化[21]。
CoEMF2参与组成的PRC2复合物催化H3K27me3的形成,并抑制靶基因的转录。若能在体细胞胚培养过程中减弱或消除H3K27me3标记,就可能会增强胚性基因的表达,从而提高脂肪酸生物合成相关基因的表达水平[22-23]。因此,本研究不仅为今后有关油茶从芽到开花的诱导问题的进一步研究提出了新的思路,也为研究油茶愈伤组织的成脂效应奠定了基础。
参考文献:
[1] 刘 凯,谭晓风,龙洪旭,等.油茶DGATl基因的全长cDNA序列克隆及分析[J].中南林业科技大学学报, 2012,32(4): 148 - 152.
[2] 中南林学院.经济林栽培[M].北京:中国林业出版社,1983:127-135.
[3] 胡孝义.油茶种子活性氧相关基因的克隆及树体RNA干扰技术研究[D].长沙:中南林业科技大学, 2009.
[4] 齐飞艳,陈媛文,张 颖,等.毛竹EMF2类基因原核表达条件优化[J].分子植物育种,2012, 10(4):485-489.
[5] 胡 波.茶树成花相关基因的cDNA克隆及生物信息学分析[D].福州:福建农林大学,2010.
[6] Holec S, F B. Polycomb group complexes mediate developmental transitions in plants[J]. Plant Physiology, 2012,158:35 - 43.
[7] Schwartz YB, V P. Polycomb silencing mechanisms and the management of genomic programmes[J]. Nature Reviews Genetics, 2007, 8(1):9 - 22.
[8] Lafos M, Kroll P, Hohenstatt ML,et al. Dynamic Regulation of H3K27 Trimethylation duringArabidopsisDifferentiation[J].Plos Genetics, 2011,7(4):134 - 139.
[9] Zheng BL, XM C. Dynamics of histone H3 lysine 27 trimethylation in plant development[J]. Current Opinion in Plant Biology, 2011, 14(2):123 - 129.
[10] Chanvivattana Y, Bishopp A, Schubert D,et al.Interaction of Polycomb-group proteins controlling flowering inArabidopsis[J].Development, 2004,131:5263 - 5276.
[11] Bouyer D, Roudier F, Heese M,et al. Polycomb Repressive Complex 2 Controls the Embryo-to-Seedling Phase Transition[J].Plos Genetics, 2011,7(3):1 - 19.
[12] 范晓明.油茶组织培养技术研究[D].长沙:中南林业科技大学,2011.
[13] Wood CC, Robertson M, Tanner G,et al. TheArabidopsis thalianavernalization response requires a polycomb-like protein complex that also includes VERNALIZATION INSENSITIVE 3[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006,103(39):14631 - 14636.
[14] Luo M, Bilodeau P, Koltunow A,et al.Genes controlling fertilization-independent seed development inArabidopsis thaliana[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(1): 196 - 301.
[15] Pasini D, Bracken AP, Hansen JB,et al.The polycomb group protein Suz12 is required for embryonic stem cell differentiation[J]. Molecular and Cellular Biology, 2007, 27(10):3769-3779.
[16] 黄 骥,王建飞,张红生.植物C2H2型锌指蛋白的结构与功能 [J]. HEREDITAS,2004,26(3): 414 - 418.
[17] Chen L J, Diao Z Y, Specht C,et al.Molecular evolution of VEF-domain-containing PcG genes in plants[J]. Plant and Cell Physiology, 2009, 2:738 - 754.
[18] Pien S, U G, Polycomb group and trithorax group proteins inArabidopsis[J]. Biochimica Et Biophysica Acta-Gene Structure and Expression, 2008, 1769(5 - 6):375 - 382.
[19] Moon Y H, Chen L J, Pan R L,et al. EMF genes maintain vegetative development by repressing the flower program inArabidopsis[J]. Plant Cell, 2003, 15:681 - 693.
[20] Meunier J, Khelifi A, Navratil V,et al.Homology-dependent methylation in primate repetitive DNA[J]. Pro Natl Acad Sci USA, 2005, 102: 5471 - 5476.
[21] Calonje M, R SZ. Complexity beneath the silence [J]. Curr Opin Plant Biol, 2006:530 - 537.
[22] Jiang DH, Wang YQ, Wang YZ,et al. Repression of FLOWERING LOCUS C and FLOWERING LOCUS T by theArabidopsisPolycomb Repressive Complex 2 Components[J].Plos One, 2008, 3(10):163 - 168.
[23] 谭晓风,张党权,陈鸿鹏,等.油茶查尔酮合酶和异构酶基因的cDNA克隆[J].中南林业科技大学学报,2007,27(1):9-13.
