自发性高血压大鼠和Wistar大鼠脑动脉平滑肌细胞膜电流的比较*
2013-03-30尚媛媛司军强李新芝张忠双马克涛
赵 磊,尚媛媛,司军强,李新芝,李 丽,张忠双,马克涛Δ
(1.石河子大学医学院新疆地方与民族高发病教育部重点实验室,2.生理学教研室,3.病理生理学教研室,新疆石河子832002)
以脑卒中为主的脑血管病是影响人类健康的主要疾病,高血压是被公认的脑卒中最重要的独立危险因素。众所周知,血管紧张度增加是高血压发病的关键,而微动脉和小动脉的肌源性张力是血管外周阻力及血压形成的重要因素[1]。高血压所致的颅内大、小动脉结构和功能的改变是脑卒中发生的基础,在这一过程中,血管平滑肌细胞(vascular smooth muscle cells,VSMCs)内的离子有着非常重要的作用。VSMCs膜上的离子通道对离子的异常转运起重要作用。研究发现,包括脑动脉(brain artery,BA)在内的VSMCs上有Ca2+通道、K+通道、Cl-通道和非选择性阳离子通道等多种离子通道的表达[2]。高血压发展过程中,这些离子通道有可能发生变化,从而引起细胞内离子浓度的异常,导致血管结构和功能的改变。本研究通过比较研究自发性高血压大鼠(spontaneously hypertensive rats,SHR)和正常 Wistar大鼠脑动脉平滑肌细胞膜电流的异同,进一步阐述高血压形成机制。
1 材料及方法
1.1 实验动物
实验选用36周龄SHR大鼠及正常血压Wistar大鼠,雌雄不拘,体重在(200~250)g,分别购自北京维通利华实验动物有限责任公司(许可证编号SCXK京2007-0001)和新疆医科大学实验动物中心。用BP-6无创血压监测仪测量大鼠清醒安静状态下尾动脉的血压。
1.2 标本制备
大鼠在麻醉状况下放血处死,迅速取出脑,置于生理盐溶液中,溶液成分如下(mmol/L):NaCl 138,KCl 5,CaCl21.6,MgCl21.2,Na-HEPES5,HEPES6,葡萄糖 7.5。在生理盐溶液中,迅速取出 BA及其分支。
单个平滑肌细胞制备:将微动脉放置低Ca2+缓冲液中 20 min,低 Ca2+缓冲液成分为(mmol/L):NaCl 142、KCl 5、CaCl20.05、MgCl21、Na-HEPES 4、HEPES 5、葡萄糖7.5。在体显微镜下将微动脉剪成几段放入消化液中,在37℃温箱中消化20~25 min,消化液成分包括(mg/ml):木瓜蛋白酶 0.75、胶原酶 IA 1、牛血清白蛋白 3.75、二硫苏糖醇 0.3。离心(1 000 r/min,6 min)后弃上清液用低 Ca2+溶液替代,如此反复替换三次后,将液体移至用多聚赖氨酸处理过的培养皿上静置30 min使细胞贴壁。
1.3 全细胞膜片钳记录
在室温条件下(22℃~25℃)使用Axon 700B放大器(Axon公司,美国)进行全细胞膜片钳实验。记录电极尖端直径约为1μm,电极阻抗约为5 MΩ,由P-97拉制仪(Sutter公司,美国)拉制。电极内液成分是(mmol/L):K-gluconate 130,NaCl 10,CaCl22.0,Mg-Cl21.2,HEPES 10,EGTA 5,葡萄糖 7.5。通过微操纵器接触到细胞后给予负压形成GΩ封接。补偿电极电容后给予瞬时较强负压或者电刺激击破细胞膜形成全细胞膜片钳。膜电流用10 kHz低频滤过。生物电信号通过 PC计算机记录(Axoscope10.2软件,Axon公司,美国)。采样间隔为 10、20或 100 μs[3,4]。
1.4 主要试剂
所用药物用生理盐溶液配制,加药通过切换开关控制,能保持灌流速度、温度和其它成分不变。所用药物有:4-aminopyridine(4-AP)、tetraethylammonium(TEA)由Sigma公司提供。其余试剂均为国产分析纯试剂。
1.5 统计方法
应用SPSS16.0分析软件,实验结果以均数±标准(¯x±s)表示,组间比较采用 t检验。
2 结果
2.1 SHR和Wistar大鼠尾动脉血压的比较
SHR大鼠的收缩压为(189.3±6.7)mmHg,明显高于正常 Wistar大鼠的收缩压(117.6±5.4)mmHg(P<0.01)。
2.2 SHR和Wistar大鼠脑动脉平滑肌细胞电流密度的异同
图1所示为应用阶跃电压激活的SHR和Wistar大鼠脑动脉平滑肌细胞全细胞膜电流的异同。当指令电压为+60 mV时,Wistar大鼠脑动脉平滑肌细胞电流幅度为(530±66)pA(n=35),电流密度为(44.3±6.0)pA/pF;SHR平滑肌细胞电流幅度为(1825±299)pA(n=35),电流密度为 (148.1±25.8)pA/pF。当指令电压为0、+20、+40和+60 mV时,SHR和Wistar大鼠脑动脉平滑肌细胞的电流密度存在统计学差异(P<0.01)。
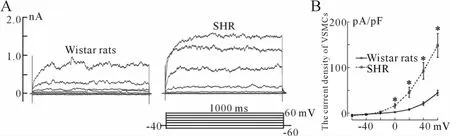
Fig.1 Comparison of the current density of VSMCs in BA between SHR and Wistar rats VSMCs:Vascular smooth muscle cells;BA:Brain artery;SHR:Spontaneously hypertensive rats*P<0.01 vs Wistar
SHR和Wistar大鼠脑动脉平滑肌细胞细胞膜电流都呈明显的外向整流特性。电压依赖的K+通道(voltage-gated K+channel,Kv)阻断剂 4-AP(1 mmol/L)和大电导钙激活K+通道(big conductance Ca2+-activated K+channel,BKCa)阻断剂 TEA(1 mmol/L)对微动脉平滑肌细胞的外向电流敏感(图2),提示SHR和Wistar大鼠脑动脉平滑肌细胞的外向电流部分主要是通过激活Kv通道和BKCa通道介导。
2.3 SHR和Wistar大鼠脑动脉平滑肌细胞STOCs的异同
34%(18/53)SHR和 22%(10/45)Wistar大鼠脑动脉平滑肌细胞上都记录到了自发性瞬时外向K+电流(spontaneous transient outward currents,STOCs),与Wistar大鼠相比,SHR的STOCs发放频率和电流幅度都远大于 Wistar大鼠(图3)。Wistar大鼠 STOCs的幅度及频率(+40 mV)分别为(217±24)pA和(0.54±0.05)Hz,SHR STOCs的幅度及频率分别为(423±57)pA和(0.83±0.07)Hz(n=16),分别增加了(57.2±14.3)% 和(64.3±16.8)%。

Fig.2 Outward current of VSMCs in BA of SHR and Wistar rats are composed by Kv and BKCaA-B:1 mmol/L TEA and 1 mmol/L 4-APpartly inhibited the outward current respectively;Kv:Voltage-gated K+ channel;BKCa:Big conductance Ca2+-activated K+ channel
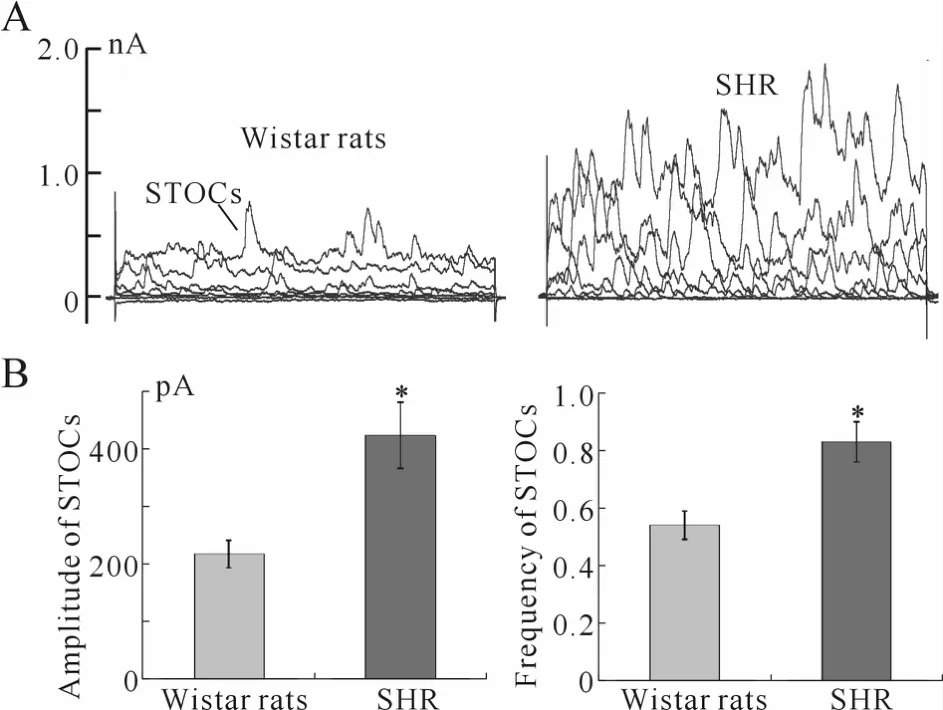
Fig.3 Comparison of the STOCs of VSMCs in BA between SHR and Wistar rats A:Representative STOCs of VSMCs in BA of SHRand Wistar rats;B:Column graph presentation of the frequency and amplitude of STOCs in BA of SHR and Wistar rats;STOCs:Spontaneous transient outward K+ currents;SHR:Spontaneously hypertensive rats;BA:Brain artery*P<0.05 vs Wistar
为了进一步验证STOCs的性质,观察了1 mmol/L BKCa通道阻断剂TEA和1 mmol/L Kv通道阻断剂4-AP对STOCs的影响,TEA基本完全阻断STOCs,而4-AP对STOCs没有影响(图4),提示 SHR和 Wistar大鼠脑动脉平滑肌细胞上记录到得STOCs由BKCa通道介导。
3 讨论
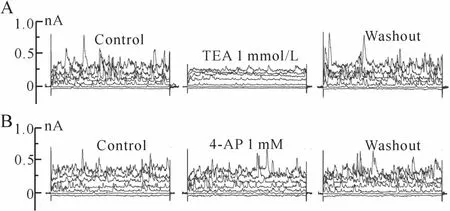
Fig.4 STOCs of VSMCs mediated by BKCa A and B:1 mmol/L TEA almostly inhibited the STOCs,but not by 4-AP;STOCs:Spontaneous transient outward K+ current;VSMCs:Vascular smooth muscle cells;BKCa:Big conductance Ca2+-activated K+ channel;4-AP:4-aminopyridine
在血管平滑肌细胞上主要表达四种K+通道,分别是内向整流K+通道、ATP敏感K+通道、Kv和BKCa[5]。它们通过影响 VSMCs的膜电位调节血管的张力及直径,同时受多种血管活性物质的调节。本研究发现在SHR和Wistar大鼠BA上平滑肌细胞的外向电流由Kv和BKCa组成,但两种平滑肌细胞的电流密度存在差异,SHR平滑肌细胞BKCa通道电流明显高于正常大鼠。有研究发现在SHR的主动脉、颈动脉及下肢动脉都存在BKCa通道的活性增强,且构成BKCa通道的β1亚基的mRNA和蛋白的表达都高于正常大鼠[6],本实验结果与之一致。SHR平滑肌细胞上BKCa通道活性增强可能是由于电压依赖性Ca2+通道开放导致的细胞内游离Ca2+浓度升高所致[7]。
BKCa通道由膜去极化和细胞内钙离子所激活,通过对膜去极化和血管收缩的负反馈调节维持血管张力。BKCa通道受多种血管活性物质(NO、前列腺素、内皮素和血管紧张素II等)的调节,通道活性及电流大小直接影响到血管的舒缩功能[8]。BKCa通道活性改变可引起细胞内信号转导、细胞的兴奋及代谢调节等多种生理过程,其功能异常牵涉到高血压等疾病的发生[9]。高血压时平滑肌细胞肌源性张力增高与其去极化状态有关,作为阻力血管的脑动脉,平滑肌细胞静息膜电位改变与高血压的发生更具有相关性。
此外,本实验在SHR和Wistar大鼠BA平滑肌细胞上成功记录到STOCs,且SHR的STOCs发放频率和电流幅度都远大于Wistar大鼠,两种平滑肌细胞上的STOCs都是由BKCa通道介导。STOCs发生起源于BKCa通道激活,与胞膜上10~100个左右的BKCa通道的同步开放相一致,低频率的STOCs(1 Hz)即可明显影响膜电位,平滑肌舒张。越来越多的研究表明由BKCa通道介导的STOCs在血管平滑肌的肌源性调节中发挥重要作用,Jaggar JH[10]等研究发现平滑肌细胞肌浆网钙库的开放可产生钙火花,引起细胞内局部、瞬时的[Ca2+]升高,进而激活细胞膜上BKCa通道,产生 STOCs。STOCs可进一步引起细胞膜超极化,抑制经L型电压依赖性Ca2+通道的Ca2+内流,负反馈调节平滑肌收缩。
总的来说,本实验采用全细胞膜片钳技术发现SHR和Wistar大鼠BA平滑肌细胞的电流密度存在差异,SHR平滑肌细胞BKCa通道电流明显增强,且更易诱发由 BKCa通道介导的 STOCs。BKCa通道和STOCs介导的K+外流引起血管平滑肌细胞超极化,血管舒张,降低外周血管阻力,反馈性的抑制血管张力,可能是阻止血压升高的保护机制。
[1] Segal S S.Regulation of blood flow in the microcirculation[J].Microcirculation,2005,12(1):33-45.
[2] Firth A L,Remillard CV,Yuan JX.TRP channels in hypertension[J].Biochim Biophys Acta,2007,1772(8):895-906.
[3] Ma K T,Guan B C,Yang Y Q,et al.2-Aminoethoxydiphenyl borate blocks electrical coupling and inhibits voltagegated K+channels in guinea pig arteriole cells[J].Am J Physiol Heart Circ Physiol,2011,300(1):H335-346.
[4] 马克涛,李新芝,李 丽,等.豚鼠不同部位微动脉平滑肌细胞电生理学特性的比较[J].生理学报,2010,62(5):421-426.
[5] Ko E A,Han J,Jung I D,et al.Physiological roles of K+channels in vascular smooth muscle cells[J].JSmooth Muscle Res,2008,44(2):65-81.
[6] 郑冬冬,杨向军,宋建平,等.高血压大鼠冠状动脉平滑肌细胞大电导钙激活钾通道的变化[J].中国心脏起搏与电生理杂志,2010,24(2):162-166.
[7] Park W S,Son Y K,Kim N.Acute hypoxia induces vasodilation and increases coronary blood flow by activating inward rectifier K(+)channels[J].Pflugers Arch,2007,454(6):1023-1030.
[8] Lam R S,Shaw A R,Duszyk M.Membrane cholesterol content modulates activation of BK channels in colonic epithelia[J].Biochimic Biophys Acta,2004,1667(2):241-248.
[9] Gouas L,Nicaud V,Berthet M,et al.Association of KCNQ1,KCNE1,KCNH2 and SCN5A polymorphisms with QTc interval length in a healthy population[J].Eur J Hum Genet,2005,13(11):1213-1222.
[10] Jaggar J H,Porter V A,Lederer W J,et al.Calcium sparks in smooth muscle[J].Am J Physiol cell physiol,2000,278(2):C235-256.
