人源性发酵乳杆菌f5降解大鼠胆固醇的研究
2013-03-20黄玉军梁文星陈大卫顾瑞霞
黄玉军 梁文星 刘 冬 陈大卫 顾瑞霞
(扬州大学江苏乳品生物技术与安全控制重点实验室,江苏 扬州 225009)
流行病学和临床研究的结果[1]表明:人体胆固醇含量与心血管疾病之间存在着显著的正相关。世界卫生组织(WHO)预测[2],至2030年,将有近2 360万人将死于心血管疾病。虽然药物治疗有一定的疗效,但也有一些副作用。因此,人们试图寻找更多的安全途径来治疗高胆固醇血症。
益生菌是一类能够对人体健康起到促进作用的活体微生物。迄今为止,已发现其具有多种生物活性[3,4],其中降低血清胆固醇水平是其重要的生理活性之一。自从1963年Shaper[5]和Mann等[6]发现L.acidophilus 发 酵 酸 奶 对 非 洲部落成年男性血清胆固醇水平具有潜在的调节功能后,对具有降解胆固醇益生菌的筛选及作用机理的研究变得越来越广泛。近年来,研究者已从动物肠道及传统发酵制品中筛选出了许多具有降胆固醇功能的菌株,主要包括嗜酸乳杆菌、植物乳杆菌、罗伊氏乳杆菌、瑞士乳杆菌、加氏乳杆菌、屎肠球菌、长双歧杆菌和乳双歧杆菌等[7-9]。2000年5个国际研究机构对丹麦 MD 食品公司生产的Gaio 酸奶(由E.faecium 和St.thermophilus 混合发酵)进行了降胆固醇性能研究[10],结果显示Gaio酸奶对人体血清TC 和LDL-C水平的降低幅度分别达4%和5%,这些研究结果为预防和治疗高血脂症等疾病提出了新的理念和可能途径。
本课题组前期已通过人工模拟胃、肠道环境,从江苏如皋长寿人群肠道中筛选出一株耐酸、耐胆盐及体外降胆固醇能力较好的乳酸菌。本试验主要研究该菌在大鼠体内的降胆固醇特性,为乳酸菌的人体临床试验奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
试验菌株:分离自江苏如皋长寿人群肠道的发酵乳杆菌(Lactobacillus fermentum )。
1.1.2 主要试剂
脱脂乳粉、浓磷酸、浓硫酸、无水乙醇、氯化钙、三氯化铁、甲醇、氯仿、胆固醇、Trition-100、石油醚等:分析纯,国药集团化学试剂有限公司;
总胆汁酸试剂盒:南京建成生物工程研究所。
1.2 主要试验仪器
可见光分光光度计:722 型,上海精密科学仪器有限公司;
超声波细胞粉碎机:SCIENZ-ⅡD 型,宁波新芝生物科技股份有限公司;
数显恒温水浴锅:HH-6型,国华电器有限公司;
生化培养箱:WS2-134-75型,上海新苗医疗器械制造有限公司;
高速冷冻离心机:5804R 型,德国Eppendorf公司;
生化培养箱:WS2-134-75型,上海新苗医疗器械制造有限公司;
全自动灭菌锅:JF-SX-500型,日本Tomy公司;
酶标仪:Bio-Tek ELX800型,美国宝特公司;
透射电子显微镜:Tecnai 12型,荷兰Philips公司。
1.3 灌胃菌液的制备
(1)菌悬液组:将活化三代的菌株以5%接种量接种于2L MRS液体培养基中,培养24h;将培养液4 000r/min离心5min,收集菌体于10%脱脂乳中,用生理盐水稀释至108,107,106CFU/mL 作 为 高、中、低 浓 度 的 菌 液 进 行 灌胃[11],根据大鼠体重进行灌胃,灌胃量为2.0mL/100g。
(2)发 酵 乳 组:按4% (V/V)的 量 接 种 到 脱 脂 乳 中37 ℃发酵6h 后灌胃,根据大鼠体重进行灌胃,灌胃量为2.0mL/100g。
1.4 试验动物分组及饲养
初断乳雄性3周龄SPF 级Wistar大鼠,由扬州大学比较医学中心提供,合格证:SCXK(苏)2007-0001;基础饲料、高脂饲料均由江苏省协同医药生物工程有限责任公司提供;大鼠饲养及试验均在本院实验动物房内进行,动物房保持通风、透光和清洁卫生,大鼠每天自由进食、进水。
Wistar大鼠雌雄各30只,普通饲料适应性饲养4d后,随机分为8组,每组10只。按照表1的方案,连续28d在上午对大鼠灌胃,参考《保健食品检验与评价技术规范(2003年版)》建立高脂血症大鼠模型。
1.5 样本处理
1.5.1 血清处理 大鼠最后一次灌胃后禁食12h,摘眼球取血,血液室温放置60min,3 000r/min 离心10~15 min,取上清液分装于塑料试管中,置-20 ℃冰箱,备用。

表1 试验动物分组及饲养方式Table1 Animal grouping and feeding styles
1.5.2 肝匀浆制备 大鼠颈椎脱臼处死,迅速摘取肝脏左叶在预冷的生理盐水中漂洗数次,滤纸吸干,称取0.8g左右的组织块,加入约为组织块重量9倍的预冷生理盐水充分研碎,制成10%肝组织匀浆。
1.5.3 粪便中胆汁酸的提取 在试验的最后3d,每天随机收集各试验组的粪便,烘干至恒重;取2g干粪用无水乙醇80 ℃提取3次,置旋转蒸发仪40~50 ℃蒸干,加入石油醚,充分混匀,留沉淀;用含2% Trition-100的乙醇溶解沉淀,取上层液,再在水浴锅中80 ℃蒸干得沉淀,最后用蒸馏水溶解,即为提取的粪胆汁酸溶液。
1.6 测定指标和方法
1.6.1 血清TC、TG、HDL-C 和LDL-C 的测定 将冷藏血清送扬州中医院血液检验科检验,并按式(1)、(2)计算动脉粥样硬化指数及抗动脉粥样硬化指数。

式中:
AI—— 动脉粥样硬化指数;
AAI—— 抗动脉粥样硬化指数;
TC—— 血清总胆固醇,mmol/L;
HDL-C—— 高密度脂蛋白,mmol/L。
1.6.2 粪便中胆汁酸的测定 用总胆汁酸试剂盒测定总胆汁酸含量[12]。
1.6.3 肝脏和粪便中胆固醇含量的测定 取0.1mL 肝匀浆 加 入4.9mL 无 水 乙 醇 混 匀,室 温 放 置10 min,4 000r/min离心10min,取上清2mL加入磷硫铁2mL 显色,560nm 波长下测各样本吸收值。
取0.3g 粉末状的干燥粪便,用甲醇与氯仿(2∶1)的混合物定 容 至3 mL,45 ℃水 浴1h 后,8 000r/min 离 心10min,取上清0.2mL加入3.8mL无水乙醇混匀,取2mL溶液加入2 mL 磷硫铁显色,560nm 波长下测各样本吸收值。
1.6.4 透射电镜标本制备 取大鼠肝左叶和心脏相同部位,戊二醛固定,Epon 812、环氧树脂包埋,切成5μm 薄片,醋酸铀、硝酸铅双层染色后电镜透射观察肝脏、心脏切片[13,14]。
1.6.5 试验数据分析与统计 应用SPSS 19.0 系统统计软件对各试验数据进行方差分析,在P<0.05 的水平下,进行显著性检验。
2 结果与分析
2.1 f5菌株对各组大鼠脏器系数的影响
试验期间,各组小鼠毛色光洁、食欲正常、精神活跃,未出现异常体征,未发生自然死亡。小鼠体质量及肝、肾、心、脾与体质量的百分比见表2。
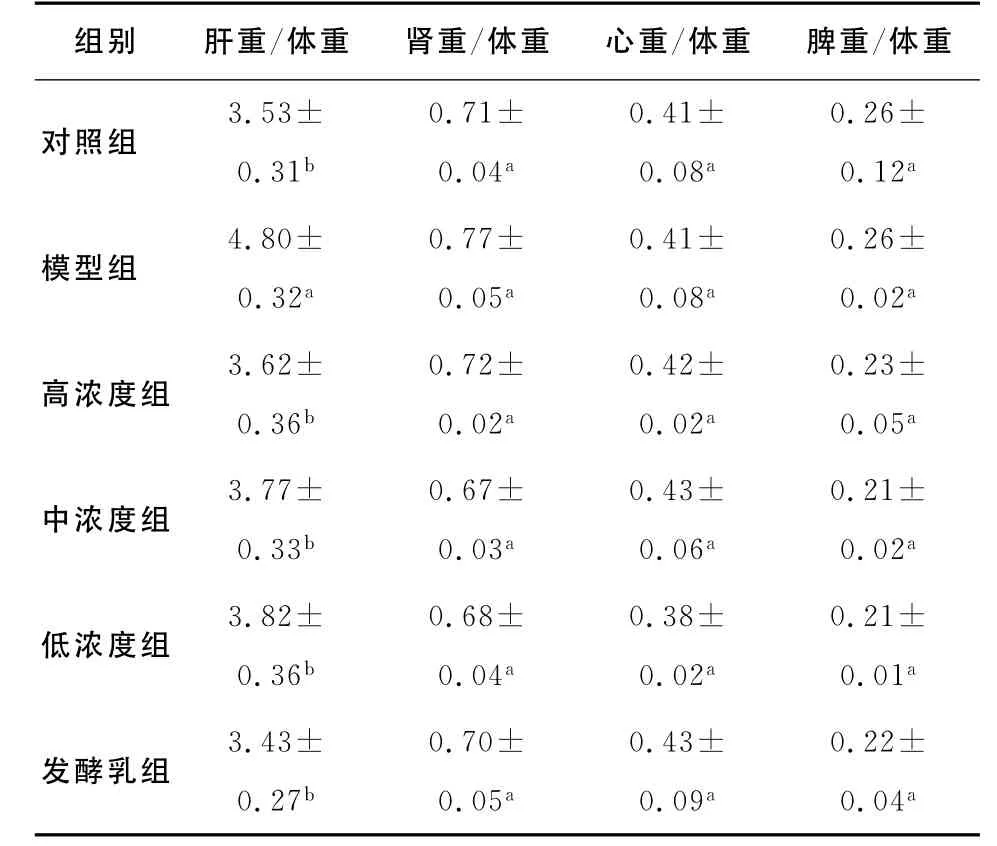
表2 f5菌株对大鼠体质量及脏器质量与体质量比的影响Table2 Effect of strain f5on body weight and viscera weight of rats with hyperlipemia(x±sd,n =10) /(10-2 g·g-1 )
正常试验动物各脏器与体重的比值较为恒定,而当动物脏器病变后,受损脏器重量可能发生改变,故脏体比也随之发生改变。脏体比增大,表示脏器可能已经充血、水肿或增生等;脏体比减小,表示脏器已经萎缩或发生其它改变。
由表2可知,与对照组相比,模型组的脏器与体重的比值显著增高(P<0.05),这说明了高胆固醇饲料的喂养使脂肪在大鼠肝脏上堆积,造成了肝脏重量增加。不同剂量的菌悬液组和发酵乳组与模型组相比,具有显著性差异(P<0.05),而与对照组相比无显著性差异(P>0.05),表明菌株能够有效地降低肝脏脂肪的堆积。各组间的肾脏、心脏、脾脏的脏器系数数无显著性差异(P>0.05),说明菌株未使试验动物脏器产生病变。
2.2 f5菌株对高脂血症大鼠血脂的影响
由表3可知,与模型组相比,高、中、低浓度组和发酵乳组的TC 和TG 的浓度都有所下降;其中高浓度组和发酵乳组与模型组相比,有显著性差异(P<0.05),中、低剂量组的TC和TG 水平也有所降低,但与模型组相比,无显著性差异(P>0.05)。
与模型组相比,灌胃组的LDL-C 都显著下降(P<0.05),剂量越高,效果越显著;在整个试验中,HDL-C 都保持着相对比较稳定,没有显著性升高和降低,这与谢宁的乳酸杆菌对高脂饮食大鼠胆固醇影响的研究结果[15]一致,饲喂高脂饲料大鼠的HDL-C 比饲喂普通饲料的HDL-C 浓度高,这可能是由大鼠体内血清总胆固醇升高引起的,因为HDL-C在生理上起着将肝外组织的胆固醇运送到肝脏内部的作用,因此,当游离胆固醇在肝外组织细胞上沉积时,HDL-C就会增多,以防止其沉积。
与模型组相比,灌胃组的AI、AAI指数都有所下降,其中高、中浓度组和发酵乳组有显著性差异(P<0.05),但是低浓度组差异性不显著(P>0.05),表明f5菌株的高、中浓度菌悬液组和其发酵乳皆具有一定的调节血脂的功效,对于预防心血管疾病具有显著效果。
2.3 f5菌株对大鼠肝脏中胆固醇含量的影响
肝脏可以将胆固醇转化为胆汁酸,经肠道排出体外。由表4可知,模型组肝脏中的胆固醇含量显著高于对照组(P<0.05),说明喂养高脂饲料使肝脏中胆固醇含量增高;高、中浓度组和发酵乳组的肝脏胆固醇含量显著低于模型组(P<0.05),说明菌株f5 对大鼠的肝脏分解胆固醇具有促进作用,能够通过肝脏将胆固醇转化和分解。

表3 f5菌株对大鼠血脂的影响Table3 Effect of strain f5on blood lipids in rats(x±sd,n =10)

表4 肝脏中胆固醇的含量Table4 The content of liver cholesterol(x±sd,n =10)
2.4 f5菌株对大鼠粪便中胆固醇和胆汁酸含量的影响
由表5可知,与对照组相比,模型组的粪便胆固醇和胆汁酸含量均有显著性差异(P<0.05),灌胃后,高、中浓度组和发酵乳组的粪便胆固醇和胆汁酸的含量都有明显升高(P<0.05),说明体内胆固醇的降解可以通过形成粪便排泄出体外,也可以形成胆汁酸排出体外。

表5 粪便中胆固醇和胆汁酸的含量Table5 The contents of cholesterol and bile acid in feces(x±sd,n =10) /(mg·g-1 )
2.5 对不同组别大鼠肝脏、心脏切片的观察
不同组别肝脏组织切片如图1所示,对照组中肝脏组织中无脂肪变性,肝脏的整体结构正常,肝细胞呈索状排列,在中央静脉周围呈放射状分布;模型组中的脂肪泡明显比正常组多,密度颗粒都比较大。在相同的放大倍数下,可发现高浓度组脂肪颗粒明显下降,几乎接近对照组;而低浓度组中肝脏细胞中的脂肪空泡仍然较多。
不同组别心脏组织切片如图2所示,对照组中心肌纤维组织排列整齐,且线粒体均匀分布,无细胞膜破裂,模型组中线粒体明显增多,且聚集在一起,线粒体增多可能由于缺氧造成,高胆固醇可能引起心血管堵塞而造成供氧不足;高浓度组中肌纤维排列整齐,且线粒体较高脂组有明显降低,且均匀分布在肌纤维中;低浓度组中线粒体比较多,分布较杂乱,进一步导致了嵴断裂。

图1 肝脏组织切片电镜透视图(×650 000)Figure1 Transmission electron microscope photos ofrats liver slice

图2 心脏组织切片电镜透视图(×650 000)Figure2 Transmission electron microscope photos ofrats heart slice
3 结论
同化作用和共沉淀作用是乳酸菌体外降胆固醇水平的两个重要机制[16,17]。而对体内研究应从胆固醇在体内的代谢平衡角度加以考察,即从胆固醇的合成与降解两个方面来研究。本研究认为发酵乳杆菌能通过促进粪便排泄来降解大鼠体内胆固醇的含量。当然,与模型组相比,试验菌株的发酵乳及高浓度菌悬液能显著降低大鼠的LDL-C、TC、TG水平及AI、AAI指数和大鼠肝脏的胆固醇含量(P<0.05),但与对照组相比,改善效果并不明显,这可能是由于干预各组饲料均为高脂饲料,大鼠体内胆固醇合成速度大于乳酸菌降解速度;通过电镜透视还发现,高浓度的菌悬液能促进模型组大鼠心脏肌纤维的整齐排列、线粒体的均匀分布,且肝脏脂肪颗粒几乎接近对照组。后续研究中将重点研究乳酸菌降低血清胆固醇的生化机理及对降解途径的影响。
1 Liong M T,Shah N P.Acid and bile tolerance and cholesterol removal ability of Lactobacilli strains[J].J.Dairy Sci.,2005,88(1):55~66.
2 World Health Organization.Cardiovascular disease:technical report of world health organization[R].Geneva:WHO,2012.
3 Yeo S K,Liong M T.Angiotensin I-converting enzyme inhibitory activity and bioconversion of isoflavones by probiotics in soymilk supplemented with prebiotics[J].Int.J.Food Sci.Nutr.,2010,61(2):161~181.
4 Ouwehand A C.Antiallergic effects of probiotics[J].J.Nutr.,2007,137(3):794~797.
5 Shaper A G,Kyobe J,Jones K W,et al.Serum lipidsin 3nomadic tribes of northern Kenya[J].American Journalof Clinical Nutrition,1963,13(3):135~146.
6 Mann G V,Spoerry A.Studies of a surfactant and cholesteremia in the maasai[J].American Journal of Clinical Nutrition,1974,27(5):464~469.
7 Scholz-Ahrens K E,Ade P,Marten B,et al.Prebiotics,probiotics and synbiotics affect mineral absorption,bone mineral content and bone structure[J].J.Nutr.,2007,137(3):838~846.
8 Baharav E,Mor F,Halpern M,et al.Lactobacillus GG bacteria ameliorate arthritis in lewis rats[J].J.Nutr,2004,134(8):1 964~1 969.
9 Falagas M E,Betsi G I.Probiotics for prevention of recurrent vulvovaginal candidiasis:a review[J].J.Antimicrob.Chemother,2006,58(2):266~272.
10 Agerholm-Larsen L,Bell M L,Grunwald G K,et al.The effect of a probiotic milk product on plasma cholesterol:A meta-analysis of short-term intervention studies[J].European Journal of Clinical Nutrition,2000,54(11):856~860.
11 严玉婷,潘道东.发酵乳杆菌SM-7的筛选及对小鼠降胆固醇作用[J].食品科学,2010,31(9):224~228.
12 邓正辉,张华,李龙平.生化试剂对胆汁酸测定的交叉污染及防范措施[J].中国实用医药,2008(10):55~56.
13 马瑞琼,张书永,张卫光,等.实验性肝纤维化大鼠胶原网络构筑的扫描电镜观察[J].解剖学报,2004,35(3):302~305.
14 Oht ani O.The maceration technique in scanning electron microscopy of collagen fiber frameworks:its application in the study of human livers[J].Arch.Histol.Cytol.,1992,55(Suppl):225~232.
15 谢宁.两株乳酸杆菌对高脂饮食大鼠胆固醇影响及相关机制研究[D].长沙:中南大学湘雅二医院,2011.
16 Noh D O,Kim S H,Gilliland S E.Incorporation of cholesterol into the cell membrance of Lactobacillus acidophilus ATCC43121[J].J.Dairy Sci.,1997,80(12):3 107~3 113.
17 Tannock G M,Tangerman A,Schaik A V,et al.Deconjugation of bile acids by lactobacilli in the mouse small bowel[J].Appl.Environ.Microbiol,1994,60(9):3 419~3 420.
