β-谷甾醇与γ-谷维素键合特征的红外光谱分析
2013-03-19池建伟
池建伟 李 阳 张 虹 胡 鹏 傅 红
(福州大学生物科学与工程学院1,福州 350108)
(丰益(上海)生物技术研发中心有限公司2,上海 200137)
甾醇类化合物在生物体内发挥重要的调节和控制作用,植物甾醇可以抑制以胆固醇为代表的动物甾醇在人体肠腔内的水解和再酯化,并作为竞争者降低饱和脂肪代谢过程中形成的胆固醇数量,从而减少膳食中动物甾醇和饱和脂肪对人体高血脂、糖尿病、心脑血管疾病的不利影响[1-4]。其中,β-谷甾醇和γ-谷维素可以明显降低血浆中低密度脂蛋白(LDL)及胆固醇量,没有毒副作用,并且γ-谷维素还具有调节中枢神经以及内分泌等多种生理活性功能[5-10]。因此,它们在许多国家被允许作为新资源食品或食品添加剂[11-13]。
近年的国外研究表明,β-谷甾醇与γ-谷维素的混合物在纯油相中可以形成牢固透明的凝胶,甚至在某些条件下形成自组装的晶体形态[14-17]。按照分子结构形成所需最低能量原则推测,由于β-谷甾醇与γ-谷维素的甾醇单元分别位于结构的一端,而γ-谷维素的阿魏酸位于结构的伸出部位,其轻微的楔形结构为弯曲的超分子结构留下空间[17],这为β-谷甾醇与γ-谷维素可能通过分子间氢键并进一步形成自组装的晶体状网络结构提供了一定的理论依据。但是,至今国内外的研究对晶体结构的形成机理缺乏有效的分析验证。本试验建立了傅里叶红外光谱法表征β-谷甾醇与γ-谷维素氢键形成的方法,用偏光显微镜下观察其在油脂体系中的晶体形态,并对其质构特性做了初步的探索。
1 材料与方法
1.1 原料与试剂
β-谷甾醇标准品:上海晶纯试剂有限公司;γ-谷维素标准品:日本东京化成工业株式会社;大豆油等植物油脂:嘉里特种油脂(上海)有限公司。
1.2 仪器与设备
BK-POL偏光显微镜:奥特光学仪器有限公司;YP802N电子天平:上海精科实业有限公司;尼高力360智能型傅里叶红外光谱仪:美国尼高力仪器公司;HJ-4A多头加热磁力搅拌器:国华仪器有限公司;DC0506W恒温水浴锅:上海方瑞仪器有限公司;TA-XT2质构仪:英国 Stable Micro System公司;WZR锥入度:上海精密科学实验有限公司。
1.3 试验方法
1.3.1 样品的傅里叶红外光谱分析
1.3.1.1 β-谷甾醇和γ-谷维素样品准备
将β-谷甾醇标准样品在150℃下加热至完全溶解,γ-谷维素标准样品在170℃下加热至完全溶解,分别缓慢冷却至室温,研磨备用。
1.3.1.2 β-谷甾醇和γ-谷维素物理混合物样品准备
按照1.3.1.1的方法,分别将研磨好的β-谷甾醇与γ-谷维素进行充分的物理混合,备用。
1.3.1.3 β-谷甾醇和γ-谷维素化合物熔融样品准备
按一定比例混合β-谷甾醇和γ-谷维素样品,在170℃下加热至完全熔融,缓慢冷却至室温,备用。
1.3.1.4 傅里叶红外光谱分析
研磨以上各备用干燥样品,与200 mg纯KBr研细混合至粒度小于2μm,在油压机上压成透明薄片,用于傅里叶红外光谱仪分析。
1.3.2 样品结晶形态的偏振光显微镜分析
1.3.2.1 β-谷甾醇和γ-谷维素的油相样品
按一定比例混合β-谷甾醇和γ-谷维素的样品,定量加入植物油脂中,于70℃水浴下溶解,不断缓慢搅拌成透明黄色,冷却至室温,放置在4℃的恒温培养箱中24 h以上,至结构稳定呈现透明的凝胶状。
1.3.2.2 样品晶体形态分析
取适量样品分别于载玻片上,盖上盖玻片,压成均匀薄片后用连接Canon数码相机的偏振光显微镜观察样品的结晶形态,观察温度为25℃,显微镜放大倍数为200。
1.3.3 质构分析
用质构仪TPA2模式,以直径为5 mm的探头(P/5)测样品硬度值。测试前速度:1.0 mm/s;测试速度:3.0 mm/s;测试后速度:3.0 mm/s;1次距离:10.0 mm;2次距离 10.0 mm;间隔时间:5.00 s。
1.3.4 锥入度值分析
将样品放于圆形容器内,启动锥入度计5 s以后,读取锥入深度值(mm)。
2 结果与讨论
2.1 β-谷甾醇与γ-谷维素的键合特征分析
通过分子官能团吸收峰的变化特征,红外光谱法成为表征氢键形成效应的有效手段之一。在红外光谱中,当分子间氢键增强时,形成氢键的羟基基团的伸缩振动吸收峰将向低波数位移,并导致谱带变宽[18-19]。
β-谷甾醇和γ-谷维素的分子结构分别如图1所示,β-谷甾醇以环戊烷全氢菲为骨架(又称甾核),分子内有一个羟基基团在箭头A所指位置上;γ-谷维素是阿魏酸与植物甾醇的结合脂,分子内的羰基在箭头B所指位置上[14,17]。从氢键的形成机理分析,β-谷甾醇可以通过羟基(R—O—H)与γ-谷维素中电负性强的羰基(—C=O)氧原子,形成分子间氢键R—O—H…O—R′。
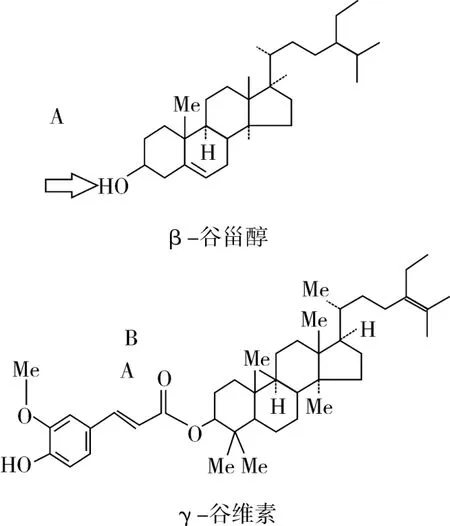
图1 β-谷甾醇与γ-谷维素的分子结构式
图2是β-谷甾醇和γ-谷维素的红外光谱图。可见图2a中β-谷甾醇的—OH伸缩振动的特征吸收峰,其波数在3 440.84 cm-1,图2b中γ-谷维素的羰基特征伸缩振动的吸收峰在1 710.49 cm-1。
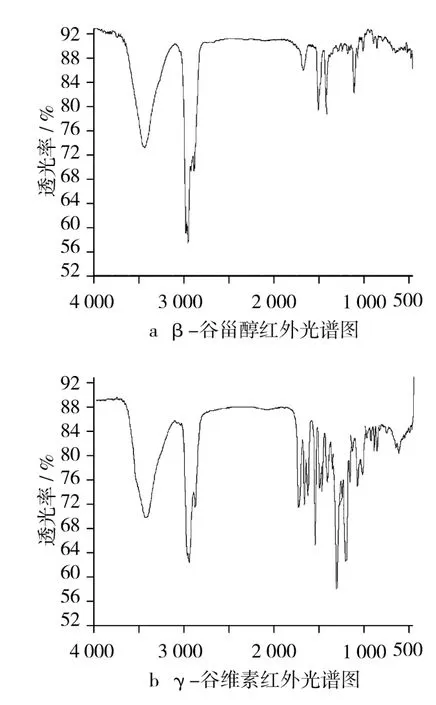
图2 β-谷甾醇与γ-谷维素红外光谱图
分子间氢键形成的程度和样品的浓度有关[15-16]。对比不同配比的β-谷甾醇与γ-谷维素键合的红外光谱,结果如图3所示。
图3显示了不同配比的β-谷甾醇和γ-谷维素化合物的红外光谱图,其中β-谷甾醇的—OH伸缩振动峰和γ-谷维素的羰基吸收峰均出现了程度不等的低波数位移,而其他分子官能团特征吸收峰则没有出现位移。
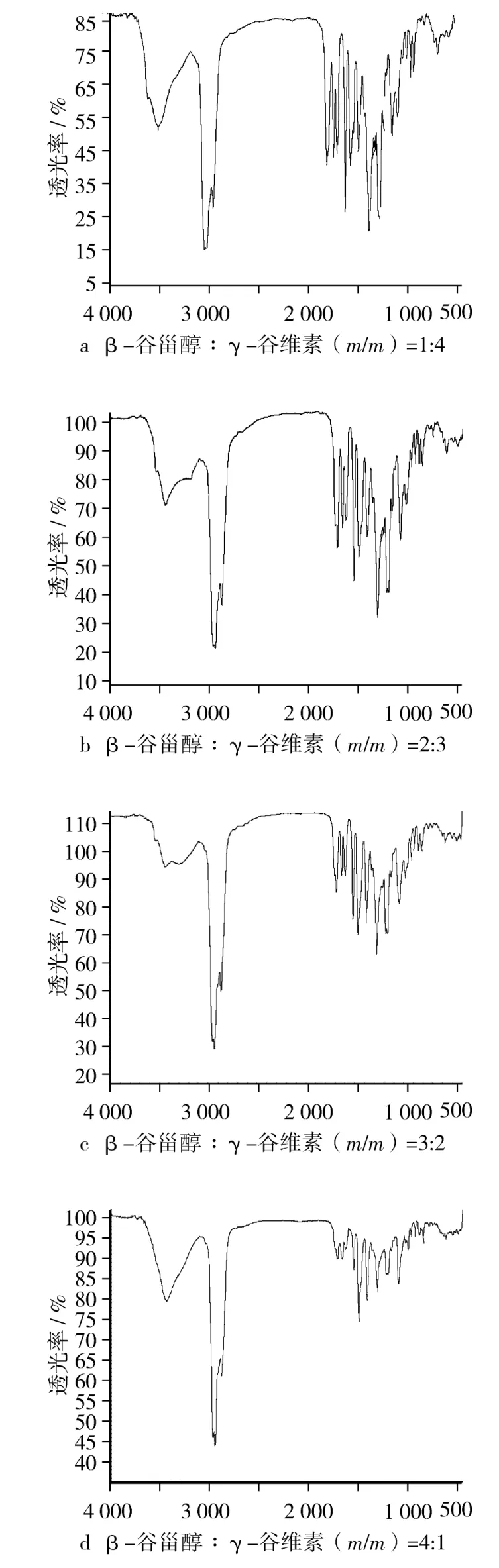
图3 不同配比的β-谷甾醇和γ-谷维素化合物的红外光谱图
如图3a和图3d所示,当β-谷甾醇与γ-谷维素(m/m)1∶4和4∶1时,β-谷甾醇的羟基伸缩振动峰向低波数位移程度较少;当β-谷甾醇与γ-谷维素(m/m)为3∶2时,如图3c,β-谷甾醇的羟基伸缩振动吸收峰出现明显的低波数移动,从图1a的3 440.18 cm-1移到3 301.25 cm-1;尤其在 β-谷甾醇与γ-谷维素(m/m)2:3时,如图3b所示,β-谷甾醇的羟基伸缩振动峰向低波数移动的程度最大,其红外吸收峰的波数为3 145.68 cm-1。
从图3可知,β-谷甾醇的羟基伸缩振动峰向低波数移动,表明β-谷甾醇分子内的羟基和γ-谷维素电负性较强的羰基上氧原子产生了分子间氢键;当β-谷甾醇与γ-谷维素的比例不同时,发生的氢键效应强弱不同,β-谷甾醇的羟基伸缩振动峰位移程度也不同;当β-谷甾醇与γ-谷维素质量比在2:3时,β-谷甾醇的羟基伸缩振动峰向低波数移动最显著,暗示此时分子间的氢键效应最大。
β-谷甾醇的分子质量为415 u,γ-谷维素的分子质量大约为600 u,当它们配比为2∶3时,β-谷甾醇和γ-谷维素的分子摩尔比大约为1∶1,在此情况下,一分子β-谷甾醇和一分子γ-谷维素可以形成最大氢键键合比率,氢键效应最显著。
β-谷甾醇与γ-谷维素粉末物理混合物的红外光谱图如图4,和图3比较,可以看出β-谷甾醇—OH伸缩振动吸收峰与γ-谷维素羰基伸缩振动吸收峰没有发生位移。由此可以说明,β-谷甾醇与γ-谷维素的氢键键合红外图谱不同于其物理混合物。

图4 β-谷甾醇与γ-谷维素物理混合物红外光谱
2.2 β-谷甾醇与γ-谷维素的自组装体系结晶态特征
将β-谷甾醇、γ-谷维素以及它们的键合物,按照相同的添加总量溶解在植物油脂体系中,用偏振光显微镜观察它们所形成晶体的大小和形态,如图5、图6所示。
β-谷甾醇在油相中的晶体形态,如图5a所示,呈现均匀分散、大小一致的长形管束状,晶体长度约为21.0μm。γ-谷维素在油相中呈透明态,图5b为其在油相中偏振光显微镜图像,可以看出γ-谷维素完全溶解在油相中,无结晶体产生。

图5 β-谷甾醇和γ-谷维素在油相中的偏振光显微镜图像
图6为一系列的β-谷甾醇和γ-谷维素自组装键合物,以不同配比溶解到油相中。从偏光显微镜图像可以看出,它们的结晶形态有明显的差异。


图6 不同配比的β-谷甾醇和γ谷维素(m/m)偏振光显微镜图像
当β-谷甾醇和γ谷维素的添加比例为1∶4时,如图6a所示,油相中只有分布均匀的、极为细小的点状晶粒,没有看到其他形态的晶体。这是因为在此体系下,难以独立成晶的γ谷维素的比例远高于β-谷甾醇,使油相中β-谷甾醇的分散程度加大,相应减少了β-谷甾醇晶核的聚集和继续生长,导致油相中的晶体未能成型。
但是,当β-谷甾醇和γ谷维素的添加比例达到2:3时,如图6b所示,油相中除了有β-谷甾醇结晶体外,还出现了新的晶体形态,并聚集成簇,晶体长度约为20.0μm。不同于图5a中β-谷甾醇长形、管束状晶体,新的晶体呈现规则紧密的四瓣形聚集态,形似雏菊,每瓣由3~4个向四周发射的长形管状构成,晶体中心具有中空的楔形形状,这种楔形空间,可能更利于弯曲的超分子结构的形成[17]。同时。还可以看出,零星的管束状β-谷甾醇晶体,分散在成簇的新晶体周围。这说明β-谷甾醇和γ谷维素通过氢键相互吸引,并有规则地组合、排列,构建成一种自组装的新晶体。
当β-谷甾醇和γ谷维素的添加比例提高到3∶2时,晶体形态如图6c所示。和图6b相比,新晶体的聚集程度略有降低,晶体之间的距离变得更大,晶体长度也略有增加,约为23.0μm;同时,油相中分布着更多的管束状的β-谷甾醇晶体。这意味着β-谷甾醇和γ谷维素键合的氢键数目减少,导致自组装的新晶体数量下降,晶体结构开始变得松散。
图6d是β-谷甾醇和γ谷维素的添加比例高达4∶1时的偏光显微图像,油相中只出现了数目极少的、不完全的四瓣形新晶体,大多数是长度约为27.0 μm的、不规则纤维状结构的β-谷甾醇管状晶体聚合物。由于β-谷甾醇在油相中可以独立成晶,因此和图6a相比,当β-谷甾醇添加比例较大时,更容易形成自组装新晶体。
以上结果表明,β-谷甾醇和γ谷维素在油相中以分子间氢键相互吸引时,可形成自组装新晶体;晶体的形态和数量随着β-谷甾醇和γ谷维素的比例,即氢键形成的数目而发生明显的变化。
2.3 质构及锥入度分析
从质构特性分析,β-谷甾醇∶γ-谷维素(m/m)=2∶3即β-谷甾醇和γ-谷维素形成氢键比率最高时,它们在油相中硬度最大,锥入度值最小(图7)。当 β-谷甾醇∶γ-谷维素(m/m)=1∶4以及4∶1时,油相体系呈流动状态,并未检测到有效数值。这一结果,与红外光谱分析及偏振光显微镜分析一致。
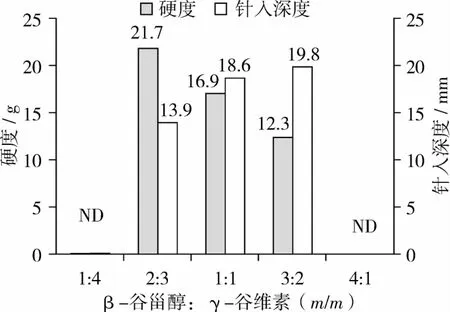
图7 TPA测试以及锥入度值分析
3 结论
β-谷甾醇上的羟基与γ-谷维素上的羰基可以通过分子间氢键进行自组装,形成新的晶体。从红外光谱分析可以看出,β-谷甾醇与γ-谷维素发生的氢键效应的强弱随着两者的比例而不同,当β-谷甾醇和γ-谷维素的比例为2∶3(m/m),即物质的量比为1∶1时,产生的氢键效应最大,其油相体系在偏振光显微镜中呈现出规则紧密的四瓣形新晶体,硬度也最大。
参考文献
[1]贾代汉,周岩民,王恬,等.植物甾醇降胆固醇作用研究进展[J].中国油脂,2005,30(5):55-58
[2]何胜华,马莺,周泉城,等.菜籽植物甾醇降小鼠血脂功能的试验研究[J].中国油脂,2005,30(6):60-62
[3]张莉华,许新德,邵斌,等.植物甾醇毒理学安全性评价[J].中国油脂,2010,35(5):19-22
[4]Ariënne D J,Jogchum P,Ronald P M,et al.Metabolic effects of plant sterols and stanols[J].Journal Nutrition Biology,2003,14(7):362-369
[5]Mattosn F H,Volpenhein R A,Erickson B A,et al.Effect of plant stereosters on the absorption of dietary cholesterol[J].Journal of Nutrition,1977,107:1139-1146
[6]Hayes K C,Pronczuk A,Wijendran V,et al.Free phytosterols effectively reduce plasma and liver cholesterol in gerbils fed cholesterol[J].Journal of Nutrition,2002,132:1983-1988
[7]朱俊东,糜漫天.植物甾醇降低血胆固醇作用的研究进展[J].重庆医学,2006,35(19):1798-1800
[8]Hallikainen M A,Sarkkinen E S,Uusitupa M I,et al.Plant stanol esters affect serum cholesterol concentrations of hypercholesterolemic men and women in a dose-dependent manner[J].Nutr,2000,130(4):767-776
[9]李爱峰.星状神经节阻滞复合谷维素口服治疗更年期综合征临床观察[J].吉林医学,2009,30(12):1163-1164
[10]王福军,慈书平.谷维素抗心律失常作用的实验研究[J].中国医师志,2003,5(10):1330-1331
[11]钟建华,徐方正.植物甾醇理化性质、生理功能及应用[J].江苏食品与发酵,2005(1):22-24
[12]王稳航.植物甾醇及其在食品中应用[J].西部粮油科技,2002(6):41-44
[13]高阳.新型功能食品添加剂—植物甾醇[J].中国食物和营养,2006(12):26-27
[14]Bot A,Ruud den Adel,Eli C.Roijers,et al.Fibrils ofγ-Oryzanol+β-Sitosterol in Edible Oil Organogels[J].J Am Oil Chem Soc,2008,85:1127-1134
[15]Bot A,Ruud den Adel,Regkos C,et al.Structuring inβ-Sitosterol+γ-Oryzanol-based emulsion gels during variousstages of a temperature cycle[J].Food Hydrocolloids,2011,25(4):639-646
[16]Bot A,Yvonne SJVeldhuizen,Ruud den Adel,et al.Non-TAG structuring of edible oils and emulsions[J].Food Hydrocolloids,2009,23:1184-1189
[17]Mimma Pernetti,Kees F.van Malssen,Flöter E,Bot A,et al.Structuring of edible oils by alternatives to crystalline fat[J].Current Opinion in Colloid&Interface Science,2007(12):221-231
[18]张汉辉,郑威,陈义平,等.波普学原理及应用[M].化学工业出版社,2011:41-42
[19]何金兰,杨克让,李小戈,等.仪器分析原理[M].科学出版社,2002:84-92
