电子自旋共振法和分光光度法测定酿酒葡萄籽原花青素抗氧化活性
2013-03-07胡博然贾玲玲
胡博然,朱 勇,徐 洁,周 妍,贾玲玲
(1.扬州大学食品科学与工程学院,江苏 扬州 225127;2.扬州大学生物科学与技术学院,江苏 扬州 225009)
电子自旋共振法和分光光度法测定酿酒葡萄籽原花青素抗氧化活性
胡博然1,朱 勇2,徐 洁1,周 妍1,贾玲玲1
(1.扬州大学食品科学与工程学院,江苏 扬州 225127;2.扬州大学生物科学与技术学院,江苏 扬州 225009)
利用电子自旋共振技术(ESR)对酿酒葡萄籽原花青素4个不同提取样品(GSP0、GSP1、GSP2、GSP3)抗氧化特性进行研究,并采用分光光度法进行对比分析。结果表明:电子自旋共振法和分光光度法均测得,GSP3样品对DPPH自由基清除能力最强;反应30min,质量浓度小于40mg/L时,样品质量浓度与清除率呈正相关,质量浓度大于40mg/L时,清除率趋于稳定。ESR测得的原花青素的清除率普遍高于分光光度法:反应30min,ESR测得不同质量浓度的GSP0的清除率最低为35.99%,最高为99%,而分光光度法测得分别为7.06%、78%;ESR测得的GSP3清除率最低为52.45%、最高值为99%,分光光度法测得的清除率分别是29%、95%。
电子自旋共振法;分光光度法;原花青素;DPPH
酿酒葡萄籽提取物(grape seed extract,GSE)是从酿酒葡萄的种子中提取出来的一种多酚物质的混合物,其中最主要的多酚活性物质是原花青素,其基本的单体是儿茶素和表儿茶素,这两种单体通过聚合形成寡聚体或者多聚体,通常将2~4聚体称为低聚体,5聚体以上的则称为高聚体[1-3]。早在20世纪70年代,人们就对原花青素进行了大量的生化和药理活性研究,并发现原花青素具有很强的抗氧化活性。经过几十年的研究开发,原花青素的安全性和优越的抗氧化性已为人们所认可,在医药、保健食品和化妆品等方面得到了广泛的应用[4-6]。
目前常用的检测抗氧化性的方法有:ABTS+g法、DPPH法、ORAC法等[7-8]。其中,DPPH法在抗氧化性方面应用广泛[9-12]。电子自旋共振技术作为一种新的检测方法,可通过直接测定自由基信号的变化来反映清除率的大小,该方法具有及时性、直接性、灵敏性等特点,在国内检测葡萄籽原花青素抗氧化性方面的应用很少见。
本实验应用电子自旋共振法对实验室提取的葡萄籽原花青素进行检测,并采用分光光度法进行对比,研究不同纯度的原花青素在不同质量浓度下对DPPH自由基的清除效果。
1 材料与方法
1.1 材料与试剂
称取1g葡萄籽粉碎后用石油醚脱脂,经微波辅助提取得到106.936mg的原花青素粗提物(crude grape seed proanthocyanidin,GSP)。称取一定量的粗提物,经AB-8树脂吸附,依次用25%、50%的乙醇洗脱,并将部分50%乙醇洗脱液冻干成原花青素粉末,依次把原花青素粗提物、25%乙醇洗脱液、50%乙醇洗脱液和50%乙醇洗脱液冻干粉标记为GSP0、GSP1、GSP2、GSP3,4℃冰箱保存,备用。
1,1-二苯基-2-三硝基苯肼(DPPH) 美国Sigma公司;儿茶素标准品(MUST-11050801) 南京泽郎医药生物技术有限公司;无水乙醇、石油醚、香兰素、甲醇、浓硫酸,以上试剂均为分析纯。
1.2 仪器与设备
A300-10/12电子顺磁共振波谱仪 德国Bruker公司;UV1600-PC紫外-可见分光光度计 上海美谱达仪器有限公司。
1.3 方法
其中:x(t)=(x1(t),x2(t),…,xN(t))T为N 维状态向量;u(t)=(u1(t),u2(t),…,um(t))T为控制向量;mN;f(x(t),u(t),t)=(f1(x(t),u(t),t),f2(x(t),u(t),t),…,fN(x(t),u(t),t))T为N维实值函数向量.为了研究问题的方便,引入广义状态空间的概念.
1.3.1 酿酒葡萄籽原花青素含量测定
参照孙芸等[13]的硫酸-香草醛法,测定原花青素含量。
1.3.2 电子顺磁共振法测定DPPH自由基清除率
电子自旋共振技术(ESR)参数设置:HSC(ER4119)谐振腔,X波段频率9.837741GHz,功率20.104mW,室温条件,调制频率100.0kHz,调幅2.0G,时间常数327.680ms,扫场时间665.600s,中心磁场3503.000G,扫场宽度80.00G,室温。
以乙醇作为溶剂,将4种样品分别配制成10、20、40、60、80mg/L不同质量浓度的溶液,取1mL待测样品与1mL 2.5h10-4mol/mL的DPPH溶液混匀,装入毛细管封闭好,放入ESR仪谐振腔,记录波谱图并计算峰面积。用95%乙醇代替样品作为空白对照。按式(1)计算清除率[14]。
1.3.3 分光光度法测定DPPH自由基清除率
取2.5h10-4mol/mL的DPPH溶液2mL,与2mL不同质量浓度的样品液于试管中充分混匀后,在暗处静置30min,然后在517nm波长处测定其吸光度(Ap),同时测定不加DPPH的样品空白吸光度(Ac)及加DPPH但不加样品(以95%乙醇代替样品)的吸光度(Amax),以VC为对照品,按(2)计算清除率。
2 结果与分析
2.1 电子顺磁共振法测葡萄籽原花青素DPPH自由基清除率结果
10mg/L葡萄籽原花青素不同样品,在进样后0、15、30min测清除DPPH自由基效果,电子自旋共振波谱图如图1所示。
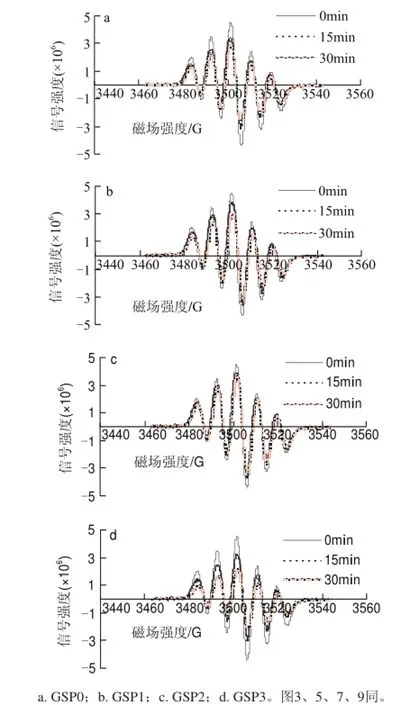
图 1 10mg/L葡萄籽原花青素不同提取样品清除DPPH自由基的电子自旋共振波谱图Fig.1 EPR spectra of DPPH free radicals after exposure to different samples at a concentration of 10 mg/L
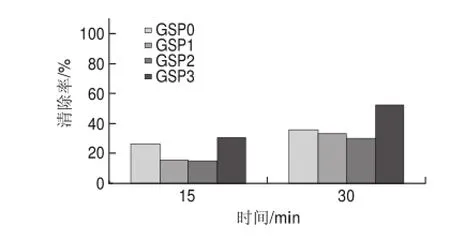
图 2 10mg/L葡萄籽原花青素不同提取样品对DPPH自由基的清除能力Fig.2 DPPH radical scavenging activity of different samples at a concentration of 10 mg/L
在电子顺磁共振中,DPPH自由基的特征吸收强度在3460~3540G之间。由图2可知,10mg/L葡萄籽原花青素不同样品清除率都比较低,随着反应时间的延长,清除率有所提高;冻干粉的清除率比洗脱液清除率高,而粗提物的清除率介于二者之间。与15min相比,在30min时GSP0、GSP1、GSP2、GSP3的清除率分别提高了35.85%、108.54%、91.14%、72.19%。
20mg/L葡萄籽原花青素不同样品,在进样后0、15、30min检测清除DPPH自由基效果,电子自旋共振波谱图如图3所示。
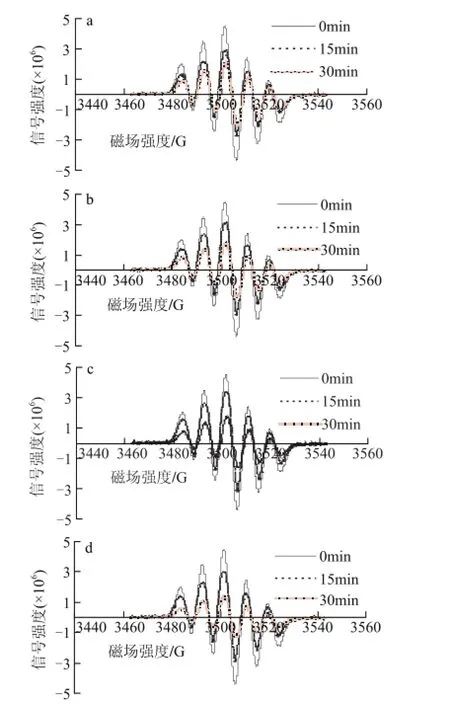
图 3 20mg/L葡萄籽原花青素不同提取样品清除DPPH自由基的电子自旋共振波谱图Fig.3 EPR spectra of DPPH free radicals after exposure to different samples at a concentration of 20 mg/L
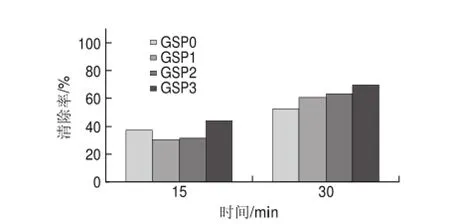
图 4 20mg/L葡萄籽原花青素不同提取样品对DPPH自由基的清除能力Fig.4 DPPH radical scavenging activity of different samples at a concentration of 20 mg/L
由图4可知,20mg/L葡萄籽原花青素不同样品清除率普遍有所提高。反应15min,与10mg/L样品相比,GSP0清除率为37.1%,提高了40%,GSP3的清除率为44%,提高了44.45%;反应30min,GSP0清除率为52.28%,提高了45.26%,GSP3的清除率为69.66%,提高了32.81%;同一样品两个不同时间点的清除率对比,反应30min的GSP0的清除率比反应15min时提高了40.92%,GSP3提高了58.32%。
40mg/L葡萄籽原花青素不同样品,在进样后0、15、30min检测清除DPPH自由基效果,电子自旋共振波谱图如图5所示。
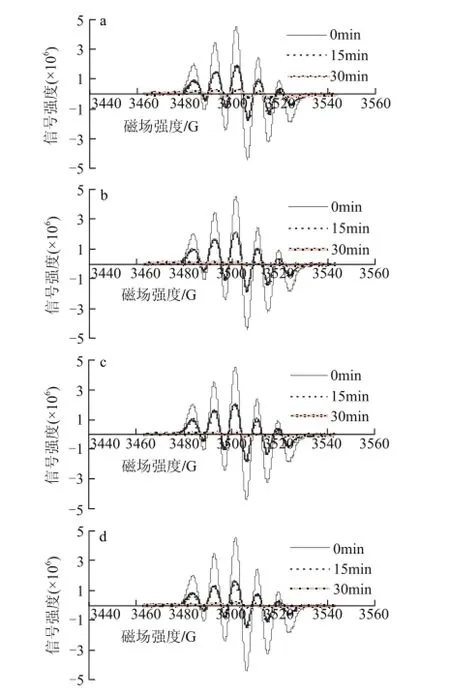
图 5 40mg/L葡萄籽原花青素不同提取样品清除DPPH自由基的电子自旋共振波谱图Fig.5 EPR spectra of DPPH free radicals after exposure to different samples at a concentration of 40 mg/L
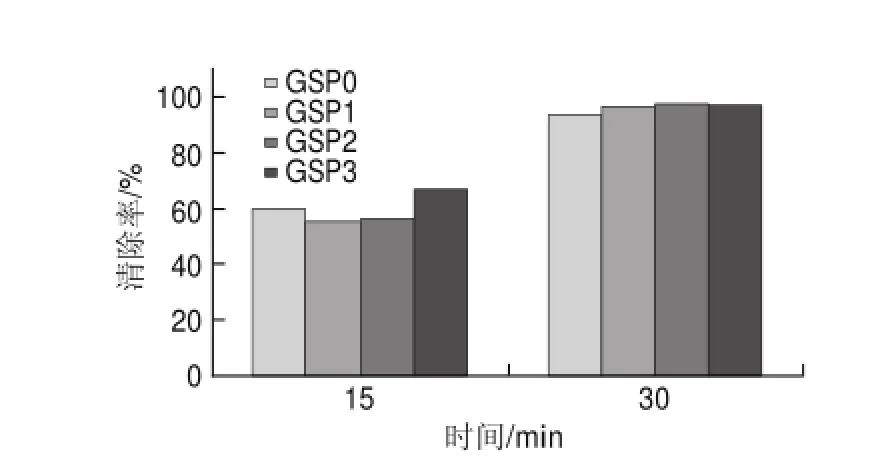
图 6 40mg/L葡萄籽原花青素不同提取样品对DPPH自由基的清除能力Fig.6 DPPH radical scavenging activity of different samples at a concentration of 40 mg/L
由图6可知,40mg/L葡萄籽原花青素不同样品反应15min时,与20mg/L不同样品相比, GSP0的清除率提高了61.02%,GSP3的清除率为66.57%,提高了51.3%;在反应30min时,所有样品的清除率基本达到97%,与15min时相比,DPPH自由基已经基本被清除,且不同样品的清除率相差不大。
60mg/L葡萄籽原花青素不同样品,在进样后0、15、30min检测清除DPPH自由基效果,电子自旋共振波谱图如图7所示。
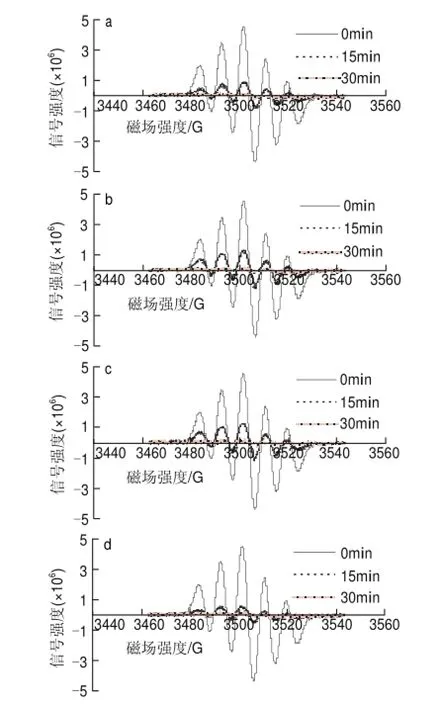
图 7 60mg/L葡萄籽原花青素不同提取样品清除DPPH自由基的电子自旋共振波谱图Fig.7 EPR spectra of DPPH free radicals after exposure to different samples at a concentration of 60 mg/L
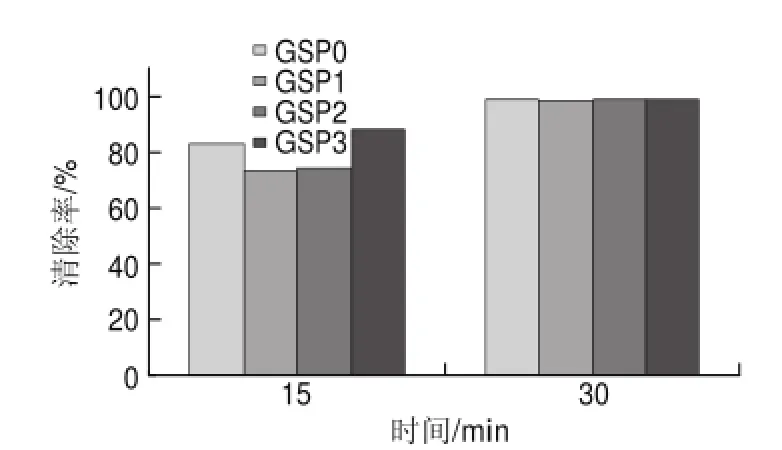
图 8 60mg/L葡萄籽原花青素不同提取样品对DPPH自由基的清除能力Fig.8 DPPH radical scavenging activity of different samples at a concentration of 60 mg/L
由图8可知,60mg/L葡萄籽原花青素不同样品反应15min时,与40mg/L相比,GSP0的清除率为82.69%,提高了38.42%,而GSP3的清除率为87.9%,提高了32.04%;反应30min时,清除率基本达到98%,且不同的样品之间相差不大。
80mg/L葡萄籽原花青素不同样品,在进样后0、15、30min检测清除DPPH自由基效果,电子自旋共振波谱图如图9所示。
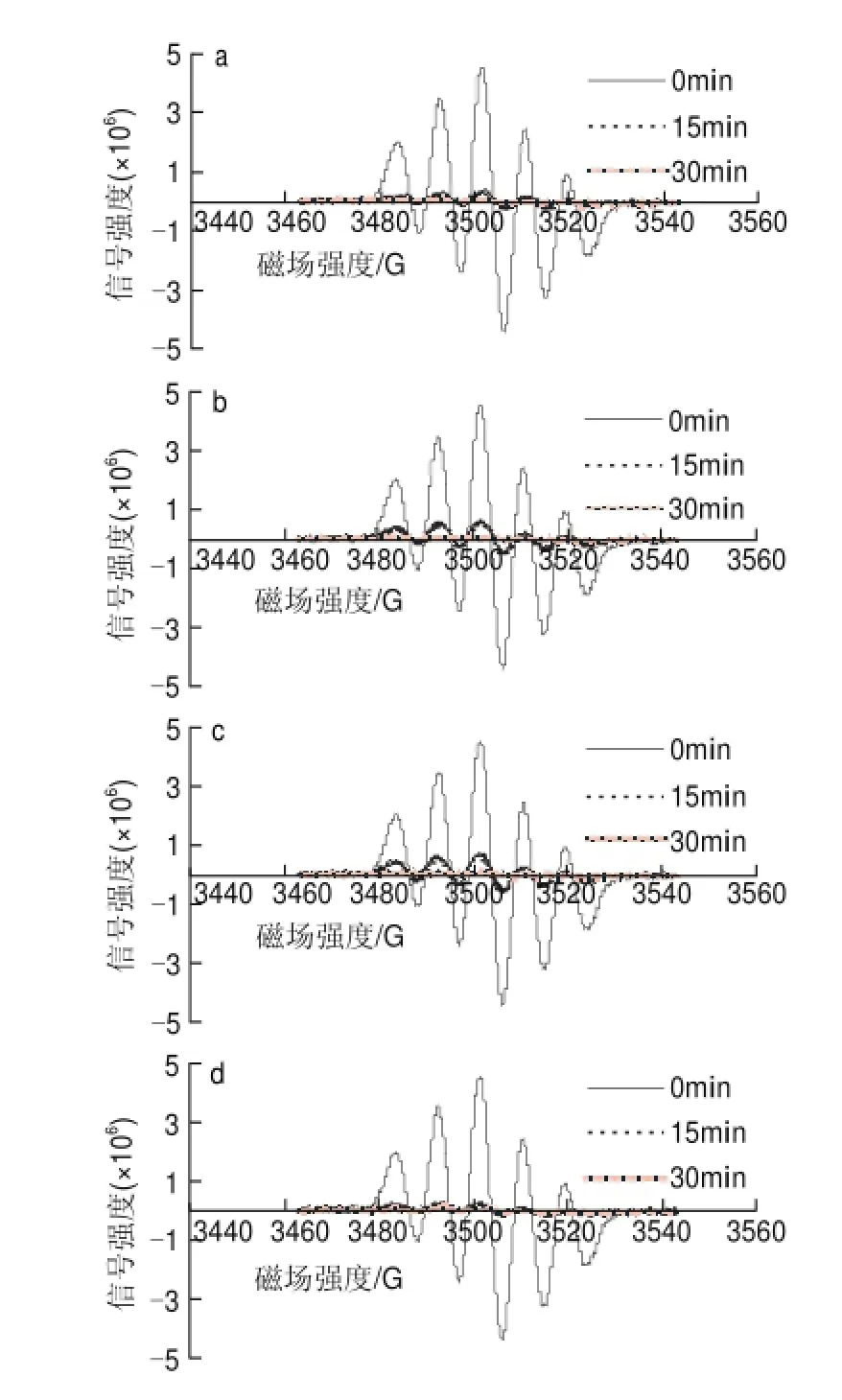
图 9 80mg/L葡萄籽原花青素不同提取样品清除DPPH自由基的电子自旋共振波谱图Fig.9 EPR spectra of DPPH free radicals after exposure to different samples at a concentration of 80 mg/L
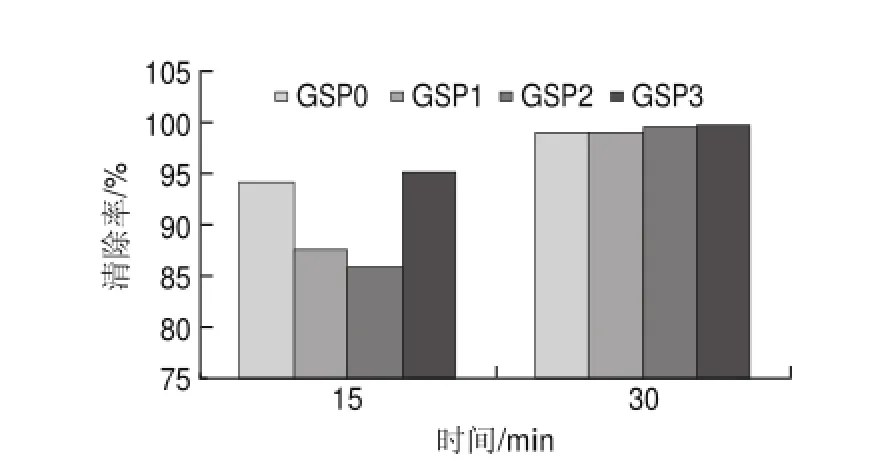
图 10 80mg/L葡萄籽原花青素不同提取样品对DPPH自由基的清除能力Fig.10 DPPH radical scavenging activity of different samples at a concentration of 80 mg/L
由图10可知,80mg/L葡萄籽原花青素不同样品清除率普遍较高,在反应15min时,GSP0的清除率为94.1%,略低于GSP3的95.19%,而GSP1与GSP2的清除率分别为87.64%和85.87%;在反应30min时,溶液中的DPPH自由基均基本被清除完全,并且GSP1和GSP2的清除率高达99%。
综上所述,15min和30min时,在同一质量浓度条件下,50%乙醇洗脱液冻干粉(GSP)对DPPH自由基的清除率最高,说明葡萄籽原花青素的50%乙醇洗脱部位对自由基的清除能力强;在一定质量浓度范围内,各原花青素提取样品对DPPH自由基的清除能力呈现剂量效应关系,在较低质量浓度时,没有明显的清除能力,随着质量浓度的升高,清除力也随之增强。在反应15min时,GSP0的清除率高于GSP2和GSP1,可能由于反应时间短,GSP2与GSP1中的原花青素与DPPH自由基的结合未完全;在反应30 min时,GSP2和GSP1经充分反应后,清除率最终不低于GSP0。30min时,当样品质量浓度增加至40mg/L后,提高样品质量浓度,原花青素的清除率基本不变。这是因为在提高样品质量浓度的初始阶段,原花青素与大量的DPPH自由基相结合产生DPPH-PheO,表现为原花青素的清除率迅速提高。当样品质量浓度继续增大,DPPH自由基减少到一定程度时,原花青素芳香环上的羟基会与PheOg结合,从而竞争性抑制了原花青素与DPPH自由基的结合,导致样品对DPPH自由基的清除率很难达到100%。
2.2 分光光度法测葡萄籽原花青素DPPH自由基清除率结果
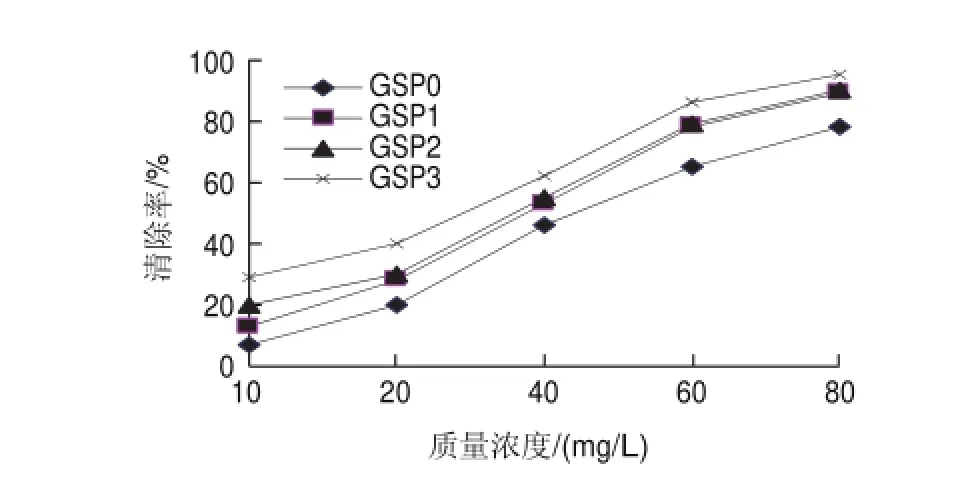
图 11 不同质量浓度的样品对DPPH自由基的清除活性Fig.11 DPPH radical scavenging activity of different samples at different concentrations
由图11可知,分光光度法测得的4种不同原花青素提取物均有显著的清除率,随着样品质量浓度的提高其清除力也随之增高,不同样品对DPPH自由基清除能力的强弱次序是:GSP3>GSP2>GSP1>GSP0,50%乙醇洗脱液冻干粉的清除效果最好。与ESR所测得的清除率相比较,反应30min时,相同质量浓度的同一种样品,ESR测得的清除率明显普遍高于分光光度法:ESR测得的GSP0清除率最低值、最高值分别是35.99%、99%,而分光光度法测得的则分别是7.06%、78%;ESR测得的GSP3清除率最低、最高值分别是52.45%、99%,分光光度法测得的分别是29%、95%。这表明ESR能更灵敏地反映原花青素对DPPH自由基的清除能力。
3 结 论
通过采用ESR和分光光度法测定4个不同酿酒葡萄籽原花青素样品清除DPPH自由基的能力,证明葡萄籽原花青素具有很强的抗氧化能力。反应15min时,同一样品对DPPH自由基的清除率与样品质量浓度成正比;而反应30min时,质量浓度小于40mg/L时,样品质量浓度与清除率呈正相关,在质量浓度大于40mg/L时,清除率趋于稳定。通过对两种方法检测得到的清除效果的比较,结果表明:利用ESR检测得到的清除效果明显好于分光光度法检测得到的效果,ESR能更灵敏、更精确、更直观地反映原花青素对DPPH自由基的清除效果,与分光光度法相比,它有着显著的优越性。
本研究为葡萄籽原花青素的抗氧化性研究提供电子自旋共振波谱分析检测方法,可在提取及含量测定方面进行更深入的研究,以期能够为其在食品天然抗氧化剂领域的开发利用提供科学依据。
[1] BGACHI D, BAGCHI M, STOHSS J, et a1. Free radicals and grape seed proanthocyanidin extract: importance in human health and disease prevention[J]. Toxicology, 2000, 148(23): 187-189.
[2] 温钢, 李立群, 隋新. 葡萄籽中低聚原花青素的提取研究[J]. 中国酿造, 2010(1): 111-113.
[3] SHARMA S D, KATIYAR S K. Dietary grape-seed proanthocyanidin inhibition of ultraviolet B-induced immune suppression is associated with induction of IL-12[J]. Carcinogenesis, 2006, 27(1): 95-102.
[4] 汪志慧, 孙智达, 谢笔钧. 响应曲面法优化双酶法提取莲房原花青素[J]. 食品科学, 2011, 32(4): 64-68.
[5] 赵述泽. 新型食品配料: 葡萄籽提取物的发展[J]. 中外食品, 2004(2): 48-49.
[6] 左媛, 王晓闻. 葡萄籽提取物研究进展综述[J]. 山西科技, 2010, 25(3): 138-139.
[7] LI Hua, WANG Xiaoyu, LI Yong, et al. Polyphenolic compounds and antioxidant properties of selected China wines[J]. Food Chemistry, 2009, 112(2): 454-460.
[8] STAŠKO A, POLOVKA M, BREZOVÁ V. Tokay wines as scavengers of free radicals (an EPR study)[J]. Food Chemistry, 2006, 96: 185-196.
[9] 李红, 张元湖. 应用DPPHg法测定苹果提取物的抗氧化能力[J]. 山东农业大学学报, 2005, 36(1): 35-38.
[10] 李彩芳, 宋艳丽, 郭亚力, 等. 珍珠菜的抗氧化活性[J]. 精细化工, 2008, 25(12): 1191-1193.
[11] 胡博然, 闻雯, 阴淑贞, 等. 电子顺磁共振波谱仪分析干红葡萄酒DPPH清除能力及其与总酚含量的关系[J]. 中国农业科学, 2012, 45(1): 135-141.
[12] 胡博然, 阴淑贞, 闻雯, 等. 干白葡萄酒清除DPPH自由基的能力及其与总酚含量的关系[J]. 食品与发酵工业, 2011, 37(11): 60-65.
[13] 孙芸, 谷文英. 硫酸-香草醛法测定葡萄籽原花青素含量[J]. 食品与发酵工业, 2003, 29(9): 43-46.
[14] 张晓元, 吴晖, 林霞, 等. 用ESR检测二氢杨梅素对自由基的清除作用的研究[J]. 现代食品科技, 2010, 26(10): 1040-1070.
Comparative Application of ESR and Spectrophotometry to Evaluate the Antioxidant Activity of Grape Seed Proanthocyanidins
HU Bo-ran1,ZHU Yong2,XU Jie1,ZHOU Yan1,JIA Ling-ling1
(1. College of Food Science and Engineering, Yangzhou University, Yangzhou 225127, China;2. College of Biological Science and Technology, Yangzhou University, Yangzhou 225009, China)
Electron spin resonance (ESR) spectroscopy was used to investigate the antioxidant activity of four proanthocyanidin extracts from wine grape seeds (designated as GSP0, GSP1, GSP2 and GSP3, respectively) and compared with spectrophotometry as a control. GSP3 had the strongest DPPH radical scavenging activity as determined by both methods. After 30 min of reaction at concentrations below 40 mg/L, a positive correlation between scavenging rate and GSP3 concentration was observed. At concentrations above 40 mg/L, the DPPH radical scavenging activity of GSP3 tended to be stable. Higher scavenging rates were obtained for all four proanthocyanidin extracts using ESR than spectrophotometry. After 30 min of reaction, the DPPH radical scavenging rates of GSP0 and GSP3 at various concentrations were determined using ESR to be in the range of 35.99%ü99% and 52.45%ü99%, respectively, whereas those obtained using spectrophotometry were in the range of 7.06%ü78% and 29%ü95%, respectively.
ESR;spectrophotometry;proanthocyanidin;DPPH
TS201.2
A
1002-6630(2013)01-0033-05
2011-10-20
国家自然科学基金项目(31271857)
胡博然(1964ü),女,教授,博士,研究方向为葡萄酒、食品生物技术与食品安全。E-mail:huboran2001@yahoo.com.cn
