二次回归中心组合法优化外源纤维素酶酶解提取香草兰青豆荚香兰素工艺
2013-03-06莫丽梅张彦军谷风林陆敏泉
莫丽梅,张彦军,谷风林,3,徐 飞,陆敏泉,*
(1.海南大学食品学院,海南 海口 570228;2.中国热带农业科学院香料饮料研究所,海南 万宁 571533;3.农业部香辛饮料作物遗传资源利用重点实验室,海南 万宁 571533)
二次回归中心组合法优化外源纤维素酶酶解提取香草兰青豆荚香兰素工艺
莫丽梅1,张彦军2,谷风林2,3,徐 飞2,陆敏泉2,*
(1.海南大学食品学院,海南 海口 570228;2.中国热带农业科学院香料饮料研究所,海南 万宁 571533;3.农业部香辛饮料作物遗传资源利用重点实验室,海南 万宁 571533)
为优化纤维素酶酶解天然香草兰青豆荚工艺,本实验采用二次回归中心组合方法考察外源添加纤维素酶处理对香草兰青豆荚香兰素含量的影响。结果表明:最佳酶解工艺条件为香草兰青豆荚10g、酶解温度53℃、纤维素酶添加量26.9mg、酶解时间16h,此条件下天然香草兰青豆荚中香兰素含量为2.18%,相比于传统发酵乙醇回流提取法的1.97%,香兰素含量提高0.21%。
香兰素;纤维素酶;条件优化
香草兰(Vanilla planifolia Andrews)又名香荚兰、香子兰、香果兰,属兰科(Orchidaceae)香子兰属多年生热带藤本植物。天然香草兰提取物是全世界价格最昂贵的风味成分之一,其中60%用于食品行业,33%用于化妆品行业,7%用于芳香保健行业[1]。香草兰是名贵的天然香料且香味独特,素有“食品香料之王”的美称[2],其香味物质主要成分是香兰素(C8H8O3)。青豆荚仅有青草香,经过加工后形成香草兰特有的香气成分,其加工过程经过杀青、发酵、干燥、陈化生香,最终形成组分复杂的香气,包括烷烃、醇类、醛酮类、酯类、酚类、酸类、少量苯、醚类等[2-4]。据王庆煌等[5]报道,酶促反应在香草兰发酵生香过程中起最重要的作用,其主要作用酶有β-葡萄糖苷酶、过氧化物酶、多酚氧化酶、果胶酶、纤维素酶。
通过预处理或外源添加酶处理天然香草兰青豆荚对香兰素含量的影响报道较少。Roode等[6]和Dignum[7]报道通过破坏细胞壁处理,增加β-葡萄糖苷底物与β-葡萄糖苷酶的接触显著提高了香草兰中香兰素的含量。Sreedhar[8]采用萘乙酸和乙烯利溶液预处理香草兰青豆荚,结果表明香兰素分别提高4倍和3.6倍。姜欣等[9]向香草兰浸膏中加入β-葡萄糖苷酶,结果发现酶与香兰素的含量呈正相关关系。Naidu等[10]研究酶法辅助提取香草兰豆荚中的香兰素,结果发现添加茶叶酶或者戊聚糖复合酶均可提高香兰素。Ruiz-Terán等[11]使用戊聚糖复合酶和纤维素酶两步法明显提高香草兰中香兰素的含量。Gu Fenglin等[12]考察纤维素酶添加量、温度和加热时间对提取香草兰中香兰素的影响,结果表明在优化条件下香兰素含量明显升高。
据Zidi等[13]报道,每年香兰素的产量达到12000t,然而从天然豆荚中提取的香兰素不足1%,大多数为化学合成。香草兰青豆荚中葡糖香兰素的含量在10%~15%,理论上经酶解能够转化为约5%的香兰素,但是采用传统的加工方法,仅得到平均约2%的香兰素[14]。世界香兰素年需求增长率为10%,国际市场对天然香兰素的需求更为迫切[10]。因此,对香草兰发酵生香过程中如何通过外源添加酶提高香兰素含量的研究显得尤为迫切。
课题组前期发现发酵生香后的香草兰豆荚添加纤维素酶可以大大提高香兰素的提取率,在此基础上,本实验拟通过考察外源添加纤维素酶处理香草兰青豆荚反应条件,优化香兰素提取工艺,为提高天然香草兰豆荚中香兰素含量提供理论参考。
1 材料与方法
1.1 材料与试剂
香草兰青豆荚 中国热带农业科学院香料饮料研究所;香兰素标准品 美国Sigma公司;纤维素酶(15000U/g) 国药集团化学试剂有限公司;无水乙醇、冰醋酸(均为分析纯) 天津天大化工实验厂。
1.2 仪器与设备
索氏提取器 四川蜀牛玻璃仪器公司;RT5高效多点加热磁力搅拌器 德国IKA公司;1260型高效液相色谱仪 美国Agilent公司;Milli-Q超纯水器 美国Millipore公司;KQ-600B型超声波清洗器 昆山市超声仪器有限公司。
1.3 方法
1.3.1 工艺流程及操作要点参照Ruiz-Terán等[11]的方法并部分修改,具体如下:
工艺流程:香草兰匀浆→分装→酶解→灭酶→醇提→过滤→定容→待测样。
操作要点:挑选一级香草兰青豆荚,洗净备用。准确称取香草兰青豆荚200.0g,按1:1(g/mL)加入水匀浆(香草兰匀浆液pH5.4,不需要加入缓冲溶液调节pH值),平均分成20份,每份20g,在指定温度条件下加入纤维素酶,酶解固定时间后,于沸水浴中保温10min灭酶。滤液冷却后加入无水乙醇,使乙醇的体积分数为47.5%,室温条件下醇提30min,过滤,定容得到香兰素浸提液,样品待上液相检测计算香兰素含量。
1.3.2 水分测定
香草兰青豆荚水分测定采用GB/T 5009.3—2003《食品中水分的测定》测定,其水分含量为86.19%。
1.3.3 香兰素含量测定
根据Brunerie[15]的方法略作修改,色谱柱:ZORBAX XDB-C18柱(4.6mm×150mm,5μm);流动相:甲醇-0.5%冰乙酸溶液(20:80,V/V);流速:1.0mL/min;柱温:室温(26℃);进样量:3μL;检测波长:280nm;灵敏度:0.01AUFS。以色谱峰的保留时间定性,并以紫外吸收光谱图辅助定性;以外标法峰面积定量,本实验中所有香兰素含量结果均换算为干基含量(%)。
1.3.4 单因素试验
分别以不同的酶解温度、酶添加量、酶解时间为单因素进行试验,考察各单因素对香兰素含量的影响,每组试验重复3次。
1.3.5 二次回归中心组合设计
在课题组前期试验基础[12]和单因素试验基础上,得出影响香兰素含量的主要因素为:酶解温度、酶添加量和酶解时间,采用二次回归中心组合设计法,对这3个主要影响因子进行最佳提取条件的选择,各个自变量按照Xi=(xi-x0)/Δx进行水平编码换算,其中xi为自变量的真实值;x0为试验中心点处自变量的真实值;Δx为自变量的变化间距。每组试验重复3次。各因素水平编码见表1。

表1 因素水平编码表Table1 Coded levels for independent variables used in response surface analysis
1.4 统计分析
采用Design Expert 7.0.1分析软件对数据进行分析处理。自变量(反应温度、纤维素酶添加量、反应时间)和响应值(香兰素含量)的关系用二级多项式回归模型表示,模型的充分性用决定系数(R2)和失拟检验(lack of fit)表示。
2 结果与分析
2.1 单因素试验
2.1.1 酶解温度的影响
固定酶添加量16.73mg、酶解时间12h,分别考察酶解温度为30、40、50、60、70℃对香兰素含量的影响,结果如图1所示。

图1 酶解温度对香兰素含量的影响Fig.1 Effect of enzymatic hydrolysis temperature on vanillin content
由图1可知,当温度从30℃升高到50℃时,香兰素含量从0.76%增加到1.44%,继续升温到70℃,则香兰素含量降为0.69%。这是由于在酶解反应中,温度会影响酶的稳定性进而影响酶解反应速率。据吕长鑫等[16]报道的结果,这是由于刚开始随着温度逐渐升高,酶的活性增加,导致反应速率加快;当达到酶解反应最适温度,酶的活力最高,最利于酶解反应的进行;随后,当温度继续升高,会钝化部分酶分子,降低酶活力,从而导致反应速率降低;当温度过高时酶完全失活。
2.1.2 酶添加量的影响
固定酶解温度和酶解时间分别为50℃和12h,分别考察酶添加量为0、10、20、30、40、50mg对香兰素含量的影响,结果如图2所示。

图2 酶添加量对香兰素含量的影响Fig.2 Effect of enzymatic addition amount on vanillin content
由图2可知,当酶添加量从0mg增加到20mg时,香兰素含量呈现显著增加的趋势(0.69%增加到1.24%);当酶添加量达到30mg时,香兰素含量达到1.59%;之后再增加酶量,香兰素含量趋于平衡。据石亚中等[17]报道,酶与底物接触反应过程中,存在平衡点,当酶添加量低于平衡点时,底物与酶可以充分结合;当酶量继续增加,底物与酶的结合程度会加大,当反应达到平衡后,酶活性趋于稳定。因此,酶添加量越大并不意味着越利于酶解效果,对于底物量一定时,存在一个最佳的酶用量。
2.1.3 酶解时间的影响
固定酶解温度50℃、酶添加量16.73mg,分别考察酶解时间为0、6、12、18、24、30h对香兰素含量的影响,结果如图3所示。

图3 酶解时间对香兰素含量的影响Fig.3 Effect of enzymatic hydrolysis time on vanillin content
由图3可知,酶解反应随着反应时间从0h增加到12h,香兰素含量逐渐由0.34%增大到1.21%,再延长酶解时间,香兰素含量基本维持在1.61%水平。据董旭等[18]的报道,添加酶后酶与底物结合程度低,酶解效果不明显,随着反应时间的延长,底物与酶接触的机会增大,酶解效果增加;当达到最佳酶解时间,酶已经达到与底物反应的最大活力,如果再延长酶解时间,酶解效果基本维持稳定,这正与本实验结果相一致。
2.2 二次回归中心组合模型拟合及方差分析

表2 二次回归中心组合试验设计及结果Table 2ble 2 Experimental design and results for response surface analysis
选取酶解温度(X1)、酶添加量(X2)和酶解时间(X3)为自变量,以香兰素含量(Y)为响应值进行响应面分析,结果如表2所示。20个试验点的响应值进行回归分析,得到回归方程:
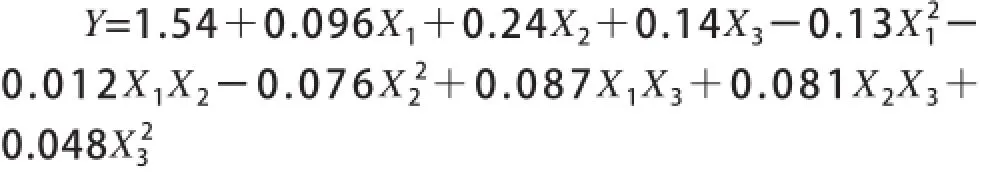

表3 模型各项回归分析Table3 Results of regression analysis

表4 模型方差分析Table4 Results of analysis of variance

表5 回归方程系数显著性检验表Table5 Statistical significance of each coefficient in the regression equation
对模型进行方差分析,结果见表3~5。由表3可知,模型显著(P<0.0001)。由表4可知,失拟项不显著(P=0.0527>0.05),R2=0.9059表明此模型能解释90.59%响应变化,回归方程拟合程度良好,因此此模型可以真实地拟合和预测实际情况,具有很好的代表性。由表5可知,一次项B1、B2、B3显著,二次项B11显著,B22和B33不显著,交互项B12、B13和B23不显著。因素B1、B2及B3的P值分别为0.0228、<0.0001及0.0035,表明酶解温度,酶添加量和酶解时间影响显著,3个因素对香兰素含量影响的顺序为酶添加量>酶解时间>酶解温度。
2.3 回归模型的响应面分析
采用Design Expert 3D Surface对关于实数变方程做曲面图以直观反映局部参数值与整体响应值直接的交互对应关系[19]。
由图4a可知,香兰素含量随着酶添加量的增加呈现增加的趋势,而随着反应温度的升高出现先增加后降低的趋势。酶解时间在中心点,酶解温度为50℃,酶添加量从7.93mg增加到25.53mg时,香兰素含量从1.22%增加到1.70%,之后趋于平衡;酶解时间在中心点,酶添加量为16.73mg,温度从38.11℃增加到61.89℃时,香兰素含量先从1.31%增加到1.54%后降低为1.51%,这说明酶添加量并不是越多越好,当酶添加量达到饱和再增加酶用量不仅不会提高香兰素含量反而增加成本,而温度升高则会降低酶活力导致香兰素含量降低。从曲线弯曲程度可知酶添加量对响应值(香兰素含量)影响更显著。

图4 各两因素交互作用对香兰素含量的影响Fig.4 Response surface plots showing the interaction effects of various independent variables on vanillin content
由图4b可知,香兰素含量随着酶解温度的升高呈现先上升后下降的趋势,而随着酶解时间的延长呈现增加的趋势,而后趋于平缓。当酶解时间为12h,温度从38.11℃增加到61.89℃时,香兰素含量先从1.31%增加到1.54%后降低为1.51%,结合单因素试验结果当温度升高为80℃时,香兰素含量降低为1.01%;当酶解温度为50℃,酶解时间从8.43h延长至15.57h,香兰素含量从1.45%增加到1.73%。此外,由曲线弯曲程度可知酶解时间对香兰素含量的影响较酶解温度更为显著。
由图4c可知,香兰素含量随着酶添加量的增加而呈现增加的趋势,当酶解时间固定为12h,酶添加量从25.53mg增加到50mg时,香兰素含量维持在1.60%左右;香兰素含量随着酶解时间的延长呈现平稳增长的趋势后趋于平衡,结合单因素试验结果,当酶添加量为16.73mg,酶解时间从16h增加到24h时,香兰素含量为(1.63±0.05)%。由曲面弯曲程度可知酶添加量对香兰素的含量影响较酶解时间更为显著。
2.4 最佳工艺条件的确定及验证
采用Design Expert软件分析得到本实验的最佳合成工艺条件为酶解温度53.03℃、酶添加量26.88mg、酶解时间16.02h,可以得到理论上最优香兰素的含量2.26%。结合实际的操作条件,得最佳反应条件为酶解温度53℃、酶添加量26.9mg、酶解时间16h,在此条件下做3次平行验证实验,结果如表6所示,最佳条件下香兰素含量为2.18%,说明该模型用于预测香兰素含量最高时三因素的组合方案具有可行性。

表6 验证实验Table6 Results of validation experiments under the optimized hydrolysis conditions
由于试验的误差存在,与预测的最高值有偏差,相对误差为3.67%,表明由回归方程所得的预测值与实际情况相差不大,说明回归方程能够比较真实地反映各因素对香兰素含量的影响。同时由表6可知,经过传统发酵后的香草兰豆荚经索氏抽提后的香兰素含量测定为1.97%,而本实验通过优化后的香兰素含量为2.18%,高于传统发酵生香法,在缩短时间的基础上得到高于传统发酵生香香草兰青豆荚中香兰素含量,大大节约了成本。
3 结论与讨论
在课题组前期试验基础上,利用香草兰青豆荚作为原料,尝试外源添加纤维素酶提高香草兰主要香味物质——香兰素,在单因素试验基础上,采用可旋转的二次回归中心组合试验设计考察酶解温度、酶添加量和酶解时间3个变量对香兰素含量的影响,最终确定最佳工艺条件为香草兰青豆荚10g、酶解温度53℃、酶添加量26.9mg(15000U/g)、酶解时间16h。验证实验表明在一定误差范围内外源添加纤维素酶可以提高香兰素含量,与传统发酵后的香草兰豆荚经索氏提取后的香兰素含量相比,香兰素含量提高了0.21%。
本课题组成员Gu Fenglin等[12]前期考察经过传统发酵生香后的香草兰豆荚通过添加外源纤维素酶处理,结果得到香兰素提取率高达7.61mg/g;Ruiz-Terán等[11]使用戊聚糖复合酶和纤维素复合酶两步法处理香草兰青豆荚,结果得到香兰素含量为3.66%;Naidu等[10]研究茶叶酶法辅助提取香草兰青豆荚中的香兰素,结果表明其香兰素含量为4.2%;Waliszewski等[20]采用3种复合酶制剂预处理香草兰切段豆荚,结果发现香兰素含量增加2倍达到2.09%。与前人的结果相比,本实验优化后的香兰素含量(2.18%)低,结果归为Gu Fenglin等[12]前期考察的是经过发酵生香后添加纤维素酶,而本实验采用的原料是香草兰青豆荚;而Ruiz-Terán等[11]和Waliszewski等[20]采用的是复合酶,据王庆煌等[5]报道香草兰发酵生香过程中最重要的作用酶有β-葡萄糖苷酶、果胶酶、纤维素酶,且这些酶相互作用将大大提高香兰素含量;Naidu等[10]采用的是茶叶复合酶,不同的酶之间性质不同,如酶活力、最适温度、pH值等。目前本实验只考察了纤维素酶对香草兰青豆荚中香兰素含量的影响,基于前面讨论,主要作用酶果胶酶和β-葡萄糖苷酶分别作用和复合作用对香草兰青豆荚中香兰素含量的影响如何还有待于进一步探讨。
[1] PRIEFERT H, RAQBENHORST J, STEINBIICHEL A. Biotechnological production of vanillin[J]. Applied Microbiology and Biotechnology, 2001, 56(3/4): 296-314.
[2] DIGNUM M J W, KERLER J, VERPOORTE R. Vanilla curing under laboratory conditions[J]. Food Chemistry, 2002, 79(2): 165-171.
[3] KUMAR K K, ANANTHAKUMAR A A, AHMAD R, et al. Effect of gamma-radiation on major aroma compounds and vanillin glucoside of cured vanilla beans (Vanilla planifolia)[J]. Food Chemistry, 2010, 122(3): 841-845.
[4] JADHAV D, REKHA B N, GOGATE R. Extraction of vanillin from vanilla pods: a comparison study of conventional soxhlet and ultrasound assisted extraction[J]. Journal of Food Engineering, 2009, 93(4): 421-426.
[5] 王庆煌, 农汉, 初众, 等. 香草兰O-β-葡萄糖苷酶底物特异性和温度稳定性研究[J]. 热带作物学报, 2012, 33(1): 1-4.
[6] ROODE B M D. Perspectives for the industrial enzymatic production of glycosides[J]. Biotechnology Progress, 2008, 19(5): 1391-1402.
[7] DIGNUM M J W. Glucosylation of exogenous vanillin by plant cell cultures[J]. Plant Cell Tissue and Organ Culture, 2002, 69(2): 177-182.
[8] SREEDHAR R V. Biotic elicitors enhance flavour compounds during accelerated curing of vanilla beans[J]. Food Chemistry, 2009, 112(2): 461-468.
[9] 姜欣, 彭黎旭. 香兰素微生物发酵法研究进展[J]. 华南热带农业大学学报, 2007, 13(4): 34-37.
[10] NAIDU M M, SUJITH KUMAR P V, SHYAMALA B N, et al. Enzyme-assisted process for production of superior quality vanilla extracts from green vanilla pods using tea leaf enzymes[J]. Food and Bioprocess Technology, 2012, 5(2): 527-532.
[11] RUIZ-TER☒N F, PEREZ-AMADOR I, L☒PEZ-MUNGUIA A. Enzymatic extraction and transformation of glucovanillin to vanillin from vanilla green pod[J]. Journal of Agricultural and Food Chemistry, 2001, 49(11): 341-347.
[12] GU Fenglin, XU Fei, TAN Lehe, et al. Optimization of enzymatic process for vanillin extraction using response surface methodology[J]. Molecules, 2012, 17(8): 8753-8761.
[13] ZIDI C, TAYED R, BOUKHILI N, et al. A supported liquid membrane system for efficient extraction of vanillin[J]. Separation and Purification Technology, 2011, 82: 36-42.
[14] ARANA F E. Action of a β-glucosidase in the curing of vanilla[J]. Journal of Food Science, 1943, 8(4): 343-351.
[15] BRUNERIE P M. Process of the production of natural vanilla aroma extracts by enzymatic processing of green vanilla pods and extract thereby obtained: US, 5705206[P/OL]. 1998-01-06. http://www. google.com/patents/US5705205.
[16] 吕长鑫, 李萌萌, 徐晓明, 等. 响应面分析法优化纤维素酶提取紫苏多糖工艺[J]. 食品科学, 2013, 34(2): 6-10.
[17] 石亚中, 方娇龙, 钱时权, 等. 响应面分析法优化纤维素酶酶解提取工艺[J]. 食品科学, 2013, 34(4): 75-79.
[18] 董旭, 杜先锋. 响应面法优化纤维素酶提取山核桃蒲多酚类物质[J].食品科学, 2013, 34(4): 109-113.
[19] SHIH I L, SHEN M H. Application of response surface methodology to optimize production of poly-ε-lysine by Streptomyces albulus IFO 14147[J]. Enzyme and Microbial Technology, 2006, 39(1): 15-21.
[20] WALISZEWSKI K N, OVANDO S L, PARDIO V T. Effect of hydration and enzymatic pretreatment of vanilla beans on the kinetics of vanillin extraction[J]. Journal of Food Engineering, 2007, 78(4): 1267-1273.
Quadratic Regression Central Composite Method for the Optimization of Enzymatic Extraction of Vanillin from Vanilla (Vanilla planifolia Andrews) Pods with Exogenous
MO Li-mei1,ZHANG Yan-jun2,GU Feng-lin2,3,XU Fei2,LU Min-quan2,*
(1. College of Food Science, Hainan University, Haikou 570228, China;2. Institute of Spice and Beverage Research, Chinese Academy of Tropical Agricultural Sciences, Wanning 571533, China;3. Key Laboratory of Genetic Resources Utilization of Spice and Beverage Crops, Ministry of Agriculture, Wanning 571533, China)
This study was conceived to develop an optimized procedure for enzymatic extraction of vanillin from vanilla green pods with exogenous cellulase. For this, quadratic regression central composite design combined with response surface methodology was employed to investigate the effects of enzymatic hydrolysis temperature, cellulase dosage and enzymatic hydrolysis time on vanillin content. The results showed that the optimum conditions of vanilla green pods, enzymatic hydrolysis temperature, cellulase and enzymatic hydrolysis time were 10 g, 53 ℃, 26.9 mg and 16 h, respectively. The maximum vanillin content under these conditions was 2.18% compared to 1.97% obtained with the conventional method of fermentation and subsequent ethanol reflux extraction.
vanillin;cellulase;condition optimization
Q55
A
1002-6630(2013)18-0018-05
10.7506/spkx1002-6630-201318004
2013-04-10
“十二五”国家科技支撑计划项目(2012BAD36B03);中央级公益性科研院所基本科研业务费专项(1630052013006)
莫丽梅(1987—),女,硕士研究生,研究方向为热带农产品加工。E-mail:molimei2007@yeah.net
*通信作者:陆敏泉(1972—),男,副研究员,硕士,研究方向为热带农产品加工。E-mail:lmq663@126.com
