美国对高风险医疗器械的审批
2013-03-03常永亨
常永亨
中国医药国际交流中心,北京市,100082
美国对高风险医疗器械的审批
【作 者】常永亨
中国医药国际交流中心,北京市,100082
在各国对医疗器械进行监督管理的实践中,监管的严格程度和需要通过的法规程序是根据医疗器械的风险等级来确定的。该文简要介绍了美国对高风险医疗器械进入市场的法规要求。
医疗器械;法规;风险;上市前审批
1 美国的医疗器械分类
美国对医疗器械进行监管的法律依据是《联邦食品、药品与化妆品法案》(Federal Food, Drug, and Cosmetic Act)中的医疗器械修正案(Medical Device Amendments)。根据该修正案,美国将医疗器械按照风险等级划分为三个管理类别,其宗旨是,对各类器械产品施以监管措施的深度,应以保证该类产品的安全性和有效性所必须为原则。
三个管理类别的划分和监管方式是:
第一类是“普通管理”产品,即危险性小或基本无危险性的产品,例如医用手套、压舌扳、手动手术器械、温度计等。对这一类产品,企业在递交FDA一2891表格后,产品即可上市。
第二类是“性能标准管理”产品,即具有一定危险性的产品,例如心电图仪、超声诊断仪、输血输液器具、呼吸机等。对这一类产品,在“普通管理”的基础上增加实施依靠“性能标准”(performance standards)进行管理的措施,以保证产品的质量和安全性、有效性。
第三类是“用于支持或维持生命、对保护人类健康起至关重要的作用,或存在导致病痛或伤害的潜在、过度风险”的产品,例如人工心脏瓣膜、心脏起搏器、人工晶体、人工血管等。这是监管投入最深的医疗器械产品类别。对这一类产品,“普通管理”和“性能标准管理”措施都不足以保证就其“预设用途”(intended use)而言的安全性和有效性,因而所有属于这一类别的医疗器械都要执行“上市前审批”(Premarket Approval — PMA)的要求。
根据这个划分,美国市场上三个类别医疗器械的存在比例是:第一类约占全部医疗器械品种的25%,第二类约占全部医疗器械品种的55%,第三类约占全部医疗器械品种的20%。
2 上市前审批(PMA)
由食品药品管理局(FDA)进行上市前审批是为保证第三类医疗器械的安全性和有效性而对其施行科学审评措施的法定程序。基于与第三类器械相关联的风险水平,FDA断定单独依靠一般或特别的管理不足以保证第三类器械的安全性和有效性,这些器械上市需要依据《联邦食品、药品与化妆品法案》中的第515条提出PMA申请。但某些在1976年医疗器械修正案发布前即已进入市场的第三类医疗器械(Class III preamendment devices )可以履行针对这些第三类器械的510(k)程序(基于历史验证)。
PMA是FDA所要求的最严格的器械上市申请,这类器械必须得到FDA批准方可上市。FDA给予PMA批准是基于以下判断:企业提交的PMA申请资料已经包含了足够的有效科学证据,足以保证该器械就其预设用途而言的安全性和有效性。PMA是准予申请人(或持有者)销售某种器械的私人许可证,但PMA的持有者可以授权他人使用其有关资料。PMA申请人通常是指为得到FDA批准而提交的PMA申请资料的所有权人或授权使用人。申请人可以是个人、合伙企业、公司法人、协会、科学或学术团体、政府机关或社会组织,或其它法人实体,常常是产品的发明者或开发者,并且最终成为制造者。FDA 法规规定的PMA审查决断时间为180天,但实际时间通常更长。在作出一个批准或否定决断之前,FDA的一个相应的顾问委员会可能会召开一个公开会议来进行审评,然后给FDA提供一个是否应批准该申请的委员会建议。FDA将批准与否的决定通知申请人后,会在网上发布一个公告。这个公告有两个作用:(1) 公布FDA作出该决定所依据的资料;(2) 给利益相关者提供一个在30天内向FDA诉求重新考虑该决定的机会。
关于上市前审批的规定位于联邦规章法典“Code of Federal Regulations”(CFR)第21部第814部分—“上市前审批”中。《联邦食品、药品与化妆品法案》第501(f)节规定,不符合PMA要求的第三类器械不得进入市场。
3 需要履行PMA的情形
PMA适用于医疗器械分类中最严格的第三类器械。搜索FDA的产品分类数据库可以找到器械产品的类别,可以得到器械的名称、类别和一个连接到联邦规章法典(CFR)的链接。CFR提供器械类型名称、识别码和分类信息。对于1976年医疗器械修正案发布之前已进入市场的第三类器械,CFR中给出了一个规则号。对需要PMA的第三类器械,CFR指出该器械为第三类,并提出一个要求取得PMA的生效期限。如果CFR的规定中指出“无要求上市前批准的生效期限”,则应提交第三类器械的510(k)。由于需要履行PMA的器械常常牵涉到一些新的概念,许多都不是医疗器械修正案之前上市的相同类型产品,因而在CFR中没有分类规定。对这种情形,产品类别数据库只给出器械类型名称和产品代码。
如果不清楚某一未分类器械是否需要PMA,可以使用“三字母产品代码”搜索PMA数据库和510(k)数据库(点击产品类别数据库网页顶端的超文本链接可以找到这两个数据库)。如果有FDA通过的510(k),且新器械与任意已获通过的器械实质性等同,则提交 510(k)即可。此外,有的新型器械在产品类别数据库中可能找不到。如果是一个高风险器械(具有第三类器械的特征)且发现不与任何一个第一、第二或适用于510(k)的第三类器械实质性等同,则该器械在美国上市前必须得到PMA批准。
对用于血液循环系统的器械,FDA有特别的审评要求。FDA的“生物、评价、研究中心”(Center for Biologic, Evaluation, Research - CBER)具有血液、血液制品、细胞疗法以及与其相关的某些医疗器械方面的完整的专业知识。为了利用这些专业知识,凡用于血液采集和处理程序以及用于细胞疗法的医疗器械的上市申请或研究申请(上市前告知、上市前审批和临床研究器械豁免),都由CBER进行审评。虽然这些产品由CBER审评,但仍适用医疗器械法规。由CBER进行审评的医疗器械目录可以上互联网查到。CDRH的上市前审批指南和由CBER进行审评的具体医疗器械指南都可以联网或与FDA接洽获得。
4 PMA申请
PMA申请资料是申请人向FDA提交的用以展示第三类器械的安全性和有效性的符合科学性和法规性要求的文件。PMA申请资料中有行政管理成分,但好的科学成分和科学撰文是获得PMA批准的关键。如果PMA申请资料中缺少管理清单上列明的成分,FDA将拒绝此PMA申请并停止进行深度的科学和临床数据审查。如果PMA申请资料中缺少建立在充分的科学推论基础上有效的临床信息和科学分析,将会延迟FDA的审查和批准。如果PMA申请资料不完整、不准确、不系统、缺少关键信息、粗劣编制,也可导致延迟批准或驳回。器械制造商在向FDA寄送PMA申请资料前应先进行内部质量控制审查,以保证申请资料具有充分的科学性,并且编制完美。
资料的技术部分应包含数据、信息,使FDA能据此判断批准或不批准该申请。技术部分又通常分为非临床的实验室研究和临床调查两部分。前者应包含微生物学、毒理学、免疫学、生物相容性、压力、磨损、保存期限等实验室试验或动物试验数据。用于安全性评价的非临床研究必须按照21CFR Part 58(针对非临床实验室研究的优良实验室规范)进行。后者应包含研究方案、安全性和有效性数据、不良反应和并发症、器械失灵和替换、患者信息、患者投诉、所有个体受试者的数据列表、统计分析结果,以及临床调查中获得的任何其它信息。
5 PMA补充/修正(PMA Supplements and Amendments)
PMA补充/修正是申请人向FDA提交对最初的PMA申请资料做出变更/修正的文件。虽然PMA补充适用于已获批准的PMA,但在很多情况下,对于一个还未获批准的PMA或PMA的补充文件也可以进行修正。
具体说来,PMA补充是申请人就一个已获PMA批准的器械所发生的对安全性和有效性有影响的变化所补充提交的资料。而就正在审查中的PMA补充资料再次向FDA提交的补充资料叫做补充资料的修正。PMA修正包括对一个批准前的PMA或PMA补充所提交的所有补充资料,或就一个批准后的PMA或PMA补充所做的后续反应。这种情形与“临床研究器械豁免”(Investigational Device Exemption - IDE) 情形的补充资料定义用语稍有不同:IDE补充是指一个IDE批准后对其提交的任何补充资料,IDE修正是指一个IDE获得批准前对其提交的任何补充资料。
6 PMA审评程序
对PMA申请进行的审评包含四个步骤:
(1) 由FDA工作人员对申请资料的完整性进行形式审查和有限的技术审查(立档审查);
(2) 由适任的FDA审查人员进行深入的科学审查、形式审查和质量体系审查;
(3) 由适任的专家小组进行审评并提出建议(专家组审评);
(4) 最终审议、归档、发出FDA的决定通知。
6.1 PMA申请的立档(21CFR.814.42)
在进行形式审查和有限的技术审查过程中,FDA依据FD&C Act和PMA法规(21CFR814)规定的资料要求以及拒绝立档政策对申请资料进行审查,以判断一项PMA申请是否应予立档。FDA制定了专门的资料检查表用于PMA申请的立档决定。
对一项申请予以立档意味着FDA已作出门槛判断——该申请资料的完整度已足以开始进行深入审评。FDA在收到PMA申请的45天内,将通知申请人是否已对该申请立档。通知函中有PMA参考号和FDA对该PMA申请的立档日期。如果适用于加快审评情形,也会在此时告知。立档日期是表示审评机构收到一项接受立档的PMA申请的日期,180天的PMA审评期限从这一天开始算起。
对于不符合最低门槛要求的申请,FDA不予立档进行实质性审评。如果资料中的信息或数据表达含糊、不完整,或经不起严格的科学审评,FDA可以认为该PMA申请不完整,不予立档。
对于不予立档的PMA申请,FDA会将拒收的原因通知申请人。通知中会给出申请资料中导致不予立档的缺陷,也会给出PMA参考号。FDA会建议制造商必须补充哪些资料,或采取哪些步骤,使申请得以符合立档要求。对于不予立档的申请,申请人可以:
(1) 补充符合FD&C Act第§515(c)(1)(A)-(G)节和21 CFR 814.20要求的资料后,重新提交PMA申请。重新提交的申请中必须标明原始提交的申请中的PMA参考号。如果重新提交的PMA申请被接受立档,则FDA接受重新提交的申请的日期为立档日期。
(2) 于收到拒绝立档通知的10个工作日内,书面提出与器械审评办公室主任就FDA不予立档的决定进行一次非正式会谈的请求。FDA将在收到请求后的10个工作日内进行该次非正式会谈,并在非正式会谈后的5个工作日内作出立档与否的决定。如果FDA此时接受对该PMA申请立档,则作出接受立档决定的日期为立档日期。如果FDA不改变拒绝立档的决定,申请人可向CDRH主任提出再次审议请求。CDRH主任的决定将作为公正审评意义上的最终行政裁定。
6.2 深入审查
接受立档以后,FDA开始对PMA申请进行实质性审查。审查过程中,FDA如果需要申请人补充任何为使FDA完成审查所必须的信息,会向申请人发出重要缺陷或轻微缺陷通知书。在PMA立档后的100天内,申请人可以请求与FDA会谈,讨论对该申请的审查情况。从“PMA百日会谈程序及后续缺陷指南——CDRH和企业使用,最终版”中可以找到“百日会谈”的程序。如果申请人主动提交或应FDA的要求提交了PMA修正申请,其中有出自于先前未报告过的研究的重要新数据、出自于先前报告过的研究的重要更新数据、对先前提交的数据所做的详细的新分析结果、或先前遗漏的重要的必须信息,审评期限可延至180天。
6.3 专家组审评
FDA可以委托一个外部专家组(顾问委员会)对PMA申请进行审评。一般情况下,同一种器械中第一个提交的PMA申请,FDA都会交给一个适任的顾问组进行审评和提出建议。此后,一旦FDA确信在判断该种医疗器械的安全性和有效性方面所面临的关健问题已经明了,并且FDA已具备了处理这些问题的能力,便不再把后面接受的同种器械的PMA申请交给专家组审评,除非某一个特别的申请中存在一个只有交给专家组审评才能得到最佳处理的问题。FDA可以将PMA申请资料或其中的有关部分交给顾问委员会中的每一个成员进行审评。审评过程中,FDA可能会与申请人或顾问委员会沟通,以便对顾问委员会成员可能提出的问题做出反应,或向顾问委员会提供补充信息。与申请人和顾问委员会进行的所有沟通,FDA都会存档。
对交给顾问委员会进行审评的PMA项目,顾问委员会必须按照21 CFR 14的规定举行一次公开的审评会。审评完成后,顾问委员会必须向FDA提交一份包括委员会对该PMA项目的建议和提出建议的根据的最终报告。顾问委员会报告和建议的形式可以是一份由委员会主席签名的会议记录。
FDA在综合考虑会议记录、专家组建议和其它信息之后对PMA申请做出最终决断。FDA会把是否同意专家组建议以及还需申请人补充哪些信息的情况通知申请人(可予批准和不予批准的决定)。如果该申请可予批准,申请人必须同意“批准条件”。
6.4 批准通知
FDA应在PMA立档日之后的180天内完成该项PMA审评以及顾问委员会报告和建议,并发出下列之一:
(1) 依据§814.44(d)的批准令;
(2) 依据§814.44(e)的可予批准信函;
(3) 依据§814.44(f)的不可批准信函;
(4) 依据§814.45的否决令。
6.4.1 批准令
FDA于审议了顾问委员会的最终报告后,如果没有发现PMA否决条款(§814.45)中的任何适用项,即会向申请人颁发该PMA已获批准的命令。FDA以产品说明(labeling)的最终文稿作为批准PMA申请的基础,条件是申请人要在产品进入市场前向FDA提交一份最终印刷版的产品说明。FDA会将该PMA的批准情况向社会公布,把宣布批准决定和作为批准依据的安全性有效性资料概要(SSED)的公告放到互联网上。概要中包括该器械可能存在的对健康的任何不良作用。公告还给申请人和其它利益相关者提供了一个依据FD&C Act第515(d)(3)节的规定对该项FDA批准决定提请行政复议的机会。每个季度,FDA还会在联邦公报(Federal Register)上刊登一个本季度发布过的批准公告的目录。依据§814.9,每一个批准公告发布后,该PMA档案中的数据和资料即可供公众查阅。
6.4.2 可予批准信函
如果一项PMA申请实质上符合FD&C Act的要求,并且FDA确信当申请人补交了有关具体资料或同意了具体条件以后可以批准该申请,FDA会向申请人寄发一封可予批准信函。信函中会说明作为批准的前提要求申请人补交的资料或要求申请人满足的条件。例如,FDA可以提出下列批准条件:
(1) 提交批准信函中列出的一些资料,比如产品说明终稿;
(2) 由FDA对生产场所进行一次现场审查,证明生产设施、方法和质量控制符合质量体系规定(21 CFR 820),并且,适用时,查证与批准该PMA相关的一些记录;
(3) 依据FD&C Act第515(d)(1)(B)(ii)节或520(e)节,对该器械的销售、流通或使用设置的一些限制。批准后可以要求申请人同意批准后继续进行研究,仅限于处方使用,或要求申请人对器械的使用者进行培训。还可能要求申请人进行上市后监督、跟踪。
申请人回复可予批准信函时,可以:
(1) 按要求做出修正;
(2) 将可予批准信函视为对该PMA申请的否决(21 CFR 814.45),并以发再议请求书(21 CFR 10.33)的方式要求行政复议[FD&C Act第515(d) (3)节];
(3) 撤回该PMA申请。
6.4.3 不可批准信函
如果FDA确信由于不符合§814.45(a)中的一条或几条因而不能批准该申请,或由于申请资料中缺乏关键信息而无法做出批准决定时,FDA会向申请人寄发一封不可批准信函。不可批准信函会说明申请资料中存在的缺陷,包括依据FD&C Act第515(d)(2)(A)-(E)节的规定而否决批准的每一个理由。可行的情况下,FDA会告知使该PMA申请变为可予批准的必要做法。
申请人回复不可批准信函时,可以:
(1) 按要求做出修正[依据§814.37(c)(1),此类修正属于重要修正];
(2) 将不可批准信函视为对该PMA申请的否决(21 CFR 814.45),并以发再议请求书(21 CFR 10.33)的方式要求行政复议[FD&C Act第515(d) (3)节];
(3) 撤回该PMA申请。
在下列情况下,FDA将PMA申请视为申请人主动撤回:
(1) 在FDA寄发修正要求后180天内,申请人未对该要求做出书面答复;
(2) 在FDA寄发可予批准或不可批准信函后180天内,申请人未对信函做出书面答复;
(3) 申请人向FDA提交撤回该PMA申请的书面通知。
6.4.4 否决令
如果申请人不遵守PMA法规的要求,或者FDA认为FD&C Act第515(d)(2)(A)-(E)节中关于否决PMA的任何一条理由适用,FDA可以否决该PMA申请。此外,FDA还可以依下列任一理由否决PMA:
(1) 在重要事实上存在不实命题;
(2) 器械的说明文字不符合第801部分关于说明的规定,或第809部分关于人用体外诊断产品的规定;
(3) 申请人不允许FDA审查人员到器械生产现场审查生产设施和管理控制措施,或获取、复制与该申请获得批准相关的全部现场记录;
(4) PMA资料中叙述的一个重要的非临床的实验室研究情况不符合21 CFR 58中的GLP规定,并且没有解释该项不符合情况的原因。或者解释了原因,但该实验所用的方法与GLP法规要求之间的差别无法支持该研究结果的有效性;
(5) PMA资料中叙述的任一人体临床研究项目,未能按照21 CFR 56关于机构审查委员会的规定或21 CFR 50关于知情同意的规定执行,因而受试人的权益或安全没有得到充分保护。
FDA依据§814.17发出对PMA申请的否决令。否决令中会告知申请人资料中存在的缺陷,包括依据FD&C Act第515(d)(2)节和第814部分的规定而予以否决的每一个理由。可行的情况下,也会告知申请人以可予批准的形式提交该PMA申请的必要做法。否决令中还包含申请人可以依据FD&C Act第515(d)(3)节的规定要求复议的告知。
7 PMA收费
自2002年10月1日起,FDA开始收取PMA审查费。2002年10月26日,医疗器械审查收取用户费(user fee)的规定和2002现代化案(Modernization Act of 2002)被写入法律。这项法律批准FDA就医疗器械审查收取费用(包括PMA审查)。
2012财政年度(2011年10月1日至2012年9月30日),对PMA申请的收费规定如表1所示。
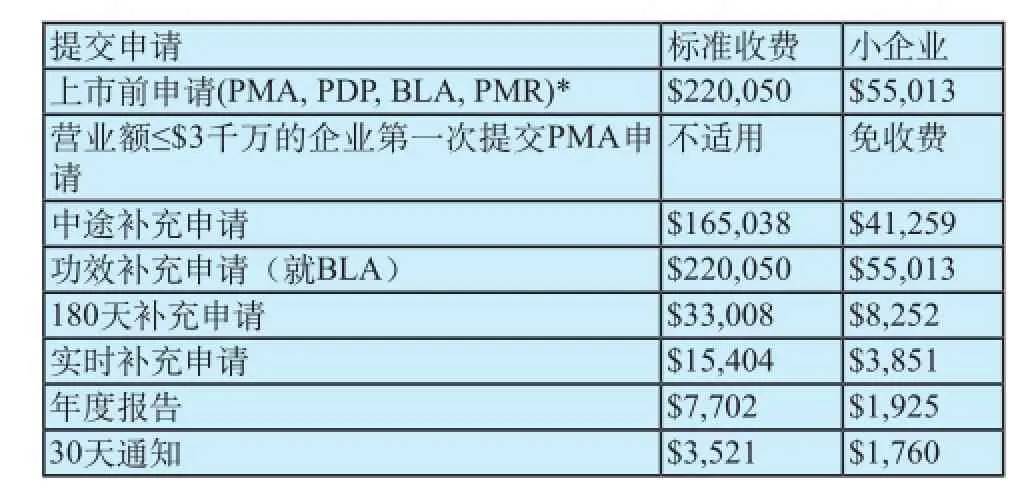
表1 2012财年器械审评用户费(美元)Tab.1 FY 2012 device review user fees($)
表1中所列的申请项目都必须按规定交费,除非申请人有资格免除费用或得到豁免。小企业有资格减少费额。必须在提交申请的同时或之前交费。如果没有付清所有欠费,FDA将按申请资料不完整处理,不予立档。
根据不同国家的具体情况,各国对高风险医疗器械的审批方式和法规要求不尽相同。以上美国对高风险医疗器械审批的做法可供我国医疗器械监管中参考或借鉴,也可供欲向美国出口医疗器械的企业参考。
USA Approval of High-risk Medical Device
【 Writer 】Chang Yongheng
China center for pharmaceutical International excharge, Beijing, 100082
During the practice of supervision and management of medical device in different countrie, the strict regulatory and needs of the program by the regulations is to be determined by the risk level of the medical equipment.This paper brie fl y describes the regulatory requirements of the United States to enter the market for high-risk medical device.
medical device, act, risk, pre-market approval
TH77
10.3969/j.issn.1671-7104.2013.02.016
A
1671-7104(2013)02-0132-05
2013-01-13
常永亨,主任,E-mail: cyh0010532@sina.com
