18FDG-PET/CT评价顺铂联合吲哚美辛及其衍生物对Lewis肺癌治疗效果的实验研究
2013-02-24高继东张彩霞陆国秀徐微娜于树鹏
高继东 张彩霞 陆国秀 徐微娜 于树鹏
1 (中国医科大学附属盛京医院 沈阳 110004)
2 (解放军第四六三医院 沈阳 110042)
18FDG-PET/CT评价顺铂联合吲哚美辛及其衍生物对Lewis肺癌治疗效果的实验研究
高继东1,2张彩霞1陆国秀1徐微娜1于树鹏1
1 (中国医科大学附属盛京医院 沈阳 110004)
2 (解放军第四六三医院 沈阳 110042)
为评价吲哚美辛及其衍生物组胺吲哚美辛对鼠Lewis肺癌的治疗效果,建立40只Lewis肺癌昆明小鼠腋下移植瘤模型,并随机分为四组:顺铂(DDP)治疗组、顺铂+吲哚美辛(DDP+Indomethacin IN)治疗组、顺铂+组胺-吲哚美辛(DDP+His-IN)治疗组及生理盐水对照组。各组小鼠于治疗前后各行PET/CT显像及取眼眶血0.2 mL,留取肿瘤组织进行组织学检测。结果显示,治疗后不同治疗组与生理盐水对照组比较靶本比均有显著性差异(P<0.05),各组治疗后TNF-α含量均升高,以DDP+His-IN组更为显著;抑瘤率未见明显差异(P>0.05)。表明IN、His-IN与DDP联合用药抗肿瘤效果好,尤其DDP与His-IN联合应用抗肿瘤效果更佳;另外,T/B 比值变化能较早反映化疗药物的抗肿瘤效果。
吲哚美辛,Lewis肺癌,TNF-α,正电子,18FDG-PET/CT
当前,国内外治疗肿瘤的方法有手术切除病灶、化疗、放疗等,手术治疗仅适应肿瘤早期及中早期患者;而多数中晚期患者,只能用化疗及放疗才能缓解病情及延长生存期,所有的化疗及放疗对人体均有较大的副作用,并且肿瘤在放、化疗治疗过程中还容易出现耐药,使肿瘤治疗效果不佳。近年来有研究证实传统的抗炎抗风湿和解热镇痛的非甾体类抗炎药吲哚美辛,对结肠癌、胃癌、肺癌、喉癌、白血病等各种恶性肿瘤均有显著的治疗效果[1]。18FDG-PET/CT不仅能反映肿瘤细胞的增殖活性,而且能在活体内直接显像,用其评价肿瘤细胞的辐射效应与在体动物实验结果具有更好的可比性[2]。本文报道将常规用的抗肿瘤化疗药物顺铂与吲哚美辛及其衍生物组胺吲哚美辛一起用于抗肿瘤方面的研究,同时,应用18FDG-PET/CT靶本比(T/B)值、病理改变、肿瘤坏死因子(TNF-α)含量及抑瘤率等评价上述药物对鼠Lewis肺癌的治疗效果。
1 材料与方法
1.1实验材料和仪器
Lewis肺癌瘤株引自中国医学科学院药物研究所。雄性昆明小鼠40只,鼠龄6周,体重(20±2) g,购于中国医科大学盛京医院实验动物中心。
吲哚美辛购自山西云鹏药业有限公司,纯度98.5%;组胺吲哚美辛:纯度>95%,委托沈阳药科大学协助合成;顺铂购自上海科兴商贸有限公司;TNF-αELISA试剂盒购于武汉博士德生物工程有限公司。PET/CT显像仪采用美国GE Discovery LS PET/CT系统,配置为16排螺旋CT;加速器为美国GE公司生产的MINItrace。显像剂:18F-FDG,pH值为5.6,放化纯>95%。
1.2小鼠Lewis肺癌模型制备及分组
将购买的荷Lewis肺癌皮下移植瘤模型鼠脱臼法处死后立即取生长良好的肿瘤组织5 g用研磨器磨碎,加生理盐水稀释成1×106细胞悬液。40只昆明小鼠,每只注射0.2 mL细胞悬液,接种于右前肢腋部皮下,肿瘤长径1.0–1.5 cm左右,将模型随机分为四组,每组10只。
1.3抑瘤实验
四组给药剂量分别为:顺铂组0.4 mg/kg、顺铂+吲哚美辛组 0.4 mg/kg+3.5 mg/kg、顺铂+组胺-吲哚美辛组0.4 mg/kg+3.5 mg/kg、生理盐水对照组0.2 mL,均采用腹腔注射法按剂量给药,一日一次,连续给药7天。每次给药前用游标卡尺测量肿瘤长径(a)、短径(b),并按公式V=1/2ab2计算肿瘤体积。停药2天后行PET/CT扫描,眼球取血后以颈椎脱位法处死小鼠,取出完整肿瘤组织称重。按体积法计算各组的抑瘤率,抑瘤率(%)=(1−实验组平均体积/对照组平均体积)×100%。
1.4 PET/CT显像
所有肿瘤鼠治疗前行PET/CT显像,各组肿瘤鼠经治疗7天、停药2天后再次行18FDG-PET/CT显像。具体显像方法:每只昆明小鼠尾静脉注射3.7 MBq /200 μL18F-FDG,利用CT进行透射扫描。采集条件为电压120 kV、电流80 mA、0.75 s/周、螺距0.875 mm、层厚2.5 mm、矩阵512×512,图像融合时转为144×144。扫描视野包括头、胸、腹、盆腔及会阴部。PET发射扫描采用三维(3D)采集,矩阵为128×128,2.5–3 min/床位,轴向视野为18 cm,采集范围同CT扫描,图像重建采用有序子集最大期望值迭代法(OSEM),融合图像重建采用3DRAMLa方式,利用CT透射扫描数据对PET图像进行衰减校正,校正后的图像与CT图像进行融合。每次显像后测定肿瘤的大小及靶本比计数值(T/B),同时观察CT图像的变化。
1.5 ELISA法测定TNF-α含量
所有小鼠于治疗前及第二次PET/CT显像结束后分别每只眼球取血0.2 mL,离心后留血清置于–20ºC冰箱中保存。测定TNF-α含量时,将事先放在–20ºC冰箱中保存的血清取出,与TNF-αELISA试剂盒中提供的生物素标记抗体先后加入酶标板孔反应后,PBS洗涤。随后加入过氧化物酶标记的亲和素反应;经过PBS的彻底洗涤后用底物TMB显色。TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下最终转化成黄色。用酶标仪在450 nm测定OD值,将TMB空白显色孔设为对照。所有的标准品和样品吸光值减去TMB空白显色孔的吸光值后,在坐标纸上画出曲线,以吸光值作为纵坐标,以浓度作为横坐标。

图1 对照组HE染色可见肿瘤细胞胞核蓝染,核大,无明显的肿瘤细胞坏死Fig.1 The control group tumor cell nucleus were blue, large, tumor necrosis was not obvious.
1.6病理观察
各组小鼠第二次PET/CT显像完毕后以颈椎脱位法将其处死,取出完整肿瘤组织,用质量分数4%的多聚甲醛缓冲液固定,石蜡包埋后切片,行HE染色,于光学显微镜下观察各治疗组肿瘤细胞的坏死情况。
1.7统计学处理
利用SPSS 17.0统计软件对数据进行统计学分析,所有计量资料结果以表示,两样本均数之间比较采用t检验,P<0.05有显著性差异。
2 实验结果
2.1病理改变
肉眼可见各治疗组肿瘤中心均有不同程度的坏死,尤其DDP+ His-IN组肿瘤中心有明显大片状坏死;光镜观察各治疗组的HE染色肿瘤细胞坏死程度不一,DDP+IN及DDP+His-IN联合治疗组肿瘤细胞坏死程度较单一顺铂治疗组明显,尤以DDP+His-IN更为明显。图1–4中左图的放大倍数为200,右图的放大倍数为400。

图2 顺铂组HE染色可见部分瘤细胞核固缩,胞浆红染Fig.2 Part of the tumor cell nucleus pycnosis, cytoplasm red can be seen in Cisplatin group HE staining.
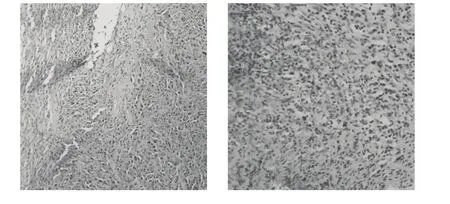
图3 顺铂+IN组HE染色可见到大片的肿瘤细胞胞核固缩,胞浆红染Fig.3 Large area of tumor cell nucleus pycnosis, cytoplasm red can be seen in Cisplatin+IN group.

图4 顺铂+His-IN组HE染色可见大面积肿瘤细胞坏死形成,胞核碎裂、溶解,红染增多Fig.4 Large area of tumor cell necrosis formation, cell nuclear fragmentation, dissolved, red increase.
2.2 ELISA法测定肿瘤坏死因子(TNF-α)含量
治疗前的各组荷瘤鼠血清中TNF-α的含量基本相近,治疗后不同治疗组均有不同程度升高,但以DDP+His-IN组升高更为显著。不同治疗组与生理盐水对照组比较,TNF-α的含量均有显著性差异(P<0.05),其中DDP+His-IN组与其它各治疗组亦有显著性差异(P<0.05)。给药前后的TNF-α含量见表1。
2.3各治疗组抑瘤率
各治疗组肿瘤体积增长相对缓慢,治疗后各治疗组的抑瘤率与对照组比较,肿瘤生长均受到抑制(P<0.05),各组肿瘤体积比较见表2。各治疗组均不同程度抑制Lewis肺癌的生长(P<0.05)。
表1 各治疗组TNF-α的含量比较Table 1 The comparison of TNF-α content of each treatment group

表1 各治疗组TNF-α的含量比较Table 1 The comparison of TNF-α content of each treatment group
组别Groups治疗前Before treatment治疗后After treatment对照组Control group顺铂组DDP group顺铂+IN组DDP+ IN group顺铂+His-IN组DDP+ His-IN group 0.66±0.19 0.71±0.18 0.68±0.23 1.13±0.37 0.70±0.14 1.32±0.45 0.69±0.25 1.98±1.04
表3 PET-CT显影肿瘤与对侧非肿瘤组织靶本比(T/B)比较Table 3 The T/B comparison among treatment group

表3 PET-CT显影肿瘤与对侧非肿瘤组织靶本比(T/B)比较Table 3 The T/B comparison among treatment group
组别Groups治疗前Before treatment治疗后After treatment对照组Control group顺铂组DDP group顺铂+IN组DDP+ IN group顺铂+His-IN组DDP+ His-IN group 2.97±0.76 3.37±0.83 2.86±0.47 2.14±0.55 2.60±0.57 1.68±0.51 2.81±0.63 1.36±0.68
表2 治疗各组对肿瘤生长抑制作用Table 2 Each treatment group inhibitory ratecomparison

表2 治疗各组对肿瘤生长抑制作用Table 2 Each treatment group inhibitory ratecomparison
组别Groups肿瘤体积 /cm3 Tumor volume抑瘤率 /% Inhibitory rate对照组Control group 5.67±1.11 __顺铂组DDP group 4.35±1.05 29.29顺铂+IN组DDP+ IN group 3.95±0.57 30.34顺铂+His-IN组DDP+ His-IN group 3.75±0.46 33.87
2.4 PET-CT显影肿瘤与对侧非肿瘤组织靶本比
各组荷瘤鼠在初次PET-CT显像所测得的肿瘤组织与对侧非肿瘤组织的靶本比较接近;治疗后PET-CT显像所测得的肿瘤组织与对侧非肿瘤组织的靶本比均降低,尤以DDP+His-IN组降低明显。治疗后不同治疗组与生理盐水对照组比较靶本比均有显著性差异(P<0.05),DDP组与DDP+IN组、DDP组与DDP+His-IN组比较靶本比均有显著性差异(P<0.05),DDP+IN组与DDP+His-IN组比较靶本比未见显著性差异(P>0.05)。给药前后肿瘤与对侧非肿瘤组织靶本比值(T/B)如表3,治疗前后对照组及DDP+His-IN组PET/CT显像见图5和图6。由图5可见,对照组治疗前肿瘤放射性浓聚明显,靶本比为2.1;治疗后肿瘤体积增大,靶本比较治疗前升高为2.3。由图6可见,DDP+His-IN组治疗前成像肿瘤放射性浓聚明显,靶本比为1.8;治疗后肿瘤局部放射性稀疏,靶本比较治疗前明显减低为0.68。

图5 对照组治疗前(a)和治疗后(b)PET-CT显像Fig.5 PET/CT imaging of control group before treatment(a) and after treatment(b).

图6 DDP+His-IN组治疗前(a)和治疗后(b)PET-CT显像Fig.6 PET/CT imaging of DDP+His-IN groups before treatment(a) and after treatment(b).
3 讨论
吲哚美辛(IN)是非甾体类抗炎药(NSAIDs)之一,多被用于解热、镇痛、抗炎及缓解风湿性疾病症状。研究发现IN有抗肿瘤作用,利用IN治疗甲状腺髓样癌、肝细胞肝癌动物的实验研究证实,其可抑制肿瘤生长和延缓转移发生[3,4]。通过流行病学调查、动物实验、临床应用证实了非甾体类抗炎药能诱导食管癌、胰腺癌和肝癌等多种肿瘤细胞的凋亡,通过抑制COX-2而起作用,且研究证实COX-2过度表达与肿瘤细胞的凋亡耐受、转移潜力的增加和血管生成增加有关[5];并且IN还具有抗肿瘤耐药作用[6]。高梅菊等[7]的关于IN对鼠的Lewis肺癌的治疗以及对放、化疗增敏作用的实验研究,显示IN使肿瘤细胞对放、化疗更敏感,使肿瘤放、化疗达到更好的疗效。本研究报道,病理组织学检查结果除对照组外,DDP治疗组、DDP+IN治疗组及DDP+His-IN治疗组的肿瘤细胞胞核均有不同程度的皱缩以及红染区域的增加,尤以DDP+His-IN治疗组的改变显著。周立坤等[8]用3H标记IN进行了一系列抗肿瘤动物实验的研究,结果证实IN具有较强的瘤组织亲和性,可选择性聚集于肿瘤组织处,并且在肿瘤组织内存留时间较其它组织明显延长。
临床上习惯用肿瘤大小变化作为评价近期疗效标准。在临床上肿瘤治疗后体积变化较慢,于短期内体积缩小不明显,即使观察到肿瘤于治疗后体积缩小,其残存肿块活性难于判断。本实验对抑瘤率进行分析可知,所有治疗组的抑瘤率均有不同程度的增加,虽然根据组织学结果以及TNF-α水平分析确定DDP+His-IN治疗组效果显著,但各治疗组间的抑瘤率差异并不显著,因此,单纯应用抑瘤率对肿瘤治疗效果进行评价,结果并不十分准确。
肿瘤化疗及放疗后形态学变化滞后于代谢活性的变化,所以,我们选择PET-CT对肿瘤组织摄取脱氧葡萄糖(FDG)的程度显像及靶/本比反映肿瘤细胞的活性非常重要的方法。若肿瘤组织摄取FDG降低,表明放、化疗有效,若肿瘤组织对FDG摄取增加或无变化,则说明肿瘤对化疗及放疗不敏感,无效患者应及时调整方案或变更治疗方式。PET-CT显像除能提供功能图像和精确的解剖定位,从影像学上反映肿瘤细胞的生物活性情况,还能有效地分辨残存病灶的活性[9]。PET/CT融合图像在提高放疗疗效基础上,对周围正常组织保护得更好[10]。治疗后病灶FDG摄取明显减低或接近正常组织表明治疗有效,PET显像肿瘤病灶FDG摄取明显降低或为阴性,是预后较好的指标,患者一般均可生存2年或2年以上;相反,治疗后肿瘤病灶FDG的摄取仍呈现高代谢灶,表明肿瘤病灶对治疗不敏感,往往提示预后不良,50%的患者可能在2年内死亡[11–15]。靶本比是利用ROI技术计算靶组织与本底的放射性分布比值,是核医学常用的半定量分析方法,可在一定程度上反映靶组织的葡萄糖代谢情况及肿瘤细胞的分子水平改变。本研究中各组荷瘤鼠治疗前PET-CT显像所测得的肿瘤组织与对侧非肿瘤组织的靶本比值较为接近;各治疗组治疗后PET-CT显像所测得的肿瘤组织与对侧非肿瘤组织的靶本计数(T/B)比值均有降低,尤以DDP+His-IN组明显,反映DDP、DDP+IN、DDP+His-IN均有抗肿瘤作用,且DDP+His-IN抗肿瘤作用尤为明显。
TNF-α是一个多功能细胞因子,由单核细胞和巨噬细胞产生,为一种多功能蛋白,具有抗肿瘤、调节机体代谢及诱导细胞分化,它对肿瘤细胞有直接杀伤作用,在体内可通过对肿瘤血管的促凝作用,使肿瘤缺血坏死。研究证明[16],TNF-α可抑制某些肿瘤细胞的增殖及诱导肿瘤细胞凋亡。魏希强等[17]研究发现肿rmhTNF与DDP具有协同作用,两药联合胸腔内注射可以作为非小细胞肺癌合并恶性胸腔积液患者的理想治疗方案,其疗效优于单用顺铂;IN与化疗药DDP同时应用,治疗后血清TNF-α水平升高,可直接杀伤肿瘤细胞[18]。IN具有调整机体免疫状态,刺激机体产生TNF、IL-2和INF等因子,因而具有直接抗肿瘤和辅助抗肿瘤作用[19],能协同提高TNF和IL-2抗肿瘤疗效。TNF-α与肺癌的预后和复发有关,血中TNF-α含量可反映机体抗肿瘤免疫状态,TNF-α水平升高有益于调动自身抗癌能力[20]。本研究于Lewis肺癌治疗前后测得的TNF-α水平的变化亦证实了各治疗组均有抗肿瘤的作用,与对照组比较差异显著(P<0.05),DDP+His-IN治疗组TNF-α含量明显升高,高于DDP组及DDP+IN组的治疗效果。各治疗组肿瘤HE染色肿瘤细胞坏死程度不一,DDP+IN及DDP+His-IN联合治疗组肿瘤细胞坏死程度较单一用DDP组使TNF-α升高更明显。这说明DDP+IN及DDP+His-IN可能有直接抗肿瘤和辅助抗肿瘤作用。
通过PET-CT显像、病理改变及TNF-α水平观察到DDP+IN、DDP+His-IN联合治疗肺癌效果高于单用DDP的效果,尤以DDP+His-IN治疗效果最强。PET-CT显像获得的T/B比值的变化与病理改变程度基本一致,表明T/B比值能反映肿瘤细胞的活性,能较早、灵敏、准确地反映抗肿瘤药物的效果,为修改肿瘤治疗方案提供重要依据。
1 Zhang H, Ye Y, Bai Z. The COX-2 selective inhibitorin dependent COX-2 effect on colon carcinoma cells is associated with the Delta1/Notch1 pathway[J]. Digestive Diseases and Sciences, 2008,53(8): 195–203
2 王利利, 秦颂兵, 娄成, 等.18F-FDG 摄取率评价肿瘤细胞辐射效应[J]. 核技术, 2011,34(3): 222–226
WANG Lili, QIN Songbing, LOU Cheng, et al. Evaluation of radiation effect on tumor cells by the uptake rate of18F-FDG in vitro[J]. Nuclear Techniques, 2011,34(3): 222–226
3 Quidville V, Segond N, Pidoux E, et al. Tumor growth inhibition by indomethacin in a mouse model of human medullary thyroid cancer: implication of cyclooxygenases and 15-hydroxyprostaglandin dehydrogenase[J]. Endocrinology, 2004,145(5): 2561–2571
4 谢勇, 吕农华, 周小江, 等. 吲哚美辛诱导肝癌细胞凋亡及与环氧合酶-2和凋亡调控基因表达关系[J]. 中华消化杂志, 2004,24(10): 604–607
XIE Yong, LV Nonghua, ZHOU Xiaojiang, et al. The effects of indomethacin on inducing apoptosis and expression of cyclooxgenase-2 and apoptosis regulating genes in human hepatocellular carcinoma cells[J]. Chinese Journal of Digestion, 2004,24(10): 604–607
5 DuBois R N. Selective COX-2 inhibitors potential for cancer prevention and treatment[A]. In 93 rd annual meeting, American Association for Cancer Research[C]. San Francisco, Program Proceedings Supplement, 2002, 46–53
6 才久波, 张彩霞, 高继东. 吲哚美辛对A549/DDP 细胞摄取99mTc-MIBI的影响及其逆转耐药性的机制[J]. 现代肿瘤医学, 2010,18(6): 1072–1074
CAI Jiubo, ZHANG Caixia, GAO Jidong. Effect of indomethacin on99mTc-MIBI uptake in cisplatin–resistant human lung cancer cells A549/DDP and its mechanism[J]. Journal of Modern Oncology, 2010,18(6): 1072–1074
7 高梅菊, 张彩霞. 吲哚美辛对鼠Lewis肺癌治疗及对方化疗增敏作用的实验研究[J]. 中国医科大学学报, 2008,37(5): 596–599
GAO Meiju, ZHANG Caixia. Therapeutic Effect of indomethacin in mice bearing lewis lung cancer[J]. Journal of China Medical University, 2008,37(5): 596–599
8 周立坤, 张彩霞. 氚标记吲哚美辛的亲肿瘤实验研究[J]. 中华核医学杂志, 2004,24(4): 209–210
ZHOU Likun, ZHANG Caixia. Experimental study of3H-IN in tumor[J]. Chinese Journal of Nuclear Medicine, 2004,24(4): 209–210
9 Andrade R S, Heron D E, Degirmenci B, et al. Posttreatment assessment of response using FDG-PET/CT for patients treated with definitive radiation therapy for head and neck cancers[J]. International Journal of Radiation Oncology Biology Physics, 2006,65(5): 1315–1322
10 周菊英, 王利利, 蔡晓君, 等. PET/CT对非小细胞肺癌精确放疗计划的影响[J]. 核技术, 2010,33(1): 75–78
ZHOU Juying, WANG Lili, CAI Xiaojun, et al. Impact of PET/CT on precision and accuracy of radiotherapy planning for patients with non-small cell lung cancer[J]. Nuclear Techniques, 2010,33(1): 75–78
11 Gutte H, Højgaard L, Kjaer A. Early clinical experience and impact of18F-FDG PET[J]. Nuclear Medicine Communications, 2005,26(11): 989–994
12 San José S, Arnaiz M D, Lucas A, et al. Radiation therapy alone in elderly with early stage non-small cell lung cancer[J]. Lung Cancer: Journal of the International Association for the Study of Lung Cancer, 2006,52(2): 149–154
13 Westerterp M, Sloof G W, Hpeksa O S, et al.18F-FDG uptake in oesophageal adenocarcinoma: linking biology and outcome[J]. Journal of Cancer Research and Clinical Oncology, 2008,134(2): 227–236
14 Marom E M, Sarvis S, Herndon J E, et al. T1 lung cancers: sensitivity of diagnosis with fluomdeoxyglucose PET[J]. Radiology, 2002,223: 453–459
15 Obrzut S, Pham R H, Vera D R, et al. Comparison of lesion-to-cerebellum uptake ratios and standardized uptake values in the evaluation of lung nodules with18F-FDG PET[J]. Nuclear Medicine Communications, 2007,28(1): 7–13
16 Rübe C E, van Valen F, Wifert F, et al. Ewing’s sarcoma and peripheral primitive neuroectodermal tumor cells produce large quantities of bioactive tumor necrosis factor-α(TNF-α) after radiation exposure[J]. International Journal of Radiation Oncology Biology Physics, 2003,56(5): 1414–1425
17 魏希强, 谢亚琳. 肿瘤坏死因子治疗肺癌恶性胸水的疗效观察[J]. 中华全科医学, 2010,8(8): 999–1000
WEI Xiqiang, XIE Yalin. Curative efficacy of recombinant mutant human tumor necrosis factor for malignant pleural effusions in patients with lung cancer[J]. Chinese Journal of General Practice, 2010,8(8): 999–1000
18 Kim C D, Sung M W, Lee S J, et al. The effect of prostaglandin in and its inhibitor on antibody-dependent cellular cytoxicity against human squamous cell carcinoma of head and neck[J]. Anticancer Research, 1999,19(1A): 455–459
19 蔡娟, 殷少军, 许福亮, 等. 肿瘤坏死因子α在非小细胞肺癌患者中的临床价值探讨[J]. 中国肿瘤临床与康复, 2002,9(4): 38–39
CAI Juan, YIN Shaojun, XU Fuliang, et al. Clinic significance of detection tumor necrosis factor alpha in patients with lung cancer[J]. Chinese Journal of Clinical Oncology and Rehabilitation, 2002,9(4): 38–39
20 Zhang C, Ao Z, Seth A, et al. A mitochondrial membrane protein defined by a novel monoclonal antibody is preferentially detected in apoptotic cells[J]. The Journal of Immunology: Official Journal of the American Association of Immunologists, 1996,157(9): 3980–3987
CLCR817.1
Experimental study of the effect of Cisplatin combined with Indomethacin and its derivatives for the treatment of Lewis lung carcinoma with18FDG-PET/CT
GAO Jidong1,2ZHANG Caixia1LU Guoxiu1XU Weina1YU Shupeng1
1 (Shengjing Hospital of China Medical University,Shenyang 110004,China)
2 (No.463 Hospital of Peoples Liberation Army,Shenyang 110042,China)
Background:Non-steroidal anti-inflammatory drug Indomethacin have been used in the treatment of fever, pain, inflammation and rheumatic disease. In recent years, some researches have confirmed that Indomethacin have the ability of assistant therapy on many kinds of malignant tumors, such as colon cancer, gastric cancer and lung cancer.Purpose:To evaluate the effect of Cisplatin combined with Indomethacin and Histamine-Indomethacin to Lewis lung cancer.Methods:40 male Kunming mice were used to establish Lewis lung cancer model. They were randomly divided into four groups: Cisplatin treatment group, Cisplatin+Indomethacin treatment group, Cisplatin+Histamine-Indomethacin treatment group and control group. Each mouse was given the PET/CT imaging and taken orbital blood for 0.2 mL before and after the treatment. Histological detection was given.Results:Ratio of targets were significantly different after the treatment, especially in Cisplatin+Histamine-Indomethacin treatment group. Each group TNF-α levels were increased after treatment and the Cisplatin+Histamine-Indomethacin treatment group was the most obvious. There was no obvious difference in tumor inhibiting rates.Conclusions:The results showed that Cisplatin combined with Histamine-Indomethacin could inhibit tumor growth and promote apoptosis of tumor cells better. The changes of the ratio of targets could reflect the effect of the chemotherapy drugs earlier.
Indomethacin, Lewis lung cancer, TNF-α, Positron,18FDG-PET/CT
R817.1
10.11889/j.0253-3219.2013.hjs.36.020304
辽宁省重点实验室基金(20060919)资助
高继东,男,1983年出生,2011年于中国医科大学获硕士学位,影像医学与核医学专业
张彩霞,zhangcx@sj-hospital.org
2012-12-04,
2012-12-28
