TA29-Barnase转基因雄性不育芥菜的获得
2013-02-24杨海鹏宋洪元
王 倩 杨海鹏 邹 敏 宋洪元
(西南大学园艺园林学院,南方山地园艺学教育部重点实验室,重庆 400715)
芥菜〔Brassica juncea(L.)Czern.et Coss.〕是我国特产蔬菜之一,营养丰富,经济价值较高,在我国南、北方均有种植,是重要的加工类蔬菜。在芥菜生产实践中广泛存在着诸如病毒病、先期抽薹、加工品质等问题(杨景华 等,2006),植物杂种优势的利用可以在一定程度上解决这些问题。由于芥菜类作物自交亲和指数非常高,杂种优势育种难以通过自交不亲和途径得以实现,导致长期以来芥菜类蔬菜品种选育都是以常规品种为主。虽然近年来利用细胞质雄性不育在芥菜优势育种上取得了一定的进展,但如何发掘、创造优良的芥菜雄性不育材料仍是当前芥菜雄性不育研究的重要内容之一。随着基因工程雄性不育系成功在油菜、玉米、菊苣等农作物上得到商业化应用(Kempken,2010),围绕花粉的发育过程,已通过多种途径建立了植物工程雄性不育系。利用具有特异时空表达特性的花药绒毡层特异启动子与解淀粉芽孢杆菌的Barnase核糖核酸酶基因融合,导入植物体内调控花粉发育,从而获得雄性不育材料成为其中应用最为普遍的方法。该方法分别在花椰菜(Reynaerts et al.,1993)、烟草(李胜国 等,1995)、油菜(钟蓉 等,1996)、甘蓝(沈革志 等,2001)、番茄(白玲 等,2002)、菜薹(曹必好和孟成民,2008)等作物上成功获得了雄性不育材料。基于对芥菜细胞质雄性不育机制的研究,Yang 等(2010)将来自线粒体的编码基因orf220导入茎用芥菜中获得雄性不育材料。相对于其他农作物,有关芥菜植物基因工程雄性不育的研究报道较少,为拓宽芥菜雄性不育资源,本试验将烟草绒毡层TA29启动子驱动下的Barnase基因通过农杆菌介导法转入茎用芥菜,获得了转基因雄性不育芥菜植株,从分子水平、细胞学水平和结籽情况等方面调查分析了转基因植株的育性,结果显示Barnase基因在芥菜绒毡层特异表达后能导致彻底的雄性不育,但伴随花朵变小,雌蕊、种荚变短,结籽数量下降的现象。
1 材料与方法
1.1 质粒和菌株
含雄性不育基因的表达载体pCABarTA29-Bn的农杆菌(Agrobacterium tumefaciens)EHA105 由南方山地园艺学教育部重点实验室保存(图1)。
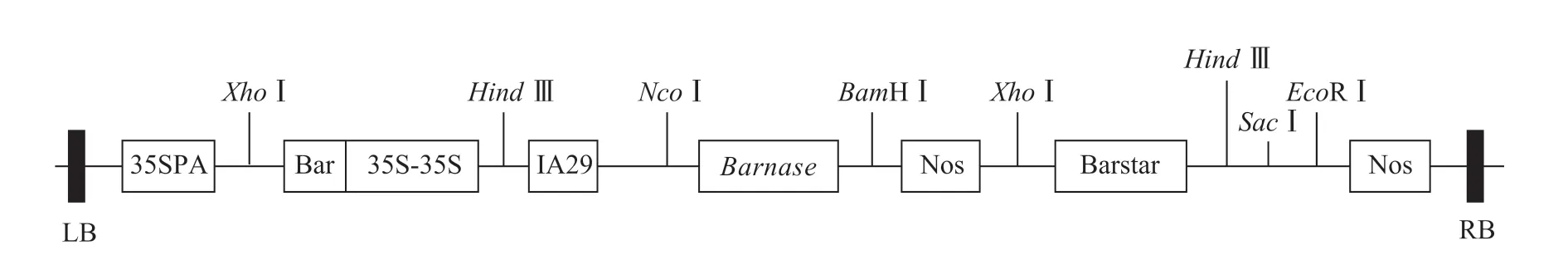
图1 pCABarTA29-Bn 植物表达载体
1.2 试验材料
试验于2012年2月7日~7月15日在西南大学南方山地园艺学教育部重点实验室进行。供试芥菜品种为渝丰榨菜,由重庆科光种苗有限公司提供。
TaqDNA 聚合酶和DNA marker 购自全式金生物工程有限公司;羧苄青霉素(Carbenicilin)、卡那霉素(Kanamycine)、链霉素(Streptomycin)、吲哚乙酸(IAA)、6 苄基腺嘌呤(6-BA)以及细菌培养基均购自北京鼎国生物技术公司;植物DNA 提取、植物组织培养以及显微制片的各种化学药品均为国产分析纯。除草剂Basta(草丁膦,主要成分为PPT)购自日产化学工业株氏会社。
1.3 转基因芥菜植株的获得
采用农杆菌介导的叶盘转化法(王关林和方宏筠,2002;曹必好 等,2003)进行转化,并略有改动:取苗龄7 d 的渝丰榨菜幼苗的下胚轴,切成1 cm 长的茎段,在分化培养基(MS+2 mg·L-16-BA+0.2 mg·L-1NAA+3%蔗糖+0.6%琼脂)上预培养2 d,用浓度OD600=0.5~0.6的农杆菌菌液侵染10 min,转到分化培养基上共培养2 d,随后在筛选培养基(MS+2 mg·L-16-BA+0.2 mg·L-1NAA+8 mg·L-1PPT+400 mg·L-1Carb+3%蔗糖+0.6%琼脂)上进行多次筛选,每14 d 换1次培养基,最后将再生植株转到生根培养基(MS+0.2 mg·L-1NAA+8 mg·L-1PPT+400 mg·L-1Carb+3%蔗糖+0.6%琼脂)上进行生根培养。
1.4 转基因芥菜植株的分子检测
采用改进的CTAB 法提取芥菜总DNA(宋洪元 等,2010)。以提取的总DNA 为模板,用TA29启动子上游引物(TA29-1:5′-CGCGGTACCCCAAGATTGCATAAG-3′)和Barnase基因下游引物(BN-2:5′-CCCCTCGGATCCGTTATCTGATCTTTGTA-3′)进行TA29启动子及下游Barnase基因的PCR检测。反应体系:模板DNA 1μL(30 ng·μL-1),上下游引物各1μL (10 ng·μL-1),dNTP Mixture 0.2μL (2.5 mmol·L-1),MgCl22.0 μL(25 mmol·L-1),TaqDNA 聚合酶0.3 μL(5 U·μL-1),10×Buffer 2.5 μL,ddH2O 补至总体积为25 μL。PCR 扩增反应程序:94℃预变性5 min;94℃变性40 s,56℃退火40 s,72℃延伸2 min,30个循环;72℃延伸5 min。扩增产物用1.0%琼脂糖凝胶电泳检测。
1.5 转基因芥菜植株花器官的观察和授粉试验
取转基 因以及野生型芥菜植株当天开放的花,观察比较雄蕊和花药的形态结 构。分别调查雄性不育转基因芥菜植株自交以及用野生型芥菜植株的花粉进行人工授粉后的结籽情况。
1.6 转基因芥菜植株雄性不育花药、花粉发育的细胞学观察
取芥菜转基因雄性不育株和野生型可育株的不同大小花蕾,投入FAA 固定液固定至少24 h,之后按照常规石蜡法制作切片(邹瑞昌 等,2012):各级酒精脱水→透明→浸蜡→包埋→切片→展片→脱蜡→染色,最后在LEICACTR5000 显微镜下镜检并照相。
2 结果与分析
2.1 转基因芥菜植株的获得
芥菜幼苗下胚轴经农杆菌菌液浸染后,在含除草剂有效成分8 mg·L-1PPT 的培养基上进行多轮筛选,筛选过程中非转化个体逐渐黄化死亡,抗性个体成苗并正常生根,生根后移栽到土壤中,获得5株成活转基因芥菜植株(图2)。
提取成活植株DNA,利用引物TA29-1 和BN-2 进行PCR 扩增,在5株转基因植株中均获得了约630 bp 的DNA片段(图3),表明外源目的基因已整合到芥菜植物基因组中。

图2 转化过程中芥菜植株生根和移栽成苗
2.2 转基因芥菜植株的花器官形态
尽管获得的转基因芥菜植株与野生型植株形态间无明显差异,但开花时转基因植株花朵偏小,并伴随花瓣较小、雌蕊短且粗、雄蕊短缩的现象;而野生型植株则表现为花瓣大、雌蕊细长、雄蕊粗壮(图4)。同时,转基因植株花药瘦小、干瘪、无花粉囊及花粉;野生型植株则花药饱满,花粉囊充满大量花粉(图5)。
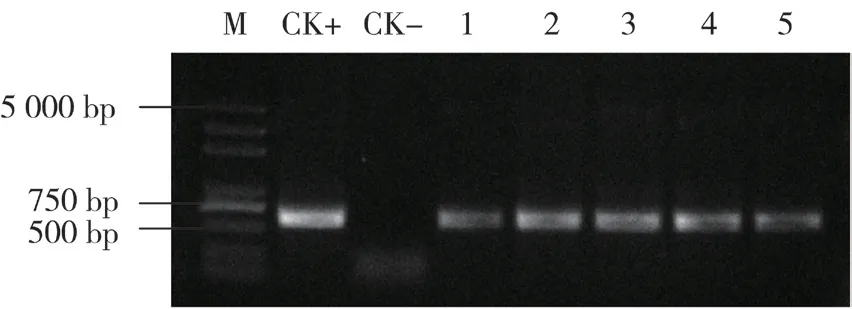
图3 转基因芥菜植株的PCR检测结果

图4 转基因芥菜植株花器官的形态结构

图5 转基因芥菜植株花药的形态结构
2.3 转基因芥菜植株的花药发育过程
在TA29启动子的作用下,Barnase基因在花药绒毡层组织细胞内表达,产生水解绒毡层组织细胞内的RNA 的核糖核酸水解酶,阻碍花药绒毡层的发育,从而导致雄性不育的产生。显微切片结果显示(图6),花药发育早期,转基因芥菜植株与野生型植株均在花药的4个角隅处形成正常的药室内壁、中层、绒毡层和造孢细胞,呈蝴蝶形排列(图6-1,6-4)。野生型植株进入减数分裂期,花粉母细胞变为椭圆形,绒毡层细胞体积增大;进入单核初期,刚释放出来的游离小孢子形状不规则,细胞壁很薄;单核晚期,细胞壁逐渐加厚且趋于圆球形,绒毡层开始降解(图6-2);单核小孢子发生有丝分裂后,进入二核期,绒毡层只余残迹,生殖核再次有丝分裂形成两个精核,花粉粒趋于成熟,绒毡层最后在花药即将开裂释放花粉粒时已完全消失(图6-3)。而转基因植株的花药中,当花粉母细胞开始进入减数分裂时,药室内壁的绒毡层细胞已经开始降解,并伴随花粉母细胞的退化(图6-5);减数分裂后绒毡层细胞和花粉母细胞进一步退化解体,无小孢子母细胞释放,药室呈现空洞状(图6-6)。
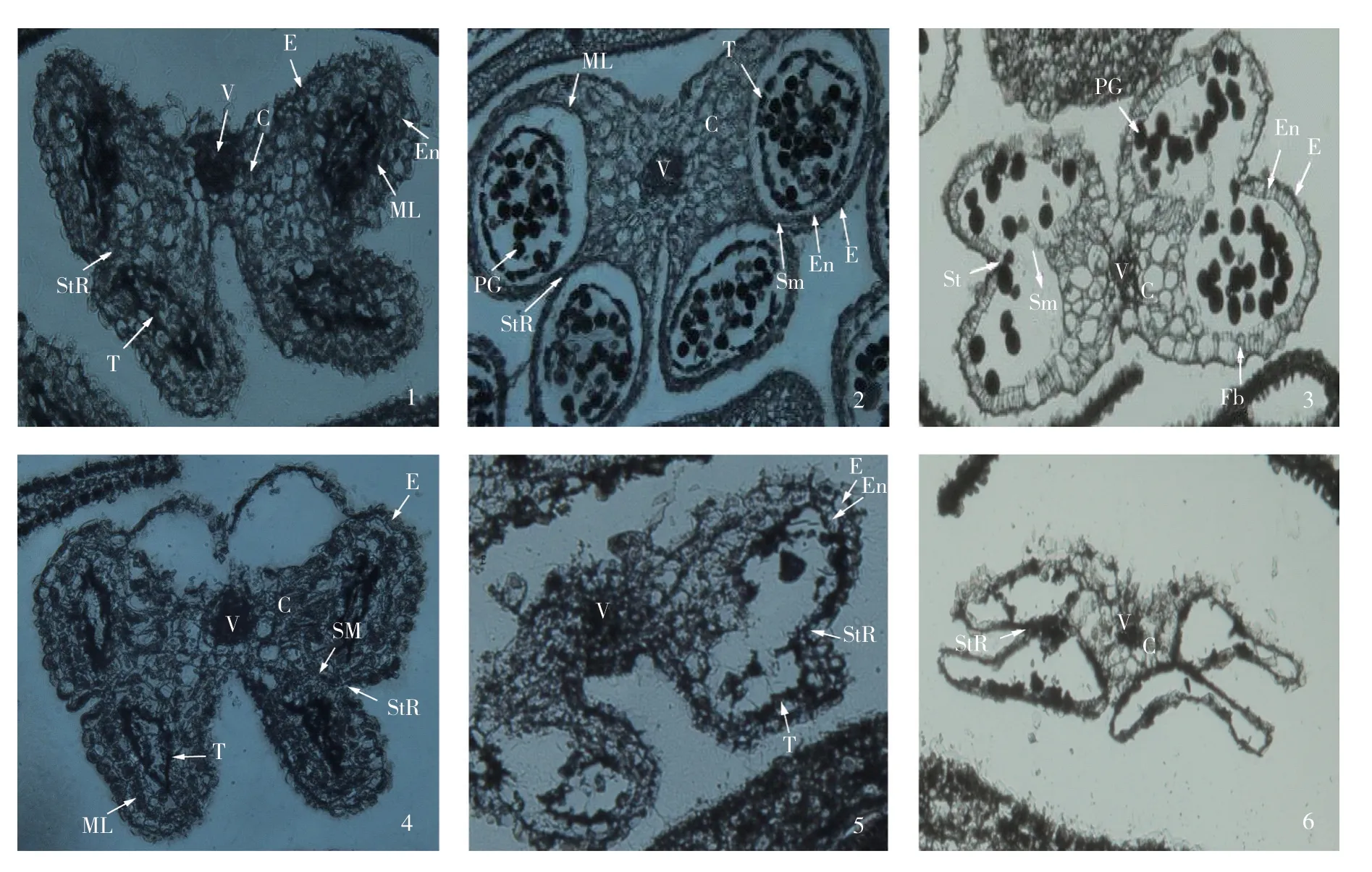
图6 转基因芥菜植株的花药发育过程
2.4 转基因芥菜植株的结实性
转基因雄性不育芥菜植株开花后,自交花朵的果荚基本不能膨大,部分脱落,无种子形成(图7-A1),而野生型植株则结籽正常(图7-B)。转基因植株用野生型植株的花粉授粉后,基本均能结实(图7-A2),但与野生型植株(图7-C2)相比果荚较短,不饱满,且种子数少(图7-C1)。该结果显示烟草TA29启动子驱动Barnase基因在芥菜植株的花药绒毡层表达后,除了影响绒毡层细胞的发育从而获得雄性不育外,对雌蕊以及其他花器官的发育也有一定的影响。

图7 转基因芥菜植株的结籽情况
3 结论与讨论
TA29是从烟草中克隆的一个绒毡层特异表达基因,在烟草减数分裂期到小孢子有丝分裂期的绒毡层中特异表达,在其他器官和花的其他组织中均没有表达 (Koltunow et al.,1990)。该启动子驱动Barnase基因在绒毡层中表达后获得了烟草和油菜雄性不育材料(Mariani et al.,1990)。随后基于TA29-Barnase雄性不育的转基因油菜获得商业化应用。然而,后来有研究显示TA29-Barnase基因导致的雄性不育对温度敏感,在温度升高后转基因植株出现不同程度的育性恢复现象。如在转基因烟草和油菜的研究中发现,当温度低于20℃时不育性稳定,温度升高到25℃时开始转育,30℃时大部分可育(钟蓉 等,1996)。另外,TA29-Barnase基因转化甘蓝后发现雄性不育植株的园艺学性状与未转化植株相同,不育植株的花朵表现为雄蕊完全退化,但蜜腺和雌蕊健全,能接受外来花粉,杂交结实率较高,但是转基因植株中存在全不育植株和半不育植株,半不育植株在开花中后期出现育性恢复现象(沈革志 等,2001)。该基因在 菜薹中表达后产生的雄性不育植株在30~35℃/25~28℃的高温条件下自交全部不能结籽,没有育性恢复现象发生(曹必好和孟成民,2008)。本试验利用该基因获得的芥菜雄性不育植株的生长发育全程处于控温条件下的人工气候室内,其雄性不育性是否受田间温度变化的影响有待进一步研究。通过原位杂交和启动子报告基因的转基因分析显示,TA29基因专一性地在绒毡层细胞中表达,表达时期为减数分裂期到花粉壁增厚期(-1 到+6 期)(Koltunow et al.,1990)。但在棉花中的研究结果显示,该启动子除了在棉花花药中优势表达外,其控制的基因也会在棉花的叶片表皮毛和花粉中表达(尹梦回 等,2008)。同时,TA29-Barnase转基因棉花除花药干瘪、花粉无活力外,也表现出花朵变小、花丝变短等现象(Zhang et al.,2007),这与本试验所获得的芥菜雄性不育转基因植株的花器官类似。但本试验获得的雄性不育芥菜植株除了上述特点外,还出现了雌蕊偏短、种荚变短的现象,说明TA29-Barnase基因在芥菜中表达后,对非靶标组织的影响相对其他已报道的植物更大。因此,在利用Barnase基因创建芥菜雄性不育系时,有必要寻找更为严谨的绒毡层启动子表达Barnase基因,减少对花器官中非靶标细胞、组织发育的影响,获得结籽能力正常的雄性不育系,从而实现一代杂种的经济有效地繁育。
白玲,刘凡,李锁平,曹鸣庆.2002.农杆菌介导Barnase基因转化番茄.河南大学学报:自然科学版,32(3):16-19.
曹必好,雷建军,宋洪元,秦耀国.2003.芥菜农杆菌高效遗传转化体系初步建立.华南农业大学学报:自然科学版,4(4):48-51.
曹必好,孟成民.2008.TA29-Barnase基因转化菜心.生物工程学报,25(5):881-886.
李胜国,刘玉乐,朱锋,罗玉英,康良仪,田波.1995.基因工程雄性不育烟草的获得.植物学报,37(8):659-660.
沈革志,王新其,朱玉英,杨红娟,陆桂华,王江,宛新衫,张景六.2001.TA29-Barnase基因转化甘蓝产生雄性不育植株.植物生理学报,27(1):43-48.
宋洪元,任雪松,司军,李成琼,宋明,雷建军.2010.利用Cre/lox 重组系统获得烟草TA29-Barnase基因工程雄性不育恢复系.农业生物技术学报,18(3):468-475.
王关林,方宏筠.2002.植物基因工程.北京:科学出版社:742-744.
杨景华,张明方,喻景权,陈竹君.2006.茎用芥菜细胞质雄性不育系及其保持系SPOROCYTELESS基因研究.园艺学进展,(7):416-419.
尹梦回,董静,李先碧,侯磊,罗明,李德谋,裴炎,肖月华.2008.烟草绒毡层特异启动子pTA29在棉花中的表达特性.作物学报,34(12):2092-2098.
钟蓉,刘玉乐,朱锋,李胜国,康良仪,罗鹏.1996.TA29-Barnase基因导致油菜雄性不育的研究.植物学报,38(7):582-585.
邹瑞昌,万正杰,徐跃进,杨文杰,傅延栋.2012.新型叶用芥菜细胞质雄性不育系0912A 的花药发育特征.华中农业大学学报,31(1):44-49.
Kempken F.2010.Engineered male sterility.Genetic Modification of Plants-Biotechnology in Agriculture and Forestry,64(2):253-265.
Koltunow A M,Truettner J,Cox K H,Wallroth M,Goldberg R B.1990.Different temporal and spetial gene expression patterns occur during anther development.Plant Cell,2:1201-1224.
Mariani C,de Beuckeleer M,Truettner J,Leemans J,Goldberg R B.1990.Induction of male sterility in plants by a chimaeric ribonuclease gene.Nature,347:737-741.
Reynaerts A,van de Wiele H,de Sutter G,Janssens J.1993.Engineered genes for fertility control and their application in hybrid seed production.Scientia Horticulturae,55:125-139.
Yang J H,Liu X Y,Yang X D,Zhang M F.2010.Mitochondrially-targeted expression of a cytoplasmic male sterility-associatedorf220gene causes male sterility inBrassica juncea.BMC Plant Biology,10:231.
Zhang H J,Wang H Y,Shi Y J,Zhang Y M,Yue J X,Wu S J,Zhu Y H,Liu Y L,Yang H Y.2007.Cotton genetic tranformation ofBarnasemale sterility gene.Cotton Sci,19(4):261-266.
