p H对粪肠球菌高产双乙酰的影响
2013-02-20杨丽杰霍贵成
郑 遂,康 欢,赵 蕊,杨丽杰,霍贵成*
(1.乳品科学教育部重点实验室,哈尔滨 150030;2.东北农业大学食品学院,哈尔滨 150030)
双乙酰是乳制品中的重要风味化合物[1-2]。和许多风味物质一样,其可经化学方法生产,但更好方法是在乳酸菌(Lactic acid bacteria,LAB)中天然产生[3]。产双乙酰支路的反应物依次为:柠檬酸和(或)葡萄糖、丙酮酸、α-乙酰乳酸(αacetolactate,α-AL)、双乙酰(及与其竞争的乙偶姻),相应的酶分别为柠檬酸渗透酶(Citric permease,CIT)、α-AL合成酶(α-AL synthetase,ALS)和 乳 酸 脱 氢 酶(Lactate dehydrogenase,LDH)、 AL脱 羧 酶(Acetolactate decarboxylase,ALD)和双乙酰还原酶(Diacetyl reductase,DR),其酶活与菌数是双乙酰高产与否的内因。此外,pH、温度、O2等为外因[4]。
已有很多以高产双乙酰为目的LAB相关研究,乳酸乳球菌(Lactococcus lactis)方向研究很多[5]。但对粪肠球菌(Enterococcus faecalis)研究很少。其在干酪的柠檬酸代谢与脂解中起作用进而影响其风味,在一些干酪(如Greek Feta、Mediterranean、Mozzarella、Cebreiro干酪)中含量丰富,并可产生抑菌物质,已有将其开发为保健酸奶发酵剂的研究[6]。
本文以东北农业大学乳品科学教育部重点实验室从内蒙古农家酸马奶中筛选的野生粪肠球菌及其NTG诱变株为出发菌株,探索两者生产双乙酰的机理,比较分析pH、生长情况等重要因素对产双乙酰的影响,确定最优产双乙酰条件及其最大产量,以期为开发产香型肠球菌发酵剂提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌种
研究菌种为东北农业大学乳品科学教育部重点实验室保存的Enterococcus faecalis KLDS 4.1004,分离自内蒙古农家酸马奶,以及经NTG诱变筛选获得的诱变株KLDS 4.1003。
1.1.2 试剂与培养基
双乙酰、乙偶姻标样为色谱纯(Sigma公司),其他试剂均为分析纯。MRS、平板计数培养基等均按照凌代文等的方法配制[7]。
1.1.3 仪器
DELTA 320 pH计,PL2002分析天平,Allegra 64R台式高速冷冻离心机,BCN1360型生物洁净工作台,SPX-150B生化培养箱,HIRAYAMA HVE-50高压灭菌器,ZHWY-100B摇床振荡培养箱,DU-800紫外分光光度计。
1.2 方法
1.2.1 菌株培养及计数
将出发菌株以2%比例接种到11%脱脂乳中,在37℃恒温培养箱中培养至凝固,反复2~3次完成菌种的活化。菌体培养、生长速度测定及计数均为常规方法。
1.2.2 代谢相关酶活力的测定
1.2.2.1 无细胞提取液的制备
将1.5 mL出发菌过夜培养物加入150 mL发酵培养基中,每个培养物对应4瓶培养基。在37℃下,摇床培养48 h(180·rev-1)后,以5 000×g离心5 min收获细胞,随后在10 mL缓冲液(pH 7.0的100 mmol·L-1磷酸钠,含0.1 mg溶菌酶·mL-1)中扩增并于室温下培养15 min。悬浮物经超声破碎2 min后以15 000×g离心15 min,其上清液用作酶活测定。
1.2.2.2 酶活测定
按照Stormer的方法测定ALD酶活力[8],对其中部分步骤进行了修改。将1单位酶活定义为每分钟将AL催化成1 μmol乙偶姻所需要的量,制备10 mmol·L-1α-AL底物液和显色反应液,将0.2 mL前者加入0.2 mL无细胞提取液或0.1 mol·L-1磷酸钠溶液(pH 7.0,含0.1 mg·mL-1溶菌酶)(作为空白对照)中,30℃水浴20 min。加入4.5 mL显色反应液来终止反应,检测OD522值。
按照Cogan的方法测定LDH、DR酶活力[9],对其中部分步骤进行修改。将1单位酶定义为每分钟1 μmol消耗或生成的NADH,应用分光光度法测定酶活,将0.1 mL无细胞提取液与2.9 mL反应混合液于培养皿中作用,并检测随后10 min的OD340值。LDH酶活检测反应液为100 mmol·L-1磷酸钠(pH 7.0)、10 mmol·L-1丙酮酸钠和0.15 mmol·L-1NADH,DR的为100 mmol·L-1磷酸钠(pH 7.0)、10 mmol·L-1双乙酰和0.15 mmol·L-1NADH。
用Bradford法测定蛋白质浓度,标准物为牛血清白蛋白。
1.2.3代谢物含量测定
双乙酰和乙偶姻含量均采用经典蒸馏比色法进行测定[10]。使用色谱纯级标样,标准曲线线性佳。
所有试验数据均重复3~6次。
2 结果与分析
2.1 pH对双乙酰产量的影响
2.1.1 pH对酶活的影响
综合考虑以往LAB研究及市售乳制品pH,选择4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0共 8个点,对野生株KLDS 4.1004和诱变株KLDS 4.1003进行对比酶活分析,目标酶为与产双乙酰/乙偶姻相关的LDH、ALD和DR,结果见图1。
由图1可知,pH 8.0以外的7个点,不利于双乙酰高产的3个酶之活力均为诱变株<野生株(诱变株中ALD灭活,故图中未显示;pH 7.5时虽然极不明显,但确有差别),3个酶起作用的顺序及机理如图2所示,故可以推测诱变株的产双乙酰能力强于野生株。从野生株单独看,DR活力从4.5~7.0一直下降,ALD活力以6.0和7.0为转折点,先升后降再升,LDH趋势更多变;pH 7.0时ALD、DR活力最低,仅为0.040 U·mg-1,但LDH活力不如7.5、8.0时低;而pH 7.5时LDH活力最低,仅为0.041 U·mg-1,但ALD和DR均为倒数第二低,故有必要在以下结果中比较两者的产双乙酰情况。从诱变株单独看,其ALD失活,这非常有利于双乙酰高产,DR活力从4.5到7.0有稳有降,LDH活力从4.5到7.0趋势为先大幅提升,而后保持平稳,大幅下降直到7.0时最低;pH 7.0时DR、LDH活力均最低,仅为0.031和0.020 U·mg-1,故推测此pH点的双乙酰产量最高;而pH 6.5时两酶活力均为次低。

图1 pH对KLDS 4.1004与4.1003相关酶活的影响Fig.1 Effect of pH on the enzymatic activities of KLDS 4.1004 and KLDS 4.1003
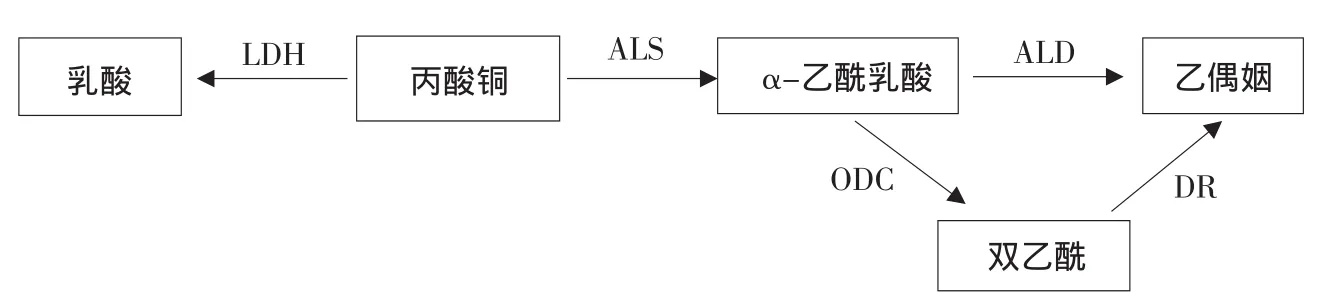
图2 产双乙酰代谢通路及相关酶Fig.2 Schematic representation of the diacetyl production metabolism and related enzymes
2.1.2 pH对菌体生长及代谢产物的影响
菌体产双乙酰能力还要考虑菌体生长情况,故对两菌在8个pH点进行最大生长速度和最大细胞计数进行对比测定,同时检测出各pH点的最大双乙酰产量及相应的乙偶姻量,结果见图3与表1。
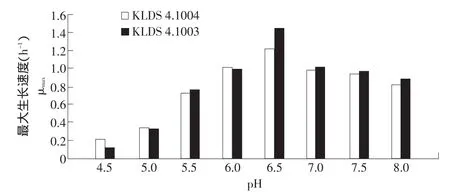
图3 不同pH时KLDS 4.1004与4.1003的最大生长速度Fig.3 μmax of KLDS 4.1004 and KLDS 4.1003 under different pH values
由图表可见,6.5时两菌的最大生长速度和最大细胞计数均最大,分别为1.22、1.45 h-1和3.1×109、3.5×109cfu·mL-1,其次为 pH 6.0、7.0、7.5时,最低为pH 4.5时。比较两菌的最大生长速度,可发现4.5、5.0、6.0等3个点为野生株>诱变株,但相差不明显;另外4个点为诱变菌>野生菌,且pH 6.5时差距较大。两者的计数情况与生长速度基本相符。
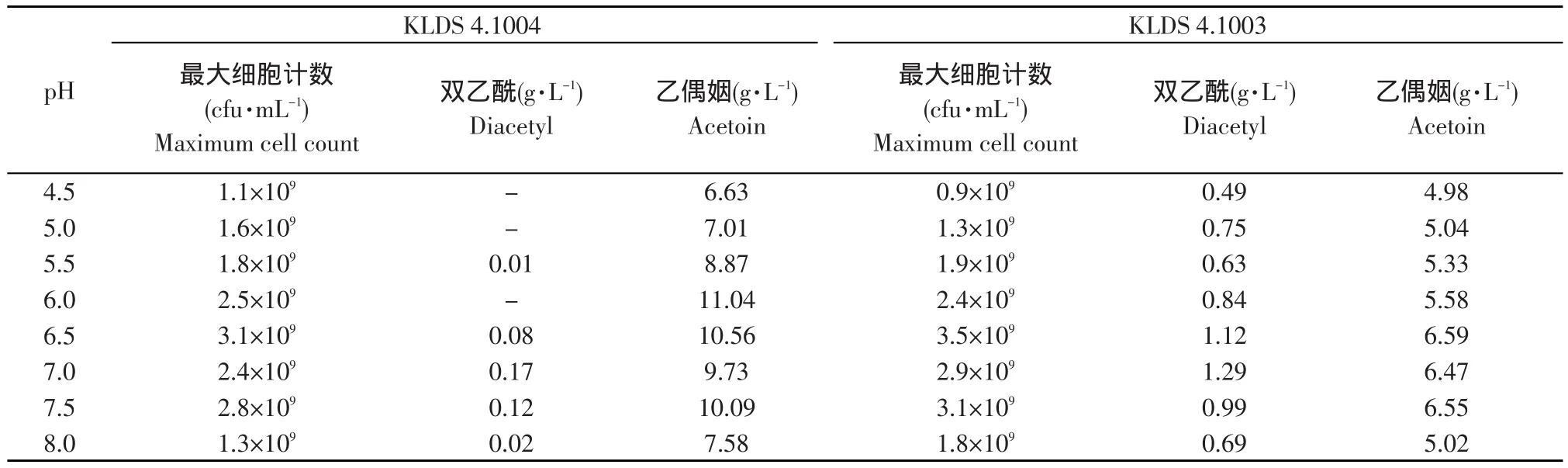
表1 pH对KLDS 4.1004与4.1003菌数及代谢产物的影响Table 1 Effect of pH on cell count and metabolites of KLDS 4.1004 and 4.1003
诱变株的双乙酰产量在所有点均远大于野生株的,在6.5、7.0、7.5时尤其明显,另外4.5、5.0、6.0时野生株中检测不到双乙酰,而诱变株则可检测到,且4.5时的最低双乙酰产量0.49 g·L-1,也约为野生株最高产量0.17 g·L-1(pH 7.0时)的3倍。5.0和5.5时的诱变株双乙酰产量差异,在于菌数不同和pH对3酶以外酶的作用。6.0时野生株不产双乙酰而诱变株产,可看出ALD对双乙酰生成的重要意义。综合考虑,可见6.5、7.0是研究重点,7.0时是因为此时酶活合适、6.5时是因为菌数较多。
乙偶姻产量均为野生株>诱变株,在6.0时最高,达到11.04 g·L-1,此时检测不到双乙酰,可见碳流全部流向乙偶姻,4.5、5.0时碳流也如此。此外,野生株的最低乙偶姻量(pH 4.5,6.63 g·L-1)比诱变株的最高量(pH 6.5时,为6.59 g·L-1)都高。乙偶姻、双乙酰的总量及两者比例,是菌生长和酶活综合作用的结果,对发酵风味有重要影响。虽然乙偶姻也有风味效果,但约为双乙酰的1/100,故要尽量多产双乙酰而少产乙偶姻。
2.2 pH 6.5、7.0时诱变株的产双乙酰情况
为进一步综合研究粪肠球菌高产双乙酰以期达到最优值,选择诱变株表现最好的pH 6.5、7.0,分别在4、8、12、16、20、24 h等6个时间点检测菌数及双乙酰产量变化(生长温度为粪肠球菌最适温度37℃)[11],结果见图4、5。
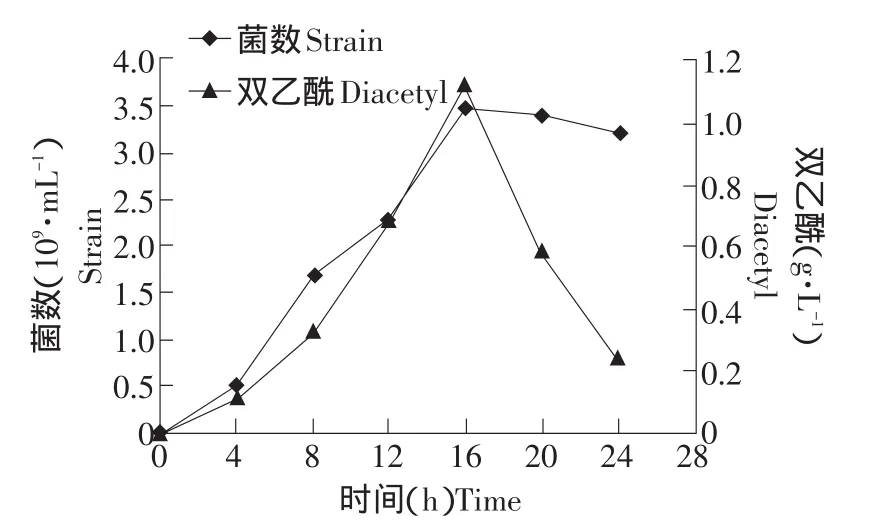
图4 pH 6.5时KLDS 4.1003的菌数及双乙酰产量变化曲线Fig.4 Counts and diacetyl production curve of KLDS 4.1003 under pH 6.5
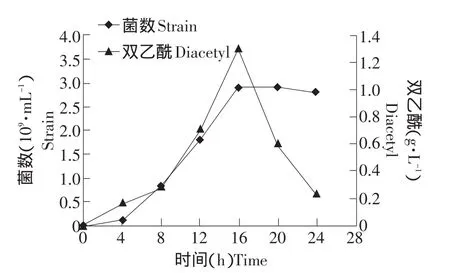
图5 pH 7.0时KLDS 4.1003的菌数及双乙酰产量变化曲线Fig.5 Counts and diacetyl production curve of KLDS 4.1003 under pH 7.0
由图4、5可见,菌数和双乙酰的最高值在pH 6.5、7.0点均出现于16 h,分别为3.5×109mL-1、1.12 g·L-1和2.9×109mL-1、1.29 g·L-1,并且趋势也基本相同。菌数区别在于,6.5时前4 h增长大于7.0时的,16~20 h的下降大于7.0时;双乙酰产量区别在于,6.5时最后4 h的下降趋势没有7.0时明显。从菌数与双乙酰产量关系来看,前16 h时两者保持对应关系,即双乙酰产量随菌数增多而提高,而最后8 h菌数基本保持稳定,但双乙酰产量大幅下降,说明有限的底物空间与营养中,菌数过多导致平均产双乙酰能力均很低。
3 讨论与结论
高产双乙酰的前提是丙酮酸的积累,高产双乙酰最理想菌株为CIT和ALS活力很高,LDH、ALD、DR活力极低甚至灭活[12],但尚未见报道具备以上所有条件的菌株,因为即使获得该菌株,也会因酶变过多而导致生长缓慢、无法传代、代谢紊乱等诸多问题。本试验所用的诱变株KLDS 4.1003具有CIT活力高(资料未显示)、LDH、DR活力低及ALD灭活等有利特点,其发酵产双乙酰量可高达1.29 g·L-1。
虽然这与以往研究中的基因调控Lactococcus lactis的双乙酰产量相比较低[13],但除菌种本身特点(生长特性及酶活)外,还因为本研究未通过添加血红素、柠檬酸、极限有氧呼吸等方式以及基因操作来加大产量。因此,本试验最接近乳制品的自然发酵,且目标菌株是GRAS,因此对开发产香型益生发酵剂具有理论指导意义,同时丰富了LAB丙酮酸代谢理论。
在后续研究中,可针对乳制品(如干酪)发酵的具体条件,进一步考虑其他实际因素对风味形成的影响;还可与杆菌共生来协同提高双乙酰产量并研究柠檬酸-葡萄糖的共发酵。在后基因组时代,可应用各级组学、GC-MS、NMR等高通量方法进行系统研究,从生物信息学、一般分子生物学方法和下游数据三个层面研究问题。
[1]Curioni P M G,Bosset J O.Key odorants in various cheese types as determined by gas chromatography-olfactometry[J].Int Dairy J,2002(12):959-984.
[2]Neves A R,Pool W A,Kok J,et al.Overview on sugar metabolism and its control inLactococcus lactis-The input fromin vivoNMR[J].FEMS Microbiol Rev,2005,29(8):531-554.
[3]Hugenholtz J.The lactic acid bacterium as a cell factory for food ingredient production[J].Int Dairy J,2008,18(5):466-475.
[4]Niel E W,Palmfeldt J,Martin R,et al.Reappraisal of the regulation of lactococcal L-lactate dehydrogenase[J].Appl Environ Microbiol,2004,70:1843-1846.
[5]Oliveira A P,Nielsen J,Forster J.Modeling Lactococcus lactis using a genome-scale flux model[J].BMC Microbiology,2005,39(5):39-44.
[6]Vaningelgem F,Ghijsels V,Tsakalidou E,et al.Cometabolism of citrate and glucose by Enterococcus faecium FAIR-E 198 in the absence of cellular growth[J].Appl Environ Microbiol,2006(1):319-326.
[7]凌代文.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:85-86.
[8]Stormer F C.2,3-Butanediol biosynthetic system in Aerobacter aerogenes[J].Methods Enzymol,1975,41:526-529.
[9]Cogan TM(1981)Constitutive nature of the enzymes of citrate metabolism in Streptococcus lactis ssp.diacetylactis[J].J Dairy Res,1981,48:489-495.
[10]Boumerdassi H,Monnet C,Desmazeaud M,et al.Effect of citrate on production of diacetyl and acetoin by Lactococcus lactis ssp.lactis CNRZ 483 cultivated in the presence of oxygen[J].J Dairy Sci,1997,80:634-639.
[11]Repizo G D,Mortera P,Magni C.Disruption of the alsSD operon of Enterococcus faecalis impairs growth on pyruvate at low pH[J].Microbiol,2011,157:2708-2719.
[12]Gaspar P,Neves A R,Ramos A,et al.Engineering Lactococcus lactis for production of mannitol:High yields from food-grade strains deficient in lactate dehydrogenase and the mannitol transport system[J].Appl Environ Microbiol,2004,70:1466-1474.
[13]付良,刘飞,霍贵成.乳酸乳球菌抗氧化的研究进展[J].东北农业大学学报,2009,40(6):132-136.
