稀有人参皂苷C-K转化菌株的筛选鉴定及其转化特性
2013-02-19赵雪淞胡彦波周义发
赵雪淞, 梁 飞, 胡彦波, 梦 月, 周义发
(1.辽宁工程技术大学 矿业学院,辽宁 阜新 123000;2.东北师范大学 生命科学学院,吉林 长春130024)
人参是百草之王,在我国已有2000多年的药用历史,具有多种药理学活性,对神经系统、内分泌系统、循环系统及免疫系统等均有作用。人参皂苷是人参的主要活性成分,从人参中分离出的人参皂苷有40余种[1]。近年来的研究发现,有些在人参中含量很低的稀有人参皂苷如Rg3、C-K、Rh2等具有优异的抗肿瘤活性,可抑制肿瘤细胞的增殖,抑制癌细胞转移、诱导肿瘤细胞凋亡和抗肿瘤诱导的血管新生等,有重要的药用价值[2-5]。但是,稀有人参皂苷在人参中的含量太低,无法从人参中直接提取,而现有的化学合成技术还无法实现工业化生产,因此,如何高效大量制备稀有人参皂苷成为科学研究的焦点。
稀有人参皂苷的化学结构与人参中某些含量高的人参皂苷(如Rb1)相比,只是缺少了一个或几个糖基。理论上可以通过改变某些高含量人参皂苷的结构来获得稀有人参皂苷。结构修饰的方法主要有化学转化法和生物转化法。生物转化法具有反应条件温和、专一性强、得率高等优点,是获得稀有人参皂苷的有效途径,而优良菌种或菌株的筛选是生物转化成败的关键因素[6]。人参中含量最高的人参皂苷是Rb1,其糖基的连接键为β-葡萄糖苷键,微生物中β-葡萄糖苷酶酶活高的菌种主要是霉菌[7],因此霉菌是筛选转化菌株的良好来源。在作者所在研究团队以前的研究中,已经发现了一些优良的稀有人参皂苷转化菌株及其转化酶[8-10]。作者从10种霉菌中筛选出1种能转化高含量的原人参二醇型皂苷为稀有人参皂苷C-K的菌株,并结合形态学和分子生物学技术进行了菌种鉴定,继而研究了该菌的转化特性。研究结果为稀有人参皂苷C-K的大量制备奠定了基础。
1 材料与方法
1.1 材料与试剂
10种霉菌,采自长春市郊茄科植物病原组织,PDA培养基4℃暗保存;人参皂苷标准品,购自成都曼斯特生物技术有限公司;人参皂苷混合物及人参皂苷单体,由作者所在实验室制备,具体制备方法参见文献 [11];DNA marker,Invitrogen公司提供;凝胶回收试剂盒,QIAGEN公司提供;CTAB,Amresco公司提供;氯仿、甲醇等化学试剂,均为北京化工厂生产。
1.2 仪器与设备
BCN-1360B生物超净工作台,北京东联哈尔仪器制造有限公司制造;YXQ-LS-30SII立式压力蒸汽灭菌器,上海博讯实业公司制造;HZQ-C空气浴振荡器,哈尔滨市东明医疗仪器厂制造;Z36HK低温高速离心机,德国Hermle制造;倒置荧光显微镜,日本Olympus制造;DYCP-31D水平电泳槽,北京市六一仪器厂制造;紫外/可见凝胶成像系统UVItec制造;PCR仪,ABI公司制造。
1.3 方法
1.3.1 分析方法 TLC分析采用G 60硅胶板,展开剂 CHCl3-MeOH-H2O(体积比 65∶35∶10,下层)。显色剂为体积分数5%硫酸乙醇,105℃加热5 min。展开方式为上行展开。
1.3.2 人参皂苷转化菌株的筛选 供试菌种置于V8汁液体培养基中振荡培养,130 r/min,28℃,培养 8 d 后,纱布过滤,8 000 g、4 ℃、离心 20 min,弃去上清,得到孢子。将孢子悬浮在20 mmol/L醋酸-醋酸钠缓冲液(pH 5.0)中,在 130 r/min、28 ℃条件下振荡培养24 h,然后加入人参皂苷储备液(人参皂苷样品溶于pH 5.0 20 mmol/L的醋酸-醋酸钠缓冲液中并通过0.2 μm的滤膜过滤除菌),使孢子的终浓度为5×106个/mL,底物的终质量浓度为0.25 mg/mL,继续振荡培养0~5 d。从加入人参皂苷的0时开始取样,每隔24 h取样一次,加入等体积的正丁醇萃取,上层正丁醇相减压蒸干,重新溶于质量分数40%乙腈水溶液中,TLC检测转化结果。
1.3.3 菌种形态鉴定 PDA培养基接种3.26号霉菌,30℃恒温培养,观察菌落的形态、颜色;挑取菌丝,“Z”型接种,用灭菌的盖玻片垂直“Z”线插入到培养基中培养,取盖玻片显微观察。
1.3.4 菌种分子生物学鉴定 鉴定采用rDNA-ITS(18S rRNA基因-ITS)序列分析方法。具体方法为:V8汁液体培养基(1 L培养基含有200 mL V8汁和2 g CaCO3)30℃振荡培养3.26号菌株5 d,取菌丝体预冻后加液氮研磨,CTAB法提取霉菌DNA,质量分数0.5%琼脂糖凝胶电泳纯化。ITS基因的扩增使用 真 菌 通 用 引 物 , 正 向 引 物 (ITS1):5′-TCCGTAGGTGAACCTGCGG-3′,19bp; 反 向 引 物(ITS4):5′-TCCTCCGCTTATTGATATGC-3′,20 bp(http://www.biology.duke.edu/fungi/mycolab/primers.htm#Internal transcribed spacer (ITS) region primers)。ITS1和ITS4由上海生工生物工程有限公司合成。PCR反应条件:94℃预变性4 min,94℃变性 45 s,48 ℃退火 5 s,72 ℃延伸 3 min,30个循环,72℃终延伸10 min,4℃保温60 min。ITS扩增后的产物经质量分数1%的琼脂糖凝胶电泳后,回收条带送至北京鼎国生物技术有限责任公司测序。
1.3.5 人参皂苷水解酶制备 V8汁液体培养基,130 r/min、30℃恒温振荡培养5 d。发酵液经6层纱布过滤、离心(4 ℃、1 200 r/min、20 min)后得到粗酶液。粗酶液中加入体积分数5%的DEAE-纤维素4℃条件下振荡吸附12 h,转入层析柱(Φ3.2 cm×28 cm),粗酶液中未结合的成分在装柱过程中流出,结合在DEAE-纤维素上的成分以含有 0、0.25、0.5、0.75、1 mol/L NaCl的缓冲液 A(25 mmol/L pH 5.0,NaAc-HAc)进行梯度洗脱,洗脱体积流量为3 mL/min,每个梯度洗脱2倍柱体积,洗脱液每50 mL收集一管。收集有酶活性的级分、透析(透析液为缓冲液A,4℃透析24 h)后得到部分纯化的人参皂苷水解酶E-I。该酶的制备过程以A280nm处紫外光吸收值表征各级分的蛋白质含量,以对硝基苯酚-β-D-葡萄糖苷(pNPG)法表征酶活性。
1.3.6 转化途径分析 4 mg/mL人参皂苷250 μL和2 250 μL酶液在40℃保温,然后加入等体积的正丁醇终止反应。正丁醇相进行TLC分析。
1.3.7 最适pH值和最适反应温度测定 酶的最适pH值测定选用pH 2.0~8.0的25 mmol/L Na2HPO4-柠檬酸缓冲液,1个pH值为一个梯度。测定方法为:取各pH值的Na2HPO4柠檬酸缓冲液450 μL(pH 分别为 2.5~8.0), 加入纯化后的 GE-I 20 μL,再加入pNPG 30 μL,37℃保温1 h后,加入2.5 mL NaOH(0.25 mol/L)终止反应,测定酶活力。最适合pH值下的酶活力记作100%,其他pH值下的酶活力为其相对百分比。酶的最适反应温度测定选用30~80℃,5℃为一个梯度。测定方法为取450 μL醋酸-醋酸钠缓冲液(pH 5.0),加 20 μL GE-I,30 μL pNPG(5 mg/mL),各自温度下避光反应 1 h,然后加入2.5 mL NaOH(0.25 mol/L)溶液终止反应,测定酶活力。最适温度下的酶活力记作100%,其他温度下的酶活力为其相对百分比。
2 结果与讨论
2.1 转化菌株的筛选
因为分离纯化得到人参皂苷单体的成本较高,此步试验采用人参皂苷Rb1、Rb2、Rc和少量Rd的混合物为底物,从10种霉菌中筛选稀有人参皂苷C-K转化菌株。图1显示了转化5 d后的结果:3.23、3.24、3.25、3.26、3.27 和 3.28 号菌株能够转化底物,产生低极性的转化产物,但是只有3.26号菌株能够转化底物为稀有人参皂苷C-K,其转化途径可能是:原人参二醇型皂苷→Rd→F2→C-K。因此,选择3.26号菌株作进一步研究。
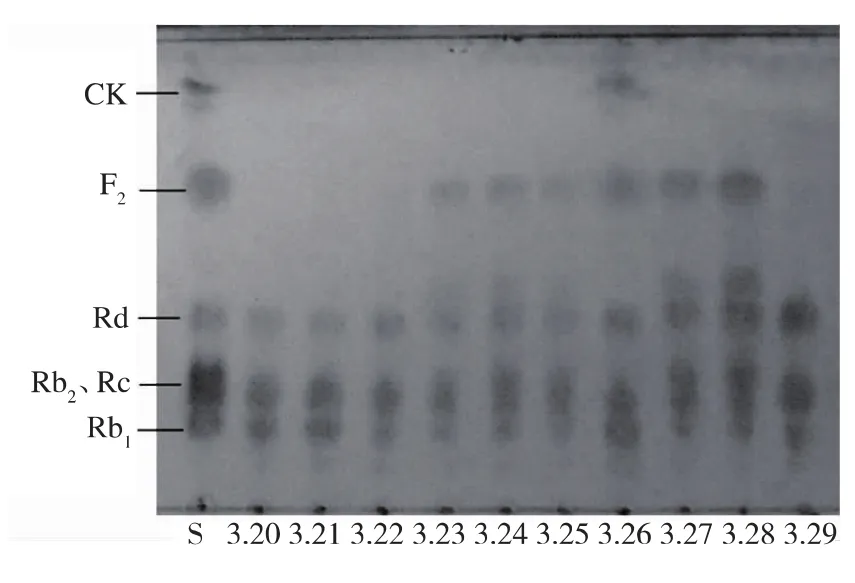
图 1 TLC分析10种霉菌生物转化人参皂苷 Rb1、Rb2、Rc和Rd的转化产物(S代表标样)Fig.1 TLC Analysis of the products of biotransformation of ginsensodies Rb1、Rb2、Rc and Rd by 10 fungi(S represents standard ginsenosides)
2.2 菌种鉴定
2.2.1 形态鉴定 3.26号菌株的菌落初呈白色、绒毛状,培养 7 d后,菌落颜色略显红色(图 2(a))。 显微观察菌丝的形态,有不规则的砖壁状横隔,分生孢子散落,颜色较深(图 2(b)(c))。经查找真菌鉴定手册[12],该菌的形态特征与半知菌类丛梗孢目瘤座孢科附球霉属(Epicoccum)真菌相近。
2.2.2 分子生物学鉴定 ITS(Internal Transcribed Spacer,内转录间隔区)序列分析是当前真菌鉴定的重要手段。由于真菌核糖体DNA ITS区序列在生物进化过程中高度保守,因此,即使是亲缘关系非常接近的2个种都能在ITS序列上表现出差异,显示最近的进化特征。作者用CTAB法提取3.26号菌株的基因组DNA,质量分数0.5%琼脂糖凝胶电泳,发现该菌的基因组 DNA 大约 14 000 bp(图 3(a)),将其作为PCR模板扩增ITS基因,PCR产物与DNA marker比较, 大小在 500~650 bp 之间 (图 3(b))。PCR产物回收后测序,然后登录GenBank数据库,将测序结果用Blast进行同源性分析,发现与附球霉属菌株Epicoccum sp.SP3 18S rRNA基因的相似度为99%(图4)。上述结果说明,3.26号菌株为半知菌类丛梗孢目瘤座孢科附球霉属(Epicoccum)真菌。

图2 3.26号菌株的菌落和菌丝B和C(10×40倍)形态Fig.2 Shapes of colony and hyphae of strain sp.3.26
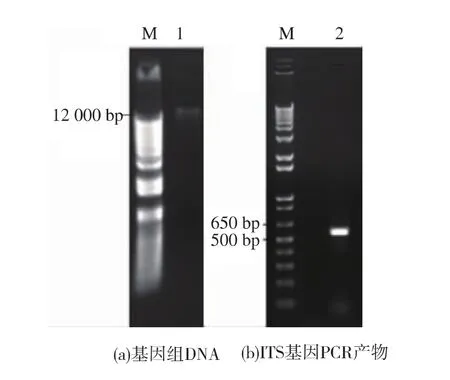
图3 3.26号菌株基因组DNA电泳图谱和ITS基因PCR产物电泳图谱Fig.3 AgarosegelelectrophoresisofgenomeDNA extracted from strain sp. 3.26 and PCR production of ITS gene

图4 3.26号菌株ITS序列与Epicoccum sp.SP3比对结果Fig.4 Sequence alignment of ITS sequences obtained from strain sp.3.26.The ITS sequences of strain sp.3.26 are aligned with those of Epicoccum sp.SP3
2.3 人参皂苷水解酶的制备
因为酶转化法有流程短、产率高、产物易分离纯化、不需要无菌操作等优点[13],同时为了进一步验证3.26号菌株的转化能力和转化途径,从3.26号菌株的培养液中分离制备了人参皂苷水解酶粗酶E-I。从图5可以看出,经DEAE-纤维素柱层析后,在氯化钠溶液浓度为0.25 mol/L时有酶活峰出现,收集酶活峰,记为E-I。
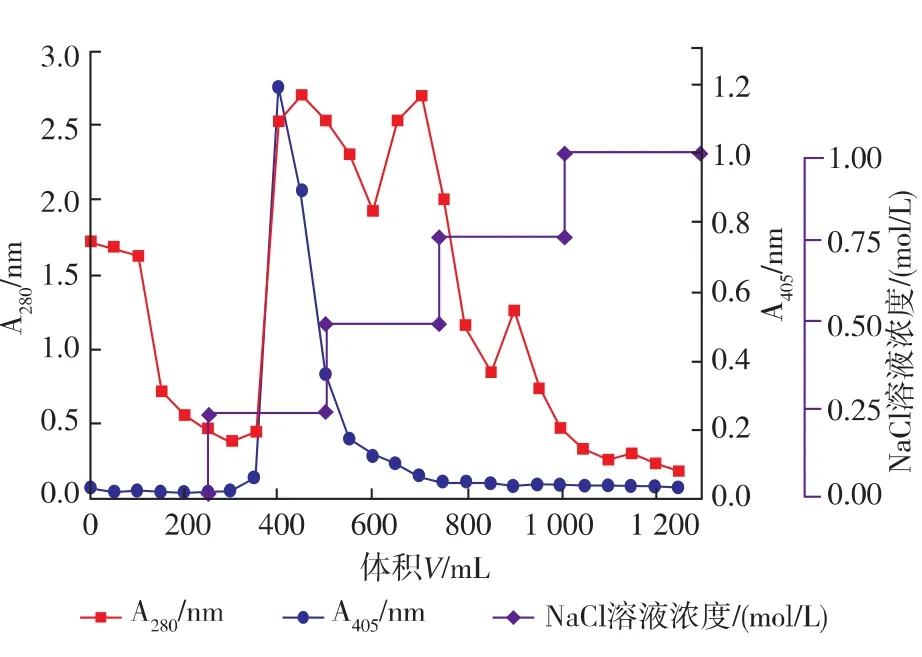
图5 DEAE-纤维素离子交换层析制备人参皂苷水解酶E-IFig.5 Preparation of ginsenoside-hydrolyzing enzyme EI by Ion-exchange chromatography on DEAE-cellulose
2.4 人参皂苷水解酶E-I的最适pH值和最适温度
从图6可以看出,E-I的最适pH值为5.0,最适温度为40℃。已有研究表明,大部分β-葡萄糖苷酶均为酸性蛋白质,最适pH值大都在酸性范围内,最适温度分布在30~110℃[14]。本研究结果符合这一规律。
2.5 转化途径分析
用人参皂苷水解酶E-I在上述最适pH值和温度条件下分别转化人参皂苷Rb1和Rb2、Rc混合物,TLC检测结果。如图7所示,人参皂苷Rb1的转化产物有3种:Rd、F2和C-K,转化6 h后,产生Rd和F2,转化12 h后,出现第3种产物C-K,转化48 h后,底物人参皂苷Rb1和产物Rd完全消失,剩下产物 F2和 C-K(图 7(a));人参皂苷 Rb2和 Rc 的转化产物与人参皂苷Rb1的转化产物相同。不同的是,人参皂苷Rb2和Rc的转化效率明显低于Rb1,Rb2和Rc转化24 h后才有少量C-K出现,转化48 h后,仍然存在很多Rd(图7(b))。上述结果说明:3.26号菌株能够转化高含量的原人参二醇型皂苷为稀有人参皂苷C-K,转化途径为:原人参二醇型皂苷→Rd→F2→CK;3.26号菌株分泌的糖苷酶具有广泛的底物专一性,但是对葡萄糖苷键的专一性更高。因为,原人参二醇型皂苷Rb1、Rb2和Rc具有共同的苷元(原人参二醇)和 C-3 位的糖链(Glc β-(1,2)-Glc),不同之处在于C-20位的糖链:Rb1的C-20位是2个葡萄糖以β(1→6)糖苷键相连接,Rb2的C-20位是一个吡喃型阿拉伯糖和一个葡萄糖以α(1→6)糖苷键相连接,Rc的C-20位是一个呋喃型阿拉伯糖和一个葡萄糖以α-(1→6)糖苷键相连接(图8),而该菌分泌的糖苷酶既能水解人参皂苷Rb1 C-20位的糖链,也能水解Rb2和Rc C-20位的糖链,说明其具有广泛的底物专一性。
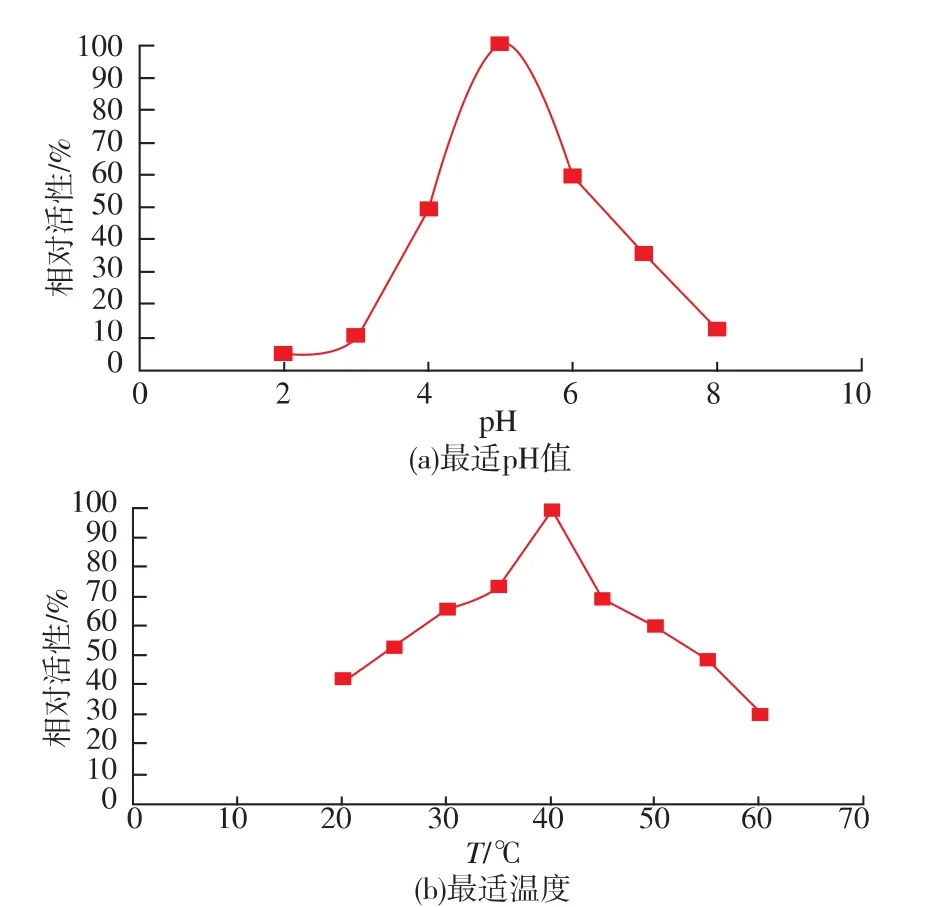
图6 E-I的最适pH值和最适温度Fig.6 Optimal pH and temperature of E-I

图7 TLC分析E-I对人参皂苷Rb1和Rb2、Rc的转化Fig.7 TLC Analysisofthe biotransformation of ginsensodies Rb1and Rb2、Rc by E-I
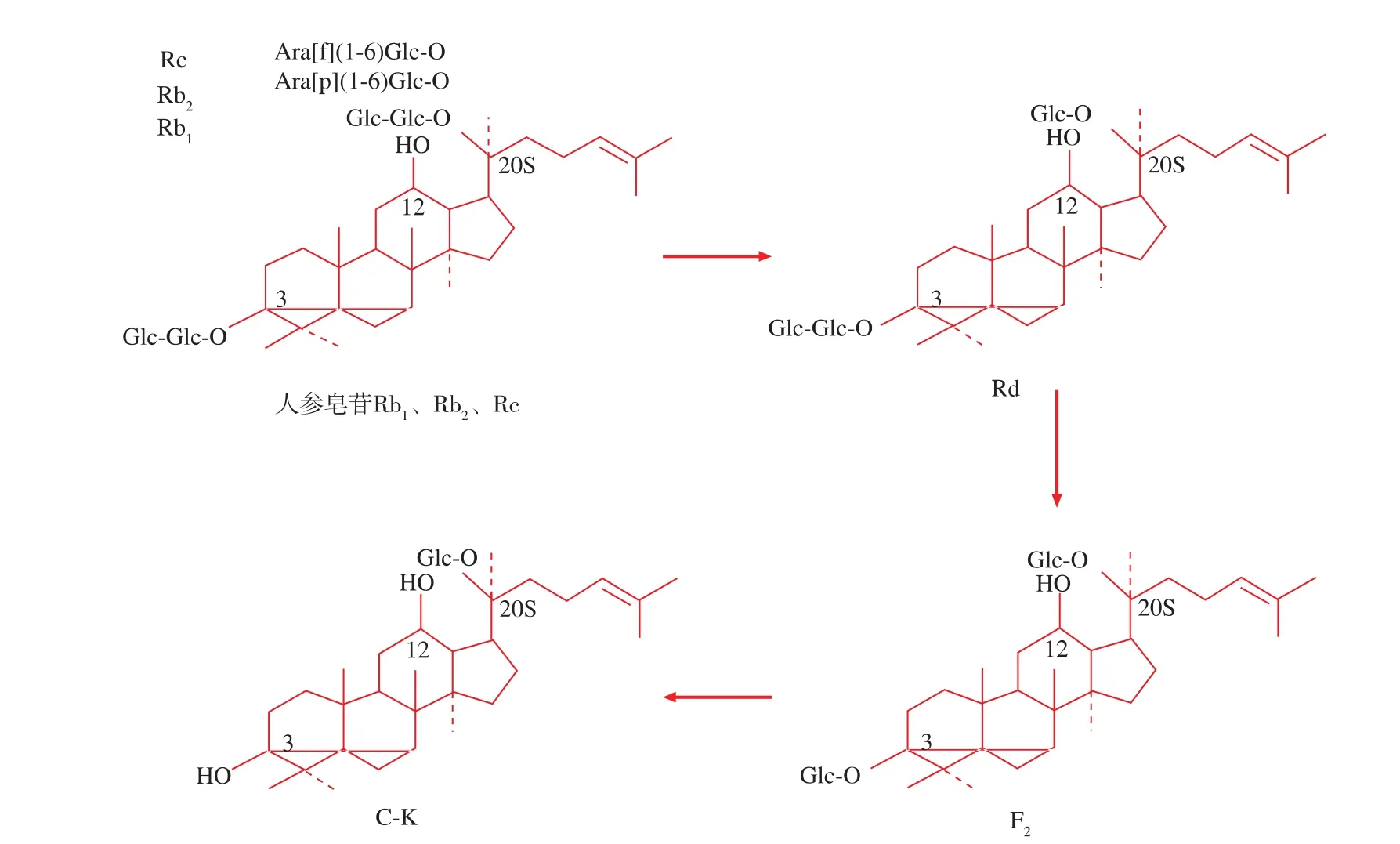
图8 3.26号菌株转化原人参二醇型皂苷的转化途径Fig.8 Biotransformation pathways of protopanaxadiol-type saponins by strain sp.3.26
3 结语
从10种霉菌中筛选出1种能够生物转化主要的人参皂苷Rb1、Rb2和Rc为稀有人参皂苷C-K的3.26号菌株。经形态学和ITS基因序列分析,确定3.26号菌株属于附球霉属(Epicoccum)真菌。采用DEAE-纤维素离子交换层析,从3.26号菌株的培养液中分离出人参皂苷水解酶粗酶E-I,确定E-I的最适pH值和最适温度分别为pH 5.0和40℃。在上述最适条件下,用E-I对该菌转化人参皂苷的具体途径进行研究,发现该菌产生的糖苷酶具有广泛的底物专一性,它既能水解人参皂苷Rb1,也能水解Rb2和Rc。3.26号菌株对人参皂苷的生物转化途径为:人参皂苷 Rb1、Rb2、Rc→Rd→F2→C-K。 该菌能将主要的原人参二醇型皂苷都转化为C-K,使得可以采用原人参二醇型皂苷混合物为底物进行生物转化,大大降低了人参皂苷分离纯化的成本,而采用粗酶进行转化,明显提高了C-K产率,同时节省了分离纯酶的成本。3.26号菌株的转化特性非常有利于稀有人参皂苷C-K的工业制备。
[1]Fuzzati N.Analysis methods of ginsenosides[J].Journal of Chromatography B,2004,812:119-133.
[2]Suda K,Murakami K,Hasegawa H,et al.Induction of apoptosis in Lewis lung carcinoma cells by an intestinal bacterial metabolite produced from orally administered ginseng protopanaxadiol saponins[J].Journal of Traditional Medicines,2000,17(6):236-244.
[3]Choi K,Kim M,Ryu J,et al.Ginsenosides compound K and Rh2inhibit tumor necrosis factor-α-induced activation of the NF-κB and JNK pathways in human astroglial cells[J].Neuroscience Letters,2007,421:37-41.
[4]Nakata H,Kikuchi Y,Tode T,et a1.Inhibitory effects ofginsenoside Rh2 on tumor growth in nude mice bearing human ovarian cancer cells[J].Cancer Science,1998,89(7):733-740.
[5]Shinkai K,Akedo H,Mukai M,et al.Inhibition of in vitro tumor cell invasion by ginsenoside Rg3[J].Cancer Science,1996,87:357-362.
[6]李学,臧埔,张连学,等.微生物转化法制备人参皂苷Compound K的研究进展[J].食品科学,2012,33(11):323-327.LI Xue,ZANG Pu,ZHANG Lian-xue,et al.Research progress on ginsenoside CK production by microbial transformation[J].Food Science,2012,33 (11):323-327.(in Chinese)
[7]朱龙宝,汤斌,陶玉贵,等.黑曲霉β-葡萄糖苷酶基因克隆及在毕赤酵母中分泌表达[J].食品与生物技术学报,2012,31(9):973-977.ZHU Long-bao,TANG Bin,TAO Yu-gui,et al.Cloning and secreting expression of the β-Glucosidase gene from Aspergillus niger in Pichia pastoris GS115[J].Journal of Food Science and Biotechnology,2012,31(9):973-977.(in Chinese)
[8]ZHAO Xue-song,GAO Juan,LIU Hai-bo,et al.A highly selective ginsenoside Rb1-hydrolyzing β -D-glucosidase from Cladosporium fulvum[J].Process Biochemistry,2010,45(6):897-903.
[9]ZHAO Xue-song,GAO Ling,WANG Juan,et al.A novel ginsenoside Rb1-hydrolyzing β-D-glucosidase from Cladosporium fulvum[J].Process Biochemistry,2009,44(6):612-618.
[10]ZHAO Xue-song,WANG Juan,LI Jie,et al.Highly selective biotransformation of ginsenoside Rb1to Rd by phytopathogenic fungi Cladosporium fulvum (syn.Fulvia fulva)[J].Journal of Industrial Microbiology and Biotechnology,2009,36(5):721-726.
[11]赵雪淞,杜秀丽,高娟.人参锈腐病菌毁灭柱孢菌酶促降解人参皂苷研究[J].中国生物防治学报,2012,28(4):560-567.ZHAO Xue-song,DU Xiu-li,GAO Juan.Enzymatic degradation of ginsenosides by ginseng rust rot pathogen Cylindrocarpon destructans[J].Chinese Journal of Biological Control,2012,28(4):560-567.(in Chinese)
[12]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:405-641.
[13]Noh K H,Son J W,Kim H J,et al.Ginsenoside Compound K production from ginseng root extract by a thermostable β -glycosidase from Sulfolobus solfataricus[J].Bioscience Biotechnology and Biochemistry,2009,73:316-321.
[14]李华,高丽.β-葡萄糖苷酶活性测定方法的研究进展[J].食品与生物技术学报,2007,26(2):107-112.LI Hua,GAO Li.Research advance on methods of determining β -Glucosidase activity[J].Journal of Food Science and Biotechnology,2007,26(2):107-112.(in Chinese)
